Na2SO4胁迫对紫苏种子萌发及其幼苗生理特性的影响
2020-01-03高昆柳晓春
高昆 柳晓春


摘 要:以國产双色紫苏为材料,研究其在Na2SO4胁迫下的抗性,为改良盐碱地、改善土壤质量提供科学依据。结果显示,当Na2SO4浓度分别为0,50,100,150,200,250 mmol·L-1时,随着Na2SO4浓度的升高,紫苏种子的发芽率、发芽势和相对发芽率均降低,相对盐害率升高,紫苏种子对Na2SO4的适宜浓度为50 mmol·L-1,半数抑制浓度为150 mmol·L-1;紫苏幼苗的主根长、侧根数目、茎长、子叶长及苗鲜质量均随Na2SO4处理浓度的增加而降低,并且在Na2SO4浓度为200,250 mmol·L-1时,无侧根形成,茎和子叶的生长完全受到抑制;复萌处理中,随原处理Na2SO4浓度的升高,紫苏种子复萌率和发芽势均降低,根长和茎长均高于原处理组但低于对照组,说明复萌的紫苏种子可以通过内部机制逐渐解除胁迫,恢复生长,但仍不能达到对照水平;在Na2SO4胁迫下,紫苏幼苗的可溶性蛋白、可溶性糖及丙二醛含量均呈现先增加后减少的趋势,分别在100,150,200 mmol·L-1时达到最大。
关键词:紫苏;硫酸钠;发芽率;复萌率;生理指标
中图分类号:S636.9 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.11.006
Effects of Na2SO4 Stress on Perilla frutescens Seed Germination and Seedling Physiological Characteristics
GAO Kun1,2, LIU Xiaochun1
(1. School of Life Science, Shanxi Datong University, Datong, Shanxi 037009, China; 2. Protected Agricultural Technology Development Center, Shanxi Datong University, Datong, Shanxi 037009, China)
Abstract: Taking domestic two-color Perilla frutescens as trial material, resistance to Na2SO4 stress of P. frutescens was studied to provide a scientific basis for improving the saline-alkali land and the quality of soil. The results showed that with the increasing of the concentration of Na2SO4, the germination rate, germination potential, relative germination rate of P. frutescens seeds were decreased, but the relative salt injury rate was raised. The concentration of suitable Na2SO4 tolerant in P. frutescens seeds was 50 mmol·L-1 and the semi-lethal concentrations of Na2SO4 was 150 mmol·L-1. The taproot length, lateral root number, cotyledon length and fresh weight of P. frutescens seedlings were decreased following with the increased concentrations of Na2SO4, there were no lateral root, and the stem and cotyledon growth were inhibited completely at the concentration of 200, 250 mmol·L-1. After re-germination, the re-germination rate and germination potential of P. frutescens seeds were decreased with the increasing of the original concentration of Na2SO4, the length of root and stem were between the original treatments and the control, which showed that P. frutescens seeds could relive the Na2SO4 stress by regulating inner mechanism and recover growth but it still could not recover to the control level. The content of soluble protein, soluble sugar and malonaldehyde of P. frutescens seedlings showed a trend of rising first and then declining, and the maximum value were occurred at 100, 150, 200 mmol·L-1 respectively.
Key words: Perilla frutescens; sodium sulfate; germination rate; re-germination rate; physiological index
受氣候变化及人类活动的长期影响,土壤盐碱化已经成为世界性的生态环境问题。我国盐渍土面积约3.5×107 hm2,相当于耕地的1/3[1-2],由于开发利用方式不合理,有进一步扩大的趋势,严重制约着农业可持续发展,破坏了生态环境。土壤盐碱化造成了土壤与植物根部根毛的渗透势差,容易破坏植物的渗透平衡,影响植物对土壤中的水分和矿质元素的吸收、运输与利用,进而影响植物的生长发育,严重的还会造成植物死亡。因此,筛选耐盐植物,对于改良土壤,改善生态环境具有重要的现实意义。
紫苏(Perilla frutescens(L.) Britt.)是唇形科 (Lamiaceae)紫苏属(Perilla)一年生草本植物[3],其抗性较强,能够在山地、丘陵及盐碱地种植[4]。紫苏是国家卫生部首批公布的60种药食两用的植物之一[5],其营养丰富,含有粗蛋白、粗脂肪、维生素C和胡萝卜素,叶片中的迷迭香酸、多酚、黄铜、花青素等活性物质具有清除自由基和抗氧化能力[6-7],此外,紫苏还含有多种矿质元素,如钾、钙、磷、镁、铁、铜、锌、硒等[8],深受人们的喜爱。紫苏的梗、叶和籽均可入药,紫苏籽富含α-亚麻酸、油酸和亚油酸,这些植物油具有调节血脂、促进学习记忆、止咳平喘、抗衰老、抗过敏和减肥等作用[9],在营养学界有“植物脑黄金”的美誉[10],α-亚麻酸在医药和保健食品领域有着广泛的用途。
我国的紫苏资源丰富,品种多样。目前,关于紫苏的研究多集中在化学成分分析[11-14]和药用价值[15-16]方面,紫苏对模拟盐胁迫环境有一定抗逆性的研究已经在NaCl[4]、Na2CO3[17]、NaHCO3[18]等盐胁迫上得到证实,而Na2SO4胁迫对紫苏种子萌发和幼苗生长的影响研究鲜见报道。Na2SO4是我国西北和华北内陆盐碱地上继NaCl之后的第二大类盐胁迫[19]。本次研究以国产双色紫苏(面绿背紫)为材料,采用水培法,通过研究不同浓度Na2SO4胁迫下紫苏种子萌发、幼苗生长状况和生理特性的变化,探讨紫苏种子和幼苗的抗盐性,为利用紫苏改良我国的盐碱地,提高土壤质量,改善生态环境,实现农业的可持续发展提供科学依据。
1 材料和方法
1.1 材 料
以国产双色紫苏(Perilla frutescens)种子为试验材料。
1.2 试验方法
1.2.1 紫苏种子胁迫 挑选大小、色泽相近的紫苏种子,用双层纱布将种子包裹,全部浸没在盛有蒸馏水的烧杯中浸种12 h,然后在5%的过氧化氢溶液中浸泡5 min消毒,之后在蒸馏水里浸泡1 min清洗。将处理好的种子放到培养皿里,每个培养皿里放50粒。试验共6个处理,分别为0(对照),50,100,150,200,250 mmol·L-1的Na2SO4处理,分别记为CK、T1、T2、T3、T4、T5,每个处理3次重复,共18组。分别向各组的培养皿中加入10 mL对应浓度的Na2SO4溶液,对照组加10 mL蒸馏水,称量并记录每个培养皿的初始质量,将培养皿放在恒温培养箱中培养。之后每天定时观察种子的萌发情况,并称量培养皿的质量,低于初始质量时补充蒸馏水,以维持Na2SO4溶液浓度恒定。6 d后取出已经发芽的种子,测定胚根长、茎长、叶片大小和侧根数和苗鲜质量。
1.2.2 复萌试验 由预试验可知,在第6 d时,Na2SO4胁迫的紫苏种子已经达到最大萌发率,因此,在第6 d统计发芽情况之后,将不同浓度Na2SO4处理中未萌发的紫苏种子挑选出来,用蒸馏水浸泡冲洗多次后,分别放在盛有蒸馏水培养皿中再次培养,按原处理浓度记为R1、R2、R3、R4、R5,放在培养箱中观察并记录这些紫苏种子的萌发情况。6 d后统计复萌率、发芽势,测量根长和茎长。
1.2.3 紫苏幼苗胁迫将在蒸馏水中萌发并生长12 d的紫苏幼苗,选择长势接近的分为5组,分别用0(对照),100,150,200,250 mmol/L的Na2SO4溶液处理2 d,记为CK、D1、D2、D3、D4组,培养方式同上,测量紫苏幼苗的可溶性糖含量[20]、丙二醛含量[21]和可溶性蛋白含量[22]。
1.3 指标计算
以肉眼可以观察到白色胚根为种子发芽的标准,每天观察并记录各处理组种子的发芽数,连续观察记录6 d后进行数据计算。
发芽率(GP,%)[23]=(发芽种子总数/供试种子总数)×100。
发芽势(GE,%)[24]=3 d内发芽种子数/供试种子总数×100。
耐盐浓度(适宜值)[25]:发芽率达到对照组发芽率75%时相对应的盐浓度。
半数抑制浓度(临界值)[25]:发芽率达到对照组发芽率50%时相对应的盐浓度。
相对发芽率(%)[26]=某一盐处理下的发芽率/对照组的发芽率×100%。
相对盐害率(%)[26]=(对照组发芽数-各组盐处理发芽数)/对照组的发芽数×100%。
复萌率(%)[24]=复萌的种子数/经盐胁迫未萌发种子数×100。
1.4 数据处理
试验所得的数据用SPSS.22.0软件进行分析。
2 结果与分析
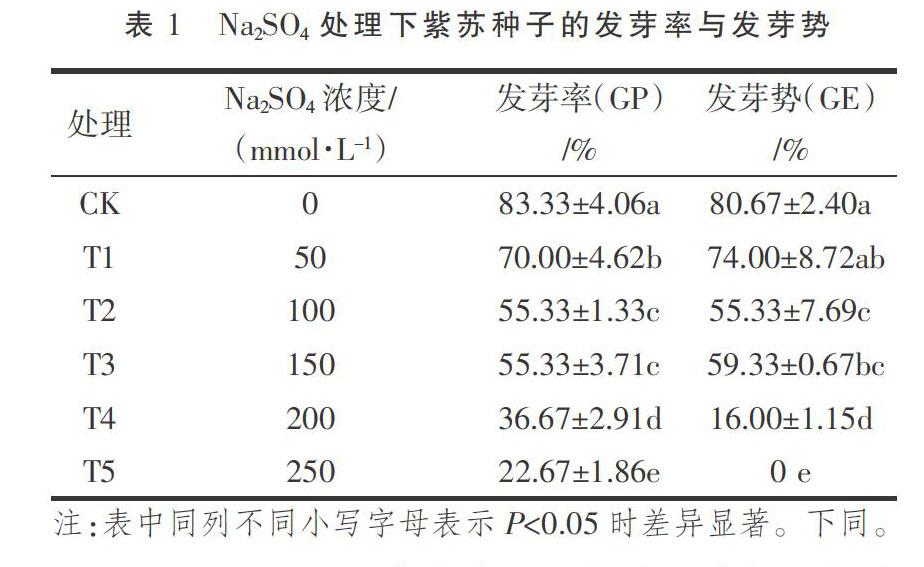
2.1 Na2SO4胁迫下紫苏种子的发芽率与发芽势
由表1可以看出,与CK组相比,Na2SO4处理下的紫苏种子发芽率均显著下降,且降幅随着Na2SO4处理浓度的增加而增大,除了T2和T3差异不显著(P>0.05)外,其它处理组间差异均显著(P<0.05);Na2SO4处理下的紫苏种子发芽势也表现出下降趋势,其中除T1下降不显著(P>0.05)外,其它各处理组均显著下降(P<0.05)。综合说明,紫苏种子萌发对Na2SO4具有一定的抗性,其耐Na2SO4浓度(适宜值)为50 mmol·L-1,Na2SO4的半数抑制浓度(临界值)为150 mmol·L 。
2.2 Na2SO4胁迫下紫苏种子的相对发芽率和相对盐害率
相对发芽率和相对盐害率可反映种子在萌发中的生活力。由表2可知,紫苏种子相对发芽率随着Na2SO4处理浓度的增加呈下降趋势,其中除T2与T3之间差异不显著(P>0.05)外,其余各组间差异均显著(P<0.05);Na2SO4处理的紫苏种子相对盐害率随着Na2SO4处理浓度的增加呈增加趋势,各组间除T2与T3差异不显著(P>0.05)外,其他组间差异均达显著水平(P<0.05),说明Na2SO4浓度越高,对种子萌发造成的盐害越大。另外,在试验观察的过程中,当Na2SO4浓度高于200 mmol·L-1时,从萌发3 d后开始,紫苏种子周围会产生乳白色的絮状物质,种子外壳变软且种皮内部的胚变质,种子逐渐死亡,且随着培养时间的推移和Na2SO4浓度的增大,发霉和死亡的种子数目逐渐增多,说明高浓度的Na2SO4对紫苏种子造成了严重的伤害,使种子霉变甚至死亡。
2.3 Na2SO4胁迫下紫苏幼苗的生长情况
逆境下的植物生长情况会发生异于正常植物的变化。从表3中可以看出,紫苏幼苗的主根长、侧根数、茎长、子叶长和苗鲜质量均较CK显著下降(P<0.05),且随着Na2SO4处理浓度的增加降幅增大,说明Na2SO4显著抑制紫苏幼苗生长。紫苏幼苗的子叶长和苗鲜质量在不同Na2SO4处理组间差异均不显著(P>0.05),而主根长在T1与T5之间差异显著(P<0.05),侧根数在T1与T4、T5差异显著(P<0.05),茎长在T1、T2、T3与T4、T5差异显著(P<0.05)。根据结果中T5组的主根数为0,T4和T5组的侧根数、茎长和子叶长均为0,说明高浓度Na2SO4(大于200 mmol·L-1)严重抑制了紫苏幼苗的生长。
2.4 复萌处理后紫苏种子的萌发与生长情况
由表4可知,R1、R2、R3、R4和R5中复萌处理种子的复萌率、发芽势、根长和茎长均随着原Na2SO4处理浓度的增加呈下降趋势。复萌后,50 mmol·L-1 Na2SO4处理的紫苏种子总的萌发率达到82%,基本达到CK的水平(83.33%),说明较低浓度(50 mmol·L-1)的Na2SO4虽然可抑制紫苏种子萌发,但胁迫去除后仍能继续萌发至发芽率达到对照的水平,而其余各处理总的萌发率分别为60%,60%,41%,27%,均低于CK,则说明超过一定浓度的Na2SO4对紫苏种子萌发造成的伤害不可恢复,且浓度越高,伤害程度越大。此外,去除Na2SO4胁迫后,各胁迫处理复萌后紫苏幼苗的根长和茎长虽高于同浓度的胁迫处理(表3),但均不能恢复到对照的水平,亦说明Na2SO4可能对紫苏种子造成了一定的不可逆伤害。
2.5 Na2SO4胁迫下紫苏幼苗的生理生化特性
2.5.1 可溶性蛋白含量 由表5可知,紫苏幼苗可溶性蛋白含量随着Na2SO4浓度的增加呈现先升后降趋势且于D1处理达到最大值。其中,D4组略低于CK组但差异不显著(P>0.05),二者均显著低于D1、D2、D3组,且D1显著高于D2、D3组(P<0.05),说明低浓度的Na2SO4可使紫苏幼苗的可溶性蛋白增加,而高浓度则抑制其形成。
2.5.2 可溶性糖含量 由表5可知,与CK相比,紫苏幼苗可溶性糖含量表现为先增后减且于D2处理达到最大值,各处理可溶性糖含量表现为D2>D3>D1>CK>D4,除D2与D3组无显著差异(P>0.05)外,其余各组间差异均显著(P<0.05),说明中低浓度Na2SO4可以促进紫苏幼苗可溶性糖的合成,而高浓度的Na2SO4使可溶性糖合成减少。
2.5.3 丙二醛含量 由表5可知,紫苏幼苗丙二醛含量随Na2SO4浓度增加而先增大后减小且于D3处理达到最大值,与D2差异不显著(P>0.05),二者均显著高于CK和D1、D4组(P<0.05)。
3 结论与讨论
3.1 Na2SO4胁迫对紫苏种子萌发的影响
种子萌发是植物发育的起始阶段,也是生活史中最为关键和重要的发育阶段[27]。正常的种子萌发不仅取决于自身条件,还与各种环境条件如水分、温度、光照、土壤状况等密切相关[28]。Na2SO4是土壤中的中性盐[29],土壤中由于Na2SO4的大量存在,改变了植物体内的离子平衡,进而影响植物对水分和矿质营养的吸收、运输和利用,最终影响植物的生长。李会云等[30]研究表明南瓜种子发芽率、发芽势、发芽指数与Na2SO4溶液浓度呈反比。本试验中,随着Na2SO4溶液浓度的增加紫苏种子的发芽率和发芽势及相对发芽率降低而相对盐害率增加,且在高浓度下(大于200 mmol·L-1),出现种子霉变甚至死亡现象,说明高浓度的Na2SO4对紫苏种子造成了严重伤害;紫苏种子对Na2SO4的耐盐浓度和半数抑制浓度分别为50,150 mmol·L-1;复萌处理的紫苏种子萌发和生长均受原处理组Na2SO4浓度的影响,随原Na2SO4浓度的升高而降低,其中50 mmol·L-1 Na2SO4处理的紫苏种子复萌后其总萌发率可达到与对照相当的水平,但其他浓度处理则均明显低于对照,说明适宜浓度的Na2SO4处理对紫苏种子的伤害可恢复,但超过一定浓度后则会出现不可逆伤害。
3.2 Na2SO4胁迫对紫苏幼苗生长的影响
Na2SO4胁迫不仅影响紫苏种子的萌发,也影响幼苗的生長。本试验中,在Na2SO4溶液中萌发的紫苏种子形成幼苗的主根长、侧根数目、茎长、子叶大小及苗鲜质量均与Na2SO4浓度呈反比,并且在Na2SO4浓度为200,250 mmol·L-1时,种子只长出了主根,而无侧根形成,茎和子叶的生长完全受到了抑制;蒸馏水中生长12 d后用Na2SO4处理的紫苏幼苗,随着Na2SO4浓度的升高可观察到幼苗的茎和叶都出现软化,不能正常的直立生长,根有发黄发褐的现象,且随着浓度的升高这些变化表现得越明显(数据未在文中体现);各Na2SO4处理复萌后的幼苗根长和茎长均高于原处理组但低于对照组,说明复萌的紫苏种子虽然可以通过内部机制逐渐解除胁迫,恢复生长,但并不能达到对照的水平,可能是Na2SO4对紫苏种子造成了部分不可恢复的伤害。
3.3 Na2SO4胁迫对紫苏幼苗生理生化特性的影响
植物的生理生化指标同样是研究植物抗盐性的主要内容。植物可以通过调节自身体内各生理生化指标的变化,来降低或消除Na2SO4胁迫对其的不利影响,进行自我保护,并适应胁迫环境。可溶性蛋白质作为植物体内重要的渗透物质之一,直接反映盐胁迫对植物代谢所产生的影响[31],有研究证明,盐胁迫在低浓度下可以提高野葛种苗中可溶性蛋白的含量,而高浓度可使野葛种苗中可溶性蛋白的含量降低[32]。本试验中,紫苏幼苗可溶性蛋白含量随着Na2SO4浓度的增加呈现先升后降趋势,在Na2SO4浓度为100 mmol·L-1时,可溶性蛋白含量最高,之后逐渐降低,这与已有的研究结果基本一致,低浓度下升高的可溶性蛋白起到保持水分的作用,可以增强紫苏幼苗对Na2SO4的抗性。
可溶性糖是逆境条件下很多非盐生植物的主要渗透调节剂[33]。可溶性糖能够提供能源物质,维持细胞的渗透压平衡[34]。已有的研究结果显示,金盏菊在盐胁迫下,其可溶性糖含量出现先升后降的趋势[33]。本试验中,紫苏幼苗中的可溶性糖含量随着Na2SO4胁迫的增加先升高后降低,与已有的研究结果类似,说明紫苏幼苗通过调节可溶性糖含量以维持体内渗透平衡,对Na2SO4胁迫具有一定的抵抗力。
植物在逆境条件下,通常会发生膜脂过氧化反应,丙二醛是膜脂过氧化反应的最终分解产物,丙二醛含量的多少可以衡量植物细胞膜的氧化损坏程度[35]。有研究表明,沙打旺幼苗体内的丙二醛含量随着NaCl胁迫浓度的增加表现为先增后减[36]。高浓度NaCl下膜损伤减轻,是因为过氧化物酶活性增高,保护了细胞膜。本试验中,紫苏幼苗叶片中的丙二醛含量亦表现为先升高后下降的趋势,可能是体内保护酶如超氧化物歧化酶、过氧化物酶含量增多,活性增强,这需要进一步验证。
参考文献
[1]李怒云,龙怀玉.植树造林与21世纪我国盐渍土开发利用的关系[J].北京林业大学学报,2000(3):99-100.
[2]乔建明,王洪军,李举文,等.土壤盐碱地现状、改良利用及盐碱治理在新疆农业发展中的意义[J].新疆农垦科技,2015,38(10):54-56.
[3]张晓彬,姜文鑫,张琳,等.紫苏的研究进展[J].食品研究与开发,2015,36(7):140-143.
[4]乔绍俊,李会珍,张志军,等.盐胁迫对不同基因型紫苏种子萌发、幼苗生长和生理特征的影响[J].中国油料作物学报,2009,31(4):499-502, 508.
[5]杨森,王仙萍,田世刚,等.不同浓度甲基磺酸乙酯对紫苏种子萌发的影响[J].贵州农业科学,2017,45(8):83-85.
[6]包万柱,张园园,王德宝,等.紫苏叶的营养价值及其产品加工研究进展[J].农产品加工,2020(3):65-69.
[7]王德宝,包迎春,包万柱.紫苏功能特性及产品加工研究进展[J].北方农业学报,2019(5):96-99.
[8]汪李平.长江流域塑料大棚紫苏栽培技术[J].长江蔬菜,2020(6):28-32.
[9]张丽娟,杨解顺,殷建忠.富含α-亚麻酸唇形科植物油的研究进展[J].国外医学:医学地理分册,2010,31(2):127-129.
[10]于长青,赵煜,朱刚,等.紫苏油的营养和药用价值研究[J].中国食物与营养,2007(8):47-49.
[11]张玲.紫苏多种活性成分测定及抗氧化活性初步研究[D].天津:天津科技大学,2016.
[12]薛姣.紫苏迷迭香酸提取工艺及其应用研究[D].太原:中北大学,2016.
[13]何彦康.紫苏中多酚类天然活性成分的结构解析与功能研究[D].上海:华东理工大学,2015.
[14]代春华,徐志建,沈晓昆,等.不同品种紫苏种子营养成分的分析[J].中国粮油学报,2015,30(3):55-58.
[15]沈奇,徐静,商志伟,等.紫苏梗中主要营养及药用成分评价[J].中国现代中药,2019,21(7):920-924.
[16]郭雪红.中药紫苏药理及临床研究新进展[J].天津药学,2016,28(2):70-73.
[17]蹇黎.Na2CO3对紫苏种子萌发的影响[J].安徽农业科学,2018,46(33):44-45.
[18]裴毅,杨雪君,尹熙,等.NaCl和NaHCO3胁迫对紫苏种子萌发的影响[J].种子,2015,34(9):11-14,19.
[19]刘正祥,张华新,杨秀艳,等.植物对氯化钠和硫酸钠胁迫生理响应研究进展[J].世界林业研究,2015,28(4):17-23.
[20]吴飞洋,柳新红,董峰平,等.光照和土壤对乌桕秋季叶片色素及可溶性糖的影响[J].西南林业大学学报:自然科学,2019,39(6):41-48.
[21]李丹丹,许馨露,翟建云,等.毛竹笋竹快速生长期可溶性糖质量分数与PeTPS1/PeSnRK1基因表达分析[J].浙江农林大学学报,2017,34(6):1016-1023.
[22]时俊帅,章超,陈双林,等.覆土控鞭栽培对高节竹鞭根养分和抗性生理特征的影响[J].浙江农林大学学报,2019,36(5):902-907.
[23]刘佳月,杜建材,王照兰,等.紫花苜蓿和黄花苜蓿种子萌发期对PEG模拟干旱胁迫的响应[J].中国草地学报,2018,40(3): 27-34,61.
[24]杨雪君,毛金枫,张雪,等.盐碱胁迫对红车轴草种子萌发的影响[J].北方园艺,2016(9):69-74.
[25]裴毅,张伟,聂江力,等.盐碱胁迫对知母种子萌发的影响[J].天津农业科学,2016,22(12):1-5,10.
[26]李永进,刘玉艳.盐胁迫对二月兰(Orychophragmus violaceus)种子萌发的影响[J].分子植物育种,2017,15(6):2368-2374.
[27]王鹏山,慈华聪,田晓明,等.不同钠盐胁迫对狼尾草种子萌发及幼苗生长的影响[J].安徽农业科学,2014,42(21):7007-7010.
[28]张红香,周道玮.种子生态学研究现状[J].草业科学,2016,33(11):2221-2236.
[29]王丽艳,杨帆,李睿瑞,等.不同种类盐胁迫对绿豆种子萌发及幼苗生长的影响[J].黑龙江八一农垦大学学报,2018,30(5):20-26.
[30]李会云,李伯寿,张延召,等.Na2SO4胁迫对蜜本南瓜种子萌发的影响[J].园艺与种苗,2018,38(5):1-3.
[31]李赵嘉,左永梅,宋明月,等.盐胁迫對大叶蒲公英生长生理指标及耐盐阈值的影响[J].中药材,2020(7):1560-1564.
[32]郭坤元,穆森,郭汉玖,等.氯化钠胁迫对野葛种苗生理特性的影响[J].时珍国医国药,2019,30(2):453-455.
[33]高慧,陈梦玲,朱小燕.不同浓度氯化钠胁迫对金盏菊生长发育的影响[J].北方园艺,2013(24):67-69.
[34]张宇君,王普昶,赵丽丽,等.巴哈雀稗幼苗对PEG和NaC1持续胁迫的生理应答[J].分子植物育种,2018,16(23):7839-7848.
[35]张萌,杨琼博,曹冬煦.卷柏与无芒雀麦抗旱性比较研究[J].中国园艺文摘,2015(1):31-32,172.
[36]卫士美,陈莉,樊存虎,等.氯化钠胁迫对沙打旺幼苗生化指标的影响[J].浙江农业科学,2017,58(12):2210-2211,2214.
