基质黏附强度调控血小板生长因子诱导的大鼠气道平滑肌细胞中Fyn激酶活性*
2020-01-03姚辉邓林红欧阳明星
姚辉,邓林红,欧阳明星
(常州大学生物医学工程与健康科学研究院,常州 213164)
1 引 言
哮喘作为全球范围内最常见的一种慢性呼吸道疾病,其发病率和死亡率正逐年增长。据相关调查统计,全球有超过3亿的哮喘病患者,中国约有3 000万人患有哮喘[1]。气道平滑肌作为呼吸道的重要组成部分,与哮喘有着密不可分的关系,例如哮喘的典型特征为气道高反应性(airway hyper-responsiveness,AHR),其主要成因之一是气道平滑肌细胞增生,平滑肌层增厚,引起气道过度收缩且无法自主松弛[2]。实验研究显示该过程中ASM细胞的力学性能也发生了变化,AHR现象也体现为一种生物力学行为[3],但其生物力学机制尚不清楚。
Fyn作为非受体酪氨酸激酶Src家族的一员(Src family tyrosine kinase,SFKs),在前列腺癌等癌症病变[4]的病理机制中起着重要作用。有研究报道Fyn参与细胞力学行为的调控[5]。ASM 细胞表达Fyn激酶[6],而血小板生长因子(PDGF)能刺激ASM 细胞的增殖和诱导ASM 细胞收缩延长效应[7]。目前,PDGF能否激活ASM 细胞中的Fyn激酶,以及细胞力学微环境是否调节ASM 细胞中的Fyn激酶活性,仍未见有报道。因此,探讨平滑肌细胞的力学微环境对Fyn激酶活性的影响具有一定意义,为进一步理解哮喘中气道细胞力学性能改变引起提供线索。
细胞与胞外基质的黏附强度代表了一种细胞力学微环境[8]。纤维粘连蛋白主要分布在细胞表面和胞外基质中,可促进伤口的修复和愈合,调节细胞的黏附、迁移以及生长分化,本研究通过改变基底纤维粘连蛋白的黏附强度来调节ASM 细胞力学微环境,初步探讨其对细胞内信号活性如Fyn激酶的影响。
荧光共振能量转移(FRET)是由供体和受体荧光分子之间通过非辐射的偶极-偶极相互作用产生能量转移的一种量子力学的现象。近二十年来,基于FRET原理发展的技术已经成为监测活细胞中动态分子活动的一种强有力的方法[9]。本研究运用FRET技术,通过利用我们已开展的Fyn FRET分子探针工作[10],探究PDGF诱导的ASM 细胞中Fyn激酶的激活,并通过改变纤连蛋白黏附强度,观察基底黏附力微环境对ASM 细胞中Fyn活性的影响。
2 材料与方法
2.1 材料
2.1.1细胞种类与来源 大鼠平滑肌细胞(ASM 细胞)来源于6~8周的雌性Sprague Dawley大鼠,采用组织块贴壁法与酶消化相结合的方法取得原代细胞,通过反复贴壁法提纯ASM 细胞,鉴定方法为免疫荧光法结合相差显微镜的形态学观察法。
2.1.2主要试剂和仪器 胎牛血清FBS,DMEM低糖培养基,Opti-MEM培养基,0.25%胰蛋白酶,细胞贴壁消化试剂Accutase,转染试剂Lipofectamine 3000,美国Thermo Fisher Scientific公司;Fibronectin,Corning公司;激光共聚焦培养皿(20 mm),NEST公司;FRET显微镜平台,倒置显微镜Primo Vert,德国Zeiss公司。
2.2 方法
2.2.1ASM 细胞转染Fyn FRET 探针 根据此前的研究结论[17], 本研究中使用膜定位的Fyn FRET探针,便于精确检测细胞膜结构上的Fyn激酶活性。转染前12 h,用胰蛋白酶消化ASM 细胞并转移至15 mL离心管中,1 000 rpm离心5 min去除胰蛋白酶,计算细胞数量使转染时细胞密度约为60~80%,六孔板的每个孔以2 mL 10% FBS的DMEM低糖培养基进行培养。转染时六孔板中每个孔的细胞转染2.5 μg DNA。转染后12 h,用1×PBS清洗细胞一次,换成2 mL含有0.5% FBS的DMEM低糖培养基,在血清饥饿条件下培养24~36 h。
2.2.2Fibronectin浓度梯度实验设置 实验中,Fibronectin浓度梯度设定为1.25、2.5、5、10、20、40 μg/mL。用1×PBS稀释Fibronectin(1 mg/mL)储液,在每个共聚焦皿的玻璃底部(直径2 cm)加500 μL稀释后的溶液,在37℃细胞培养箱孵育4 h。将转染Fyn FRET 探针的ASM细胞传到共聚焦皿上,以0.5% FBS的DMEM低糖培养基饥饿培养贴壁6~8 h后,在5 h内完成所有样品的FRET显微镜成像实验,避免细胞本身分泌的胞外基质蛋白极大改变预设的Fibronectin黏附强度差异。
2.2.3FRET显微镜采集ASM 细胞图像数据 显微镜成像前,用Accutase消化液消化转染后的细胞并转移到铺设有Fibronectin的共聚焦皿中,继续培养在含0.5% FBS的DMEM低糖培养基中。FRET显微镜的ECFP成像通道的荧光滤片参数为激发436/20,分光455,发射 480/40;FRET成像通道的荧光滤片参数为激发436/20,分光455,发射535/30(Zeiss)。在实验拍摄过程中,5~6 min之间通过外接导管给细胞样品加入1 mL含PDGF(终浓度 50 ng/mL)的DMEM低糖培养基(0.5% FBS)。
2.2.4FRET图像数据的定量分析 FRET显微镜采取的细胞图像数据分析依据我们此前的研究[10]。研究数据以“平均值±标准误(mean±S.E.M.)”表示,采用统计分析软件GraphPad Prism 6进行方差分析,用t-test分析数据在统计学意义上的差异,以P<0.05为具有显著性差异。
3 结果
3.1 PDGF刺激诱导ASM 细胞中Fyn激酶的激活
大鼠气道平滑肌细胞转染Fyn FRET探针 DNA质粒后24~48 h,通过荧光显微镜的GFP通道可观察到在普通细胞培养皿上,约5~10%的细胞已成功表达Fyn FRET 探针,见图1(a),满足后续FRET实验所需要的转染效率。然后我们检测了PDGF刺激对Fyn的活性影响,见图1(b),PDGF的刺激能显著引起ASM 细胞中Fyn FRET的反应。多个细胞中的FRET变化定量分析显示PDGF能诱导Fyn的快速激活,5 min内达到高活性的平台期,见图1(c)。统计的平均结果显示,代表细胞中Fyn激酶相对活性的FRET比值(ECFP/FRET)从刺激前的0.347,升高到了PDGF刺激5 min后的0.744,变化率达到了约110%,见图1(d)。实验结果表明,PDGF能快速高效地激活ASM 细胞中Fyn激酶活性。

注:**** 代表P<0.0001,两组数据的平均值分别为0.347和0.744。
图1PDGF刺激诱导ASM细胞中Fyn FRET反应
(a).ASM细胞转染后表达Fyn FRET探针;(b).PDGF刺激诱导ASM细胞中Fyn FRET反应。细胞图片的颜色代表ECFP/FRET比值分布图,从蓝到红代表FRET比值从低到高,也意味着Fyn的相对活性从低到高的变化;(c).PDGF诱导一组ASM细胞(N=12)中Fyn FRET反应,图中显示每个单细胞的ECFP/FRET比值在沿时间轴方向上的定量变化曲线;(d).在(c)中的ASM细胞在PDGF刺激前后的ECFP/FRET比值变化统计(平均值+方差,mean+SEM,N=12)
Fig.1PDGF-induced Fyn FRET responses in ASM cells
3.2 细胞-基质黏附强度可调节Fyn的激活
下一步观察细胞-基质黏附强度的力学微环境是否会影响ASM 细胞中的化学信号。转染Fyn FRET 探针的ASM 细胞传到铺设有不同Fibronectin浓度的共聚焦皿上,6~8 h后开始FRET成像。显微镜下可清晰地观察到,在Fibronectin低浓度的小皿上(1.25 和2.5 μg/mL),多数细胞的贴壁形态还未完全铺展开,见图2(a),表明其黏附强度相对较弱(比较1.25和2.5 μg/mL)。FRET成像结果显示,在不同浓度的Fibronectin条件下,PDGF刺激都能有效地激活ASM 细胞中的Fyn激酶活性,见图2(a)。从定量的角度分析,Fyn的激活程度和Fibronectin浓度存在明显的相关性,见图2(b),随着Fibronectin浓度递增,FRET反应曲线(平均值±方差)也上移;从统计学上的显著性差异分析,当Fibronectin浓度达到5 μg/mL或以上,与低浓度的1.25 μg/mL条件下相比,Fyn的激活存在显著性增加,见图2(c)。这些结果初步显示,细胞-基质黏附强度的力学微环境会一定程度上调控PDGF诱导的ASM 细胞中Fyn的活性。
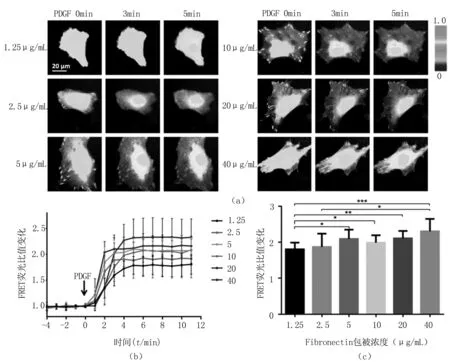
注:*代表P<0.05,**代表P<0.01,***代表P<0.001。
图2细胞-Fibronectin黏附强度对PDGF诱导ASM细胞中Fyn活性的影响
(a).ASM细胞黏附在包被有不同浓度Fibronectin的共聚焦皿上,PDGF刺激诱导细胞中Fyn FRET反应前后的ECFP/FRET比值分布图。实验中,细胞贴壁6~8h后,开始FRET显微镜成像实验;(b).在(a)中的每个实验条件下,各组ASM细胞(N>10)中的Fyn FRET反应统计,图中显示ECFP/FRET比值在沿时间轴方向上的定量变化统计曲线(平均值方差)。各曲线的起始点数值均归1;(c).实验数据(b)中不同浓度Fibronectin的细胞组在PDGF刺激前(0min)、后(5min)的ECFP/FRET比值变化统计(平均值+方差),各组平均值依次为1.803,1.870,2.091,1.989,2.110,2.305
Fig.2Cell-Fibrinectin adhesion strength regulates PDGF-induced Fyn activity in ASM cells
3.3 抑制细胞内部的收缩力不影响Fyn的激活
细胞外部基质黏附强度的力学微环境能影响ASM 细胞中Fyn的激活,我们也初步观察了细胞内部的收缩力对Fyn活性的影响。ML-7是肌球蛋白轻链磷酸化的抑制剂,能抑制细胞内的收缩力[11]。异丙腺素(ISO)是一种β-受体激动剂,已证明ISO能舒张ASM 细胞,降低细胞自身的刚度和收缩力[12]。在FRET实验中,ASM 细胞分别经ML-7或ISO处理以减弱细胞内收缩力后,PDGF均能有效激活细胞中Fyn的活性,见图3(a)。多细胞水平上的进一步定量分析显示,和对照组比较,这些减弱细胞收缩力的药物处理对PDGF诱导的ASM 细胞中Fyn的活性,无明显影响,见图3(b)、图3(c)。实验结果初步显示减弱ASM 细胞内收缩力,不影响PDGF诱导的Fyn活性,提示前面降低细胞-基质黏附强度造成的Fyn活性下调,可能不是经由减弱细胞内收缩力的途径而引起的。

注:N.S.代表P≥0.05,无显著性差异。
图3抑制细胞内收缩力对PDGF诱导的ASM细胞中Fyn活性的影响
(a).ASM细胞在药物处理4h后(药物工作浓度ML-7:10μM;ISO:10μM),PDGF刺激诱导Fyn FRET反应,图中显示各条件下代表性细胞的ECFP/FRET比值分布图;(b).在实验条件(a)中,药物处理后各组ASM细胞(N>10)中的Fyn FRET反应统计,图中显示ECFP/FRET比值在沿时间轴方向上的定量变化统计曲线(平均值方差);(c).实验数据(b)中不同药物处理的细胞组在PDGF刺激前后的ECFP/FRET比值变化统计(平均值+方差)
Fig.3The effect of inhibiting intracellular contraction force on PDGF-induced Fyn activity in ASM cells
4 讨论
哮喘是一种由多种细胞及细胞因子共同参与的慢性气道炎症反应及气道高反应性(AHR)疾病。虽然气道平滑肌在哮喘中的重要作用早已被认识,但其参与AHR发病机制的确切性质尚不清楚,并且单纯的抗炎治疗并不能“治愈”哮喘。即使没有气道炎症,气道高反应性也会在哮喘患者中持续存在,这可能是因为该疗法没有直接治疗哮喘患者气道平滑肌过度收缩而导致的气道狭窄。有研究表明哮喘患者的气道平滑肌总量是增加的,即使没有收缩表型的改变,也有可能增强气道反应性,从而导致哮喘症状[13]。
本研究考虑生理条件下气道平滑肌力学性能的重要性,通过调节细胞层面的力学微环境,初步观察了ASM 细胞中力学-生化信号转导现象。研究中通过改变细胞-基底黏附强度,利用灵敏的FRET分子探针实时测量活细胞中Fyn激酶的活性,初步发现物理的黏附强度与PDGF诱导的Fyn激活这个化学信号现象间有正相关性。该结果具有一定的基础理论研究意义,也提示慢性的哮喘病理条件下,持续性收缩引起的气道平滑肌层的力学环境改变可能也会导致细胞内部生化信号的变化。虽然该研究结果的细胞分子机制有待进一步阐明,这个初步性的工作对全面理解气道平滑肌的力学生物学特点有一定帮助,对了解哮喘病理条件下气道平滑肌细胞内的生化信号变化提供了一些思路。
