老年胶质瘤患者术后基质金属蛋白酶-2及Bax的表达及在预后评估中的价值
2020-01-01季列毛仁玲孙祥冬徐军
季列,毛仁玲,孙祥冬,徐军
胶质瘤是常见的颅脑恶性肿瘤,约35%~60%的颅脑肿瘤为胶质瘤[1]。手术是其主要治疗手段,但由于胶质瘤具有侵袭性生长的特征,术后复发率较高,预后较差。胶质瘤细胞的恶性增殖是导致病情恶化的主要因素,研究与胶质瘤侵袭生长相关蛋白的表达,对于指导临床治疗和评估患者预后具有重大意义。Bax蛋白是抑癌蛋白,具有促细胞凋亡作用,Bax蛋白表达与多种肿瘤的发生、发展有密切联系[2]。基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)可降解细胞外基质,促进肿瘤细胞浸润。本研究采用免疫组化法测定并对比胶质瘤组织与非胶质瘤脑组织中的MMP-2、Bax表达情况,以了解MMP-2、Bax与胶质瘤发生发展的关系。
1 资料与方法
1.1 一般资料
选取2016年6月至2017年6月本院收治的老年胶质瘤患者48例为观察组。纳入标准:行手术治疗;术后经组织切片病理检查确诊为胶质瘤;临床资料完整;术前未接受过任何抗肿瘤治疗。排除标准:伴自身免疫性疾病;合并其他恶性肿瘤;严重肝、肾、心、肺功能障碍;凝血功能障碍。其中男28例,女20例;年龄52~78岁,平均(65.62±2.87)岁;瘤体直径1.3~5.3 cm,平均(2.52±0.75)cm;病灶位于额叶22例,颞叶13例,顶叶8例,枕叶5例;病理分期Ⅰ期6例,Ⅱ期12例,Ⅲ期9例,Ⅳ期21例。另选取同期在本院行去骨瓣减压术的非脑胶质瘤患者30例为对照组,男17例,女13例;年龄48~76岁,平均(66.54±3.72)岁。2组的性别、年龄差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准通过,所有患者知情同意。
1.2 方法
1.2.1 主要试剂 兔抗人MMP-2单克隆抗体和Bax单克隆抗体(购于美国Epitomics公司);SP法免疫组化试剂盒(购于武汉博士德生物技术有限公司)。
1.2.2 检测方法 2组患者均在术中留取颅脑组织标本,观察组留取脑胶质瘤组织标本,对照组留取相应灶周脑组织标本。所有标本都在手术切除后10 min内,使用浓度为10%的甲醛溶液进行固定,石蜡包埋、连续切片(厚度3 μm)。脱蜡、酒精梯度水化,然后使用枸橼酸盐缓冲液进行抗原修复。室温冷却,PBS冲洗,一抗室温孵育,再次PBS冲洗,二抗37℃孵育,PBS洗涤,DAB显色后冲洗,再复染、脱水、封片。记录患者临床特点,随访至患者死亡,记录中位生存期。
1.2.3 结果判断 MMP-2、Bax均为细胞质着色,细胞质染色即为阳性细胞。高倍镜下随机选择10个视野,观察染色情况,计数500个阳性细胞进行半定量计分。阳性细胞比例≤5%计0分,阳性细胞比例6%~25%计1分,阳性细胞比例26%~50%计2分,阳性细胞比例51%~75%计3分,阳性细胞比例>75%计4分。染色程度计分:细胞无染色计0分,染色细胞呈淡黄色计1分,染色细胞呈黄色计2分,染色细胞呈棕黄色或褐色计3分。阳性评分=阳性细胞比例得分×染色程度得分。阳性评分0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中度阳性(++),>6分为强阳性(+++)。
1.3 统计学处理
采用SPSS 20.0软件处理数据,计数资料以率表示,χ2检验;计量资料以(±s)表示,t检验;采用Kaplan-Meier生存分析法,分析MMP-2、Bax表达与中位生存期的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 2组的MMP-2、Bax蛋白表达水平比较
对照组MMP-2蛋白阳性表达0例,Bax蛋白阳性表达25例(83.33%);对照组MMP-2蛋白阳性表达31例(64.58%),Bax蛋白阳性表达28例(58.33%)。观察组的MMP-2蛋白表达阳性率高于对照组(P<0.05),Bax蛋白表达阳性率低于对照组(P<0.05)。
2.2 不同临床特点胶质瘤患者的MMP-2、Bax蛋白表达对比
不同性别、年龄、病灶位置、病灶直径胶质瘤患者的MMP-2蛋白阳性率、Bax蛋白阳性率比较,差异均无统计学意义(P>0.05)。不同病理分期胶质瘤患者的MMP-2蛋白阳性率、Bax蛋白阳性率差异均有统计学意义(P<0.05)。Ⅰ~Ⅱ期胶质瘤患者的MMP-2蛋白阳性率低于Ⅲ~Ⅳ期者,Bax蛋白阳性率高于Ⅲ~Ⅳ期者(P<0.05),见表1。
2.2 MMP-2、Bax表达与预后的相关性
通过Kaplan-Meier生存分析显示,胶质瘤患者中MMP-2阳性者的中位生存期为16.9月(95%CI 13.6~24.2),MMP-2阴性者的中位生存期为21.5月(95%CI 20.2~25.3)。经Log-rank检验,MMP-2阳性者的中位生存期显著低于阴性者(χ2=16.874,P=0.002)。胶质瘤患者中,Bax阳性者的中位生存期为21.3月(95%CI16.2~25.3),Bax阴性者的中位生存期为16.8月(95%CI13.6~21.1)。经Log-rank检验,Bax阳性者的中位生存期显著高于阴性者(χ2=8.628,P=0.014)。
3 讨论
胶质瘤恶性程度高、呈侵袭性生长是胶质瘤的共同特点。有研究发现胶质瘤病理过程与MMPs家族表达异常存在密切联系,MMPs能对肿瘤细胞周围的细胞外基质造成破坏,肿瘤细胞可通过缺失的细胞外基质向周围组织浸润,从而造成肿瘤的侵袭与转移[3]。MMP-2不仅能对细胞外基质中的明胶Ⅳ型胶原发挥降解作用,还能通过新生毛细血管促进胶质瘤侵袭、转移,是恶性胶质瘤浸润、侵袭的重要标志。本研究发现脑胶质瘤中的MMP-2表达阳性率显著高于正常脑组织,这与国内相关文献报道[4]结论相符。提示MMP-2可能参与胶质瘤的发生、发展过程。陈亮等[5]的研究显示,具有侵袭性的胶质瘤细胞能分泌大量的MMP-2,胶质瘤的侵袭能力、恶性程度均与MMP-2表达量呈正相关。本研究也显示,Ⅲ~Ⅳ期胶质瘤患者的MMP-2阳性率显著高于Ⅰ~Ⅱ期者,这与前述研究结论基本一致。有学者[6]使用siRNA干扰MMP-2表达,发现MMP-2表达降低后,胶质瘤细胞的侵袭能力明显减弱,提示MMP-2可对胶质瘤的发生、发展发挥促进作用,同时MMP-2表达的高低与胶质瘤侵袭能力的强弱密切相关,抑制MMP-2表达有助于降低胶质瘤的侵袭程度。
已有多项研究证实[7,8],检测细胞凋亡相关基因表达可为肿瘤诊断及预后评估提供有效依据。Bcl-2家族蛋白在多数细胞中都发挥着调控Caspase活化与凋亡的重要作用。Bax是Bcl-2家族最重要的促凋亡因子。Bax蛋白移位到线粒体中时,与线粒体膜上的Bcl-2蛋白结合,形成Bax-Bcl-2异二聚体,拮抗Bcl-2的抗凋亡作用[9]。游离Bax也能在线粒体膜上直接形成Bax-Bax同二聚体,改变细胞膜通透性,促使大量的细胞色素C释放到细胞浆中,激活下游Caspase-3,共同促进细胞凋亡[10]。本研究显示,脑胶质瘤的Bax表达阳性率显著低于正常脑组织,并且Ⅲ~Ⅳ期胶质瘤患者的MMP-2阳性率明显比Ⅰ~Ⅱ期者更低。这一结果与于泽奇等[11]报道相符,说明Bax表达量随着胶质瘤病理分期的加重而降低。这可能是因为Bax高表达能发挥诱导胶质瘤细胞凋亡的作用,在Bax蛋白减少、缺失的情况下,细胞将出现凋亡抵抗效应。
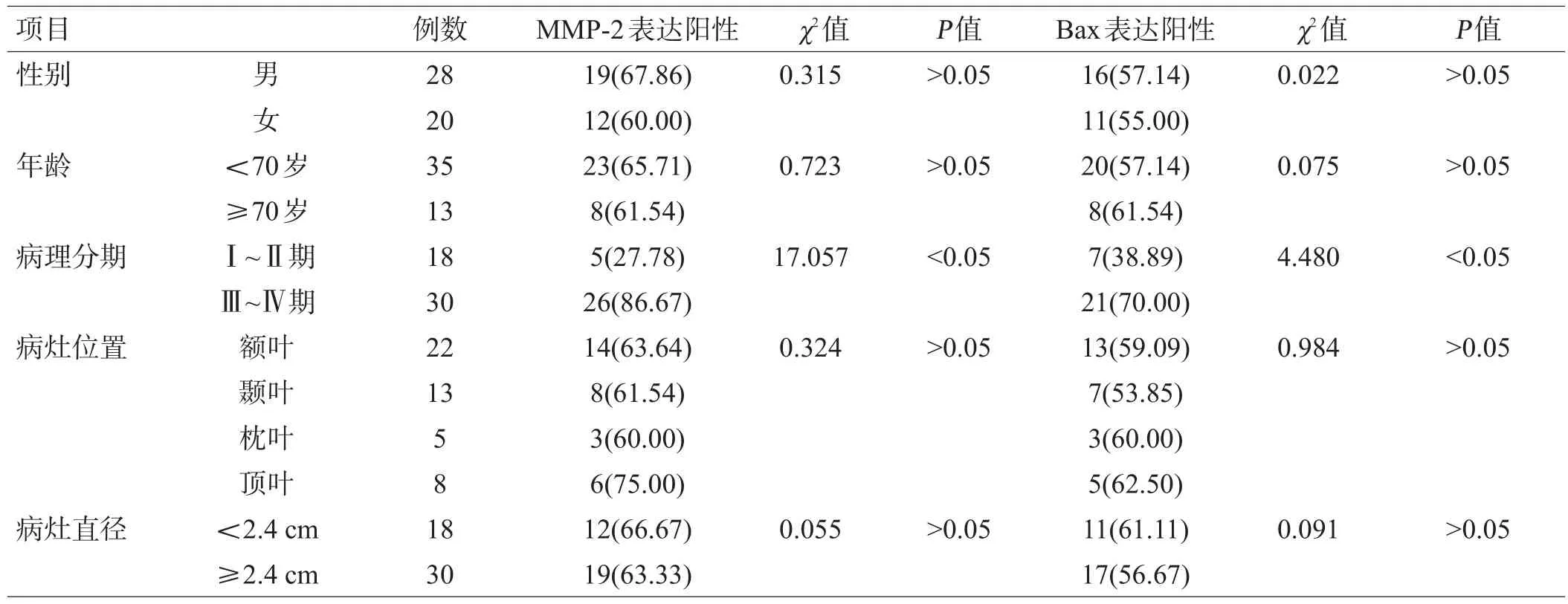
表1 不同临床特点胶质瘤患者的MMP-2、Bax蛋白表达对比[例(%)]
王力夫等[12]报道显示,MMP-2表达阳性的胶质母细胞瘤患者,其死亡率是阴性者的2.75倍。本研究通过Kaplan-Meier生存分析发胶质瘤MMP-2阳性者的中位生存期显著低于阴性者,而Bax阳性者的中位生存期显著高于阴性者,这与国内相关文献报道[12]结论相符,说明MMP-2、Bax均是胶质瘤术后患者预后的独立影响因素,MMP-2高表达、Bax低表达往往预示着不良预后,其可作为胶质瘤术后患者预后预测的有效指标,同时也可作为胶质瘤术后患者的潜在治疗靶点[13]。
综上所述,老年胶质瘤术后患者有MMP-2表达升高、Bax表达降低的特征,MMP-2表达阳性、Bax表达阴性预示着不良预后。
