从Wnt 通路抑制因子表观遗传修饰调控 研究重楼皂苷Ⅶ抗结直肠癌机制
2020-01-01陈鸣旺高舒影刘海光唐清珠罗宏标
陈鸣旺 高舒影 刘海光 唐清珠 罗宏标
结直肠癌(colorectal cancer,CRC)是最常见的癌症之一,也是导致癌症相关死亡的主要原因之一。年新发病例37.63 万人,年死亡率19.10 万人。据统计CRC 在美国的患病率和致死率均排名第三位,尽管在手术技术和新辅助化疗方面取得了相当大的进步,但CRC 的生存率仍未明显提高[1-3]。结直肠癌是一个多步骤过程,涉及遗传和表观遗传改变的逐步积累,癌症发展的分子机制仍不清楚,因此目前治疗选择有限,塞来昔布等非甾体抗炎药对大肠腺瘤有一定的预防作用,而5-氟尿嘧啶等抗代谢物对CRC 患者有治疗作用,但非甾体抗炎药会发生心血管疾病的风险,抗代谢物的持续使用对人体会有一定的毒性,包括骨髓毒性和胃肠道毒性,限制其长期使用[4-5]。因此,需要寻找具有更强特异性和更低毒性的新型治疗性药物。天然产物已被证明是抗癌药物的优良和可靠来源[6],重楼皂苷VII(polyphyllin,PPLVII)是从植物重楼中提取的甾体皂苷类,具有免疫调节、抗炎和抗肿瘤等生物活性[7],已成功应用于预防结直肠瘤变的IIA 期临床试验。重楼是一种百合科植物,重楼根茎中含有多种生物活性成分,如甾体皂苷,从植物中提取的多种皂苷可以抑制肿瘤的生长和转移[8], 例如人参皂苷能有效抑制小鼠结肠癌细胞的转 移[9]。因此,PPLVII 对癌细胞的作用机制值得研究。研究发现miR-590-3p 在结肠癌组织和细胞系中表达上调,miR-590-3p 在体外实验中可以显著促进结肠癌细胞的生长和增殖,研究发现[10]Wnt 抑制因子1(WIF1)和Dickkopf 相关蛋白1(DKK1)是miR-590-3p 的直接靶标。Wnt 通路抑制因子1可以诱导G1 期细胞周期阻滞,可以caspase-3 依赖性的方式触发细胞凋亡,抑制结直肠癌细胞株SW-620 的生长。在本研究中,我们从重楼中提取了一种甾体皂苷即PPLVII,通过小鼠结肠直肠癌模型从Wnt 通路抑制因子1(WIF1)表观遗传修饰调控研究其对结直肠癌细胞影响的机制。
资料与方法
一、实验动物
从Slaccas 实验动物公司(中国上海)获得 30 只5 周龄ICR 雌性小鼠。本实验根据动物保护和使用委员会的标准在无病原体条件下饲养,所有的实验动物程序都符合动物护理和使用委员会的审查和批准。
二、建立结直肠癌小鼠模型和分组
选择30 只小鼠,将小鼠平均分为3 组:对照组、模型组和PPLVII 治疗组。对照组小鼠不作处理。模型组、PPLVII 组小鼠采用腹腔注射1,2-二甲基肼(15 mg/kg),一周后在无菌非酸化饮用水中给予小鼠2%的右旋糖酐硫酸钠进行小鼠结直肠癌模型的建立。从第9 周至实验结束(第20 周),模型组、PPLVII 组小鼠分别腹腔注射生理盐水和PPLVII。每天对小鼠进行外观、食物摄取、体重、粪便浓度、直肠出血的评估,所有小鼠均于第 20 周因过量服用乙醚而死亡。大肠用PBS 冲洗并切除,测量其长度(从回盲交界处到肛门边缘),取肿瘤组织置于10%中性缓冲福尔马林固定至少24 小时进行组织病理学检查。结肠黏膜用玻璃片小心地刮掉,快速置于液氮中储存,直到处理完毕。
三、观测指标及方法
1.采用硅胶柱色谱、SephadexLH-20 凝胶柱色谱和高效液相色谱等分离方法,从重楼根茎醇提物的正丁醇萃取部位分离得到PPLVII。
2. TUNEL 免疫组织化学分析:采用TUNEL法检测小鼠的肿瘤细胞凋亡情况,冷冻切片用4%多聚甲醛固定,用末端脱氧核苷转移酶缓冲液孵育,染色切片在尼康显微镜下观察。
3. 免疫蛋白印迹分析检测β-连环蛋白的表达:分别取肿瘤组织和结肠黏膜组织在裂解缓冲液(pH=7.9)中重新悬浮或匀浆10 mM Hepes, 10 mM KCl,0.1 mM EDTA,1 mm DTT,加上蛋白酶抑制剂亮肽素10 mg/mL,抑肽酶10 mg/mL, 0.1 mmol/L PMSF。15% SDS 聚丙烯酰胺凝胶上电泳,转移至硝化纤维素膜,用含有TBS 的缓冲液阻断,0.05%吐温-20 和5%脱脂牛奶室温下封闭2 小时。然后在48 ℃的温度下用不同的一抗孵育过夜,然后用hrp 偶联的二抗孵育过夜。在含有0.05%吐温-20 的TBS 缓冲液中三次洗涤10 分钟后,使用TMA-6 试剂盒检测,实验独立重复三次。
4. 应用双抗体夹心法ELISA(sandwich ELISA) 检测cleaved caspase-3、cleaved caspase-8、cleaved caspase-9、Bax、Bcl-2 以及Cdk-4、Cdk-6、Cyclin D1 和p21 的表达:①标准品的稀释与加样:稀释后各孔加样量都为50 μL(浓度分别为24 μg/L, 16 μg/L,8 μg/L,4 μg/L,2 μg/L)。②加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。③温育:用封板膜封板后置37 ℃温育30 分钟。④配液:将30(48T的20 倍)倍浓缩洗涤液用蒸馏水30(48T 的20 倍)倍稀释后备用。⑤洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 秒后弃去,如此重复5 次,拍干。⑥加酶:每孔加入酶标试剂50 μL,空白孔除外。⑦温育:操作同③。⑧洗涤:操作同⑤。⑨显色:每孔先加入显色剂A50 μL, 再加入显色剂B50 μL,轻轻震荡混匀,37℃避光显色15 分钟。⑩终止和测定:每孔加终止液50 μL, 终止反应(此时蓝色立转黄色)。以空白孔凋零,450 nm 波长依序测量各孔的吸光度(OD 值)。 测定应在加终止液后15 分钟以内进行。
5. 流式细胞仪检测相关蛋白变化:细胞凋亡检测采用annexin V-FITC/PI 凋亡检测试剂盒,用冰PBS 洗涤,再悬浮在1 个结合缓冲液中(10 mM Hepes/NaOH,pH=7.4),140 mM NaCl,2.5 mM CaCl2,在100 mL 细胞悬液中加入V-FITC 溶液 (25 mg/mL)和5 mL 溶解PI(250 mg/mL)。将细胞轻轻涡旋,室温下置于暗处孵育15 min,加入400 mL 4 ℃结合缓冲液,轻轻搅拌。为了确定细胞周期的分布,收集细胞,用冰水PBS 洗涤,在20 ℃的75%乙醇中固定过夜,1% RNase A 处理20 min 37 ℃,用50 mg/mL PI 染色,流式细胞仪检测荧光强度。
6. TOP/FOP 检测:TOPglow / FOPglow TCF 试 剂盒用于检测Wnt 信号传导途径活性,将细胞接种在6 孔板中,并根据手册用TOPglow 和FOPglow 转染,所有转染一式三份进行并重复至少3 次。
7. 实时荧光定量PCR 检测OCT4、SOX2、c-Myc 和TCF4 相关基因的表达:用TRIzol 提取总RNA,将RNA 在50 mL 无RNase 的水中洗脱并储存在-70 ℃,为了分析基因表达,根据标准方法对含有cDNA 模板,引物和SYBRGreen qPCR Master Mix 的qRT-PCR 混合物系统进行qRT-PCR,使用2-△△Ct方法计算基因表达的倍数变化。
四、统计学分析
本研究中数据全部采用SPSS20.0 统计分析软件(美国IBM 公司)进行处理;计量资料采用均数±标准差()表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验;计数资料采用百分率(%)表示,组间比较采用χ2分析;P <0.05 代表差异有统计学意义。
结 果
一、TUNEL 免疫组织化学分析
与模型组相比,PPLVII 明显诱导肿瘤细胞凋亡。见图1。
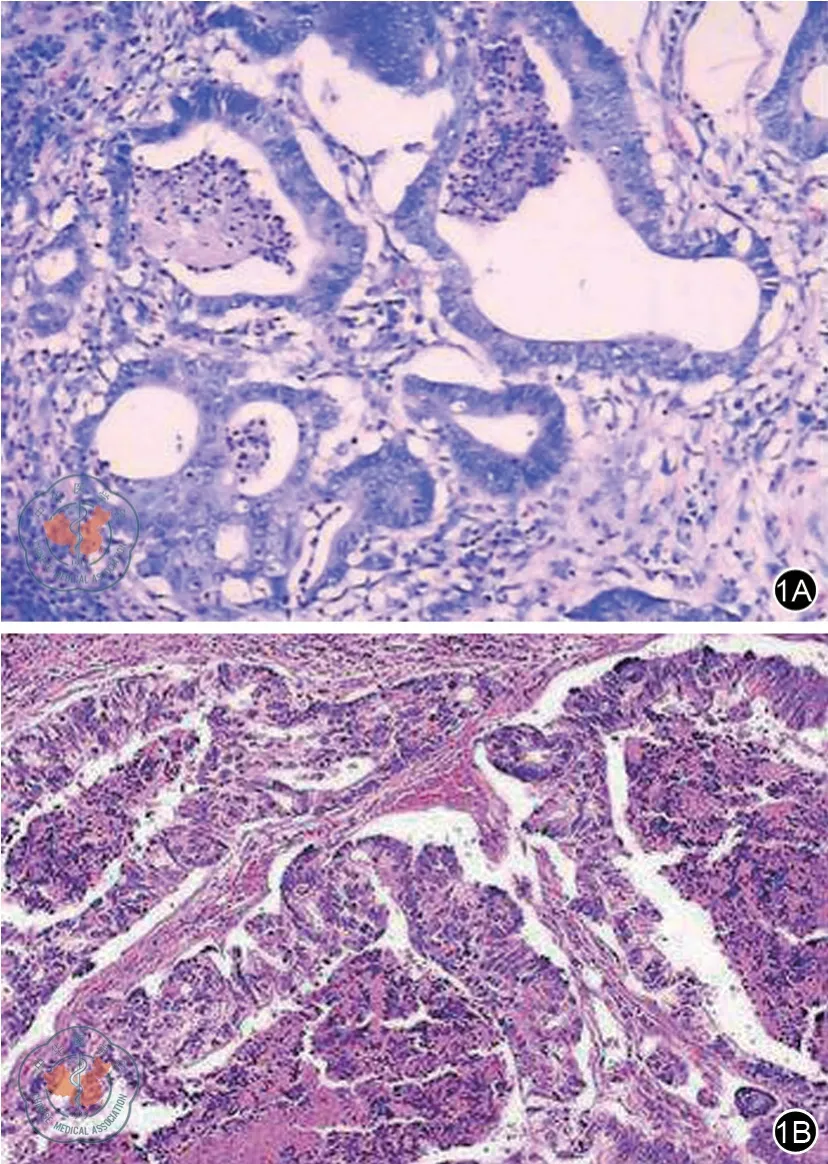
图1 TUNEL 染色确定细胞凋亡水平(×100)。1A:对照组,1B:重楼皂苷VII 治疗组
二、PPLVII 影响细胞凋亡相关蛋白的表达
研究cleaved caspase-3、cleaved caspase-8、cleaved caspase-9、Bax、Bcl-2 在PPLVII 干预后CRC 细胞中表达的情况,表1 数据结果显示,PPLVII 治疗后,cleaved caspase-3、cleaved caspase-8、cleaved caspase-9 和Bax 表达增加(P 均<0.05);Bcl-2在PPLVII 处理后表达降低(P=0.010)。
三、PPLVII 影响细胞周期相关蛋白的表达
为了研究细胞周期变化,评估了Cdk-4、 Cdk-6、Cyclin D1 和p21 的表达,结果如表2 所示。PPLVII 处理后,Cyclin D1、Cdk-4、Cdk-6 表达下降(P 均<0.05);而p21 表达上调(P=0.001)。
表1 PPLVII 影响细胞凋亡相关蛋白的相对表达量(双抗体夹心法ELISA)(,ng/mL)

表1 PPLVII 影响细胞凋亡相关蛋白的相对表达量(双抗体夹心法ELISA)(,ng/mL)
组别 例数 cleaved-caspase-3 cleaved-caspase-8 cleaved-caspase-9 Bax Bcl-2对照组 10 0.75±0.02 0.53±0.04 0.39±0.01 0.26±0.02 0.29±0.04模型组 10 0.19±0.03 0.11±0.03 0.12±0.02 0.15±0.02 0.81±0.02治疗组 10 0.61±0.02 0.48±0.03 0.32±0.01 0.25±0.03 0.38±0.03 F 值 22.962 19.281 16.035 16.859 15.364 P 值 0.001 0.001 0.005 0.007 0.010
四、TOP/FOP 测定Wnt 信号通路活性
在PPLVII 干预治疗后,检测对照组细胞中TOP/FOP 比率为1.86±0.22,模型组为3.48±0.36,治疗组为2.17±0.23,三组比较差异有统计学意义(F=96.072,P <0.001)。
五、β-连环蛋白灰度值检测结果
通过提取细胞中的β-连环蛋白,用免疫蛋白印迹进行检测,根据图2 的结果发现与对照组相比,模型组的检测结果升高(β-连环蛋白灰度值为2.13±0.03),在PPLVII 进行干预治疗后β-连环蛋白灰度值下降为1.29±0.02(t=6.331;P=0.020)。
六、PCR 相关基因表达检测结果
在对各组检测中发现干细胞相关基因,OCT4,SOX2 和TCF4 相对于对照组,其在模型组细胞中表达上调,在PPLVII 进行干预治疗后OCT4、 SOX2、c-Myc 和TCF4 相关基因的表达下调,差异有统计学意义(P <0.02)。见表3。
讨 论
既往研究表明,皂苷对结直肠癌细胞具有显著的细胞毒性[11]。本次研究结果显示,从重楼中分离得到的皂苷类化合物PPLVII,通过降低Wnt 通路抑制因子的表达对CRC细胞具有生长抑制作用。考虑由于PPLVII 对DMH/DSS 诱导的CRC 模型小鼠肠道毒性和癌变有潜在的保护作用,PPLVII 细胞存活率下降部分是因诱导细胞凋亡所致,cleaved caspase-3、cleaved caspase-8、cleaved caspase-9 和Bax 蛋白水平上调,说明PPLVII 诱导的细胞凋亡与内源性凋亡通路密切相关。本次研究还发现,Bcl-2 水平在PPLVII 作用下降低,表明Bcl-2 作为Bcl-2 家族主要的抗凋亡蛋白,参与了诱导凋亡[12]。 因为从一个细胞周期向另一个细胞周期的转变是有序进行的,并通过细胞周期蛋白进行调控,不同的细胞周期蛋白在细胞周期的不同阶段达到其最大活性,细胞周期蛋白D1 在结直肠癌细胞过度表达,它与CDK4 和CDK6 结合形成CDK4/6-cyclin D1复合物是细胞进入G1 期所必需的。由于PPLVII在下调细胞周期蛋白D1、CDK4、CDK6 表达的同时,上调细胞周期蛋白依赖性激酶抑制剂p21 的表达,阻止受损DNA 复制,在CDK 抑制和G1 期阻滞中发挥重要作用。因此,PPLVII 诱导CRC 细胞G1 期阻滞是通过上调p21 表达引起的。这与Ghasemi 等[13]研究结果基本一致。
Wnt 通路在结肠肿瘤发生中起着重要作用,在60%~70%的结肠癌病例中,Wnt 信号被激活,Li 等[14]人研究表明PPLVII 不仅降低了异种移植瘤小鼠模型的肿瘤大小,而且抑制DMH/DSS 诱导的CRC 小鼠模型的肿瘤发生。Wnt 通路抑制因子是miR-590-3p 的潜在靶标, miR-590-3p 直接抑制WIF1 和DKK1 mRNA 转化为成熟蛋白,癌症特异性miRNA 对于理解肿瘤发生中的作用和探索新的治疗靶点有重要的意义。本次研究发现,PPLVII干预治疗通过降低Wnt 通路抑制因子的表达对结直肠癌有一定的改善和治疗作用。Wnt 通路抑制因子下调降低细胞球体形成,WIF1 和DKK1 在调节结肠癌细胞肿瘤发生中起重要作用[15]。WIF1 是一种脂质结合蛋白,可与Wnt 蛋白结合并阻止它们触发Wnt/β-连环蛋白途径,目前WIF1 基因在人结肠癌的外周血中被证实是失调的,并且可以做为有希望的标志物。笔者推测,WIF1 可能参与结肠癌细胞增殖和肿瘤发生,DKK1 通过与LRP 和Kremen蛋白结合阻止β-连环蛋白介导的信号转导,促进细胞分化和凋亡[16]。DKK1 在结肠癌中下调,多个分子通过下调DKK123-32 促进结直肠肿瘤发生,已经证明Wnt/β-连环蛋白信号传导参与结肠癌的发展和促进。Wnt/β-连环蛋白信号传导可被几种与Wnt 配体或降解复合物结合的因子抑制,WIF1、卷曲蛋白相关蛋白和DKK130。WIF1 和DKK1 在结肠癌组织和细胞中受miR-590-3p 的负调控,导致Wnt 信号传导的异常激活[17-18]。
表2 PPLVII 影响细胞周期相关蛋白的相对表达量(双抗体夹心法ELISA)(,ng/mL)
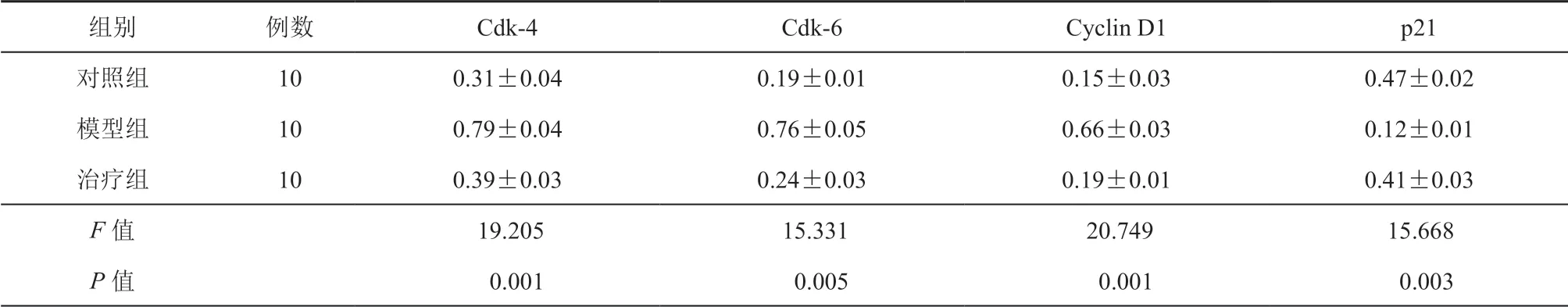
表2 PPLVII 影响细胞周期相关蛋白的相对表达量(双抗体夹心法ELISA)(,ng/mL)
组别 例数 Cdk-4 Cdk-6 Cyclin D1 p21对照组 10 0.31±0.04 0.19±0.01 0.15±0.03 0.47±0.02模型组 10 0.79±0.04 0.76±0.05 0.66±0.03 0.12±0.01治疗组 10 0.39±0.03 0.24±0.03 0.19±0.01 0.41±0.03 F 值 19.205 15.331 20.749 15.668 P 值 0.001 0.005 0.001 0.003
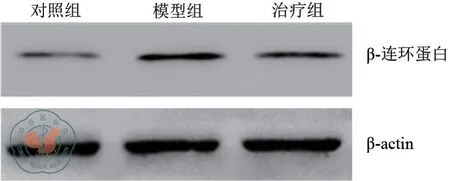
图2 蛋白印迹检测β-连环蛋白水平(WB)
表3 PCR 相关基因表达检测结果()

表3 PCR 相关基因表达检测结果()
组别 例数 OCT4 SOX2 c-Myc TCF4对照组 10 1.00±0.05 1.00±0.05 1.00±0.05 1.00±0.05模型组 10 2.82±0.08 2.21±0.08 3.12±0.22 3.96±0.65治疗组 10 1.34±0.02 1.36±0.02 1.15±0.01 1.11±0.01 F 值 13.762 16.375 20.236 15.766 P 值 0.010 0.016 0.014 0.011
本研究进一步证明,PPLVII 在小鼠模型中通过对WIF1 表达的影响能有效预防结肠炎相关结直肠癌的发生。笔者分析认为,WIF1 表达降低促进干细胞相关标志物的表达,例如OCT4、SOX2 和TCF4。 WIF1 和DKK1 参与Wnt /β-连环蛋白信号传导。WIF1 被抑制可以促进β-catenin 核转位,提高TOP / FOP 比率,降低β-catenin 等与MMP-9 启动子的结合,表明WIF1 在调节Wnt /β-catenin 信号通路中起重要作用,可以导致多个下游基因通过Wnt /β-连环蛋白信号转导激活;WIF1 表达降低还可以增强Cyclin D1、RUNX2 和DMP1 蛋白的表达,促进结直肠癌细胞的凋亡。
