玉竹根际土壤浸提液对蔬菜种子萌发与生长的影响
2019-12-30袁辉李萍芳陈勇漆兴远谌雨薇金晨钟胡一鸿
袁辉 李萍芳 陈勇 漆兴远 谌雨薇 金晨钟 胡一鸿


摘要 [目的]探明玉竹连作障碍形成机制。[方法]从连作玉竹根际土壤中提取浸提液,设置连作玉竹根际土壤浸提液的浓度为5.0、2.0、1.0、0.5 g/mL,分别处理萝卜、芝麻、莴苣种子,研究连作玉竹根际土壤浸提液对3种受体植物种子萌发和幼苗生长的影响。[结果]不同浓度玉竹根际土壤浸提液对萝卜、芝麻、莴苣种子的萌发与幼苗生长均有不同程度的抑制作用。玉竹根际土壤浸提液对莴苣的抑制效果最明显,7 d内各浓度处理莴苣种子均没萌发。随着处理浓度的提高,对萝卜和芝麻种子萌发与幼苗生长的化感效应指数呈上升趋势,5.0 g/mL处理对萝卜和芝麻的化感综合效应指数分别为-0.98和-0.99。[结论]在这3种受体植物中,萝卜最适合作为玉竹的下茬作物,芝麻最適合作为进一步研究玉竹化感作用的受体作物,而对莴苣种子的影响有待确定。
关键词 玉竹;土壤浸提液;蔬菜;种子萌发;生长;影响
中图分类号 S 344.4文献标识码 A
文章编号 0517-6611(2019)23-0058-04
doi:10.3969/j.issn.0517-6611.2019.23.020
开放科学(资源服务)标识码(OSID):
Effects of Extracts from Rhizosphere Soil of Polygonatum odoratum on Germination and Growth of Vegetable Seeds
YUAN Hui1,LI Ping fang1, CHEN Yong1,2et al
(1.Department of Agriculture and Biotechnology,Hunan University of Humanities,Science and Technology,Loudi,Hunan 417000;2.Hunan Provincial 2011 Collaborative Innovation Center,Loudi,Hunan 417000)
Abstract [Objective] In order to explore the formation mechanisms of the continuous cropping obstacles of Polygonatum odoratum. [Method]The rhizosphere soil extracts of P. odoratum were prepared at the concentrations of 5.0,2.0,1.0 and 0.5 g/mL, and the seeds of radish, sesame and lettuce were treated with the extracts to investigate the effects of rhizosphere soil extract of P. odoratum on seed germination and seedling growth of these receptor vegetables. [Result]Different concentrations of rhizosphere soil extracts of P. odoratum had different degrees of inhibition on seed germination and seedling growth of radish, sesame and lettuce. The inhibitory effect on lettuce was the most obvious, and the seeds of lettuce did not germinate until 7 d. With the increase of the extract concentration, allelopathic effect indexes of seed germination and seedling growth of radish and sesame also increased,the allelopathy indexes treated with 5.0 g/mL extracts on radish and sesame were -0.98 and -0.99, respectively. [Conclusion]Among the three receptor vegetables, radish is the most suitable for the next crop of P. odoratum, sesame is the most suitable for further research on receptor allelopathy on P. odoratum, and the effects on lettuce are need to be studied further.
Key words Polygonatum odoratum;Soil extracts;Vegetable;Seed germination;Growth;Effect
玉竹(Polygonatum odoratum(Mill.)Druce)为百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物,是湖南道地中药材,药食均可,药用价值高,具有养阴润燥、生津止渴的功能,可用于肺胃阴伤、燥热咳嗽、咽干口渴、内热消渴[1]。在我国玉竹已有2 000多年的用药历史[2]。制药行业对于玉竹的需求很大,玉竹作为一种良好的补品在市场上也日益备受推崇。
随着同一土地的连作,玉竹表现出明显的连作障碍现象。连作障碍的发生是植物与土壤体系中各种因素的综合效应,包括植物分泌的化感物质引起的对自身的毒害作用、土壤中具有传染性的病害以及理化性状变差等。研究表明,植物化感作用是导致植物连作障碍的主要原因之一[3-4]。化感作用除了在不同的物种之间表现很明显,对于自身的毒害效应也有突出的表现。自毒是连作障碍发生的一个主要原因[5]。前人研究表明,植物分泌物的自毒作用是药用植物连作障碍形成的主要原因之一。连作对药用植物的影响主要有影响植物的基因表达、蛋白质和DNA的合成、细胞膜的生物学功能、抗氧化系统的酶活性以及植物体内激素的酶活性[6-8]。
当前缓解连作障碍的措施主要有化学手段调控以及农业耕作手段,此外施用绿肥以改良土壤也有较好的效果。目前对药用植物连作障碍的研究报道较多,但对于玉竹连作障碍的生理生化机理报道甚少,玉竹的化感自毒物质以及如何控制化感物质对玉竹生长的影响鲜见报道。该试验从玉竹根际土壤浸提液对蔬菜种子萌发与生长影响的角度,研究连作玉竹根际土壤的化感效应,对探明玉竹连作障碍机理、构建玉竹轮作体系具有较为重要的理论意义,对玉竹产业的发展也具有较为重要的现实意义。
1 材料与方法
1.1 试验材料
试验采用的供体材料为连作玉竹根际土壤,均取自娄底市涟源市古塘镇古塘村;受体材料为萝卜、芝麻、莴苣种子,均从本地市场购买。
1.2 试验方法
1.2.1 试验材料的准备。
2015年10月下旬于娄底市涟源市古塘镇古塘村,选择3年生连作玉竹地。于收获期采取剥落法按“S”形选点[9]采集根际土壤。置于室内阴凉风干,粉碎后过2 mm筛,装入自封袋,每袋1 000 g,备用。
1.2.2 土壤浸提液的制备。
取玉竹根际土壤1 000 g,加入3 000 mL 95%的乙醇浸泡提取3次,每次浸泡3 d,每8 h用玻璃棒充分搅拌一次,时间3~5 min,3 d后抽滤,使用旋转蒸发仪减压浓缩(45 ℃,-0.1 MPa)至约10 mL,倒入锥形瓶中,得乙醇提取物。
再用4 000 mL去离子水对经乙醇浸提过的玉竹根际土壤浸提4 d,离心(4 000 r/min,25 ℃,10 min)后,取上清液用定性滤纸过滤,经微孔滤膜(0.45 μm)过滤,于旋转蒸发仪(55 ℃,-0.1 MPa)减压浓缩至浸膏状,倒入三角瓶中,得水提取物。最后合并乙醇提取物和水提取物,保存于4 ℃冰箱中,备用。
1.2.3 土壤浸提液不同浓度溶液的制备。
取100 mL容量瓶,将混合好的连作玉竹根际土壤乙醇提取物和水提取物加入适量蒸馏水充分搅拌倒入容量瓶中,定容至100 mL。得到相当于土壤10 g/mL的溶液(即1 mL中含10 g土壤提取物)作为母液,编号为T10000,分别再取50、20、10、5 mL母液均定容至100 mL,得到5 000、2 000、1 000、500 mg/mL的稀释液各100 mL,编号为T5000、T2000、T1000、T500,4 ℃冰箱保存备用。
1.2.4 化感活性生物测定。
取萝卜、芝麻、莴苣种子适量用75%的乙醇表面消毒30 s,再用无菌水清洗3~5次后,用适量蒸馏水浸泡2 h使其充分吸收水分后,置于铺有两层滤纸的9 cm直径培养皿中,每皿放置30粒种子,分别加入不同浓度的玉竹根际土壤提取物溶液5 mL,并设置蒸馏水对照CK,设置3次重复。将所有处理随机排列,放入组织培养室(25 ℃+1 ℃,12 h/12 h,75%)中培养,每隔24 h补充提取液1 mL,每24 h调查发芽情况,计算发芽势、发芽率和发芽指数;7~10 d后随机调查各受体植物10株的根长和苗长,计算化感综合效应。种子发芽的标准为胚根或胚轴突破种皮1~2 mm[10]。
1.2.5 抗氧化物酶活性的测定。
分别取不同受体植物叶片1.0 g,用试剂盒(购自苏州科铭生物技术有限公司)进行抗氧化酶活性测定,按照试剂盒说明进行测定。
1.2.6 MDA含量测定。
MDA试剂盒从苏州科铭生物技术有限公司采购,按照试剂盒说明进行测定。
1.2.7 数据分析。发芽势、发芽率和发芽指数的计算如下:
发芽势=发芽初期(第3天)正常发芽种子数/供试种子数×100%;
发芽率=发芽终期(第7天)正常发芽种子数/供试种子数×100%;
发芽指数=(Gt/Dt),式中,Gt为第t天的发芽数,Dt为相应的发芽天数。
化感效应参照Williamson等[11]提出的化感效應指数(RI)来衡量化感作用的类型和强度,公式如下:
RI=T/C-1
式中,C为对照值;T为处理值,RI为化感效应指数,RI>0时为促进作用,RI<0时为抑制作用,绝对值的大小与作用强度一致。
所有测定均重复3次。试验数据采用SPSS 13.0软件进行分析,用Duncan test法进行方差分析。
2 结果与分析
2.1 玉竹根际土壤浸提液对受体植物种子萌发的影响
由表1可知,不同浓度的玉竹根际土壤浸提液对萝卜和芝麻种子的萌发均有抑制作用,并随着玉竹根际土壤浸提液浓度的升高,抑制作用越明显。萝卜种子T500处理的发芽势、发芽率和发芽指数分别为82.33%、85.67%、37.97,与对照组相比,均有所下降,但未达显著水平。芝麻种子T500处理的发芽势、发芽率和发芽指数分别为28.00%、50.00%、15.74,与对照差异显著。随着玉竹根际土壤浸提液浓度的升高,萝卜和芝麻种子的发芽势、发芽率和发芽指数总体上都呈下降趋势,萝卜T1000和T2000处理差异不显著,芝麻T500、T1000和T2000之间均未达显著水平。当处理浓度达到5 000 mg/mL(T5000)时,萝卜和芝麻种子的萌发均受到严重影响,发芽率分别为567%和5.33%。
不同玉竹根际土壤浸提液浓度处理的莴苣种子在前7 d均没有发芽,而对照CK发芽率达85.56%。在第8~10天对莴苣种子继续观察,发现500 mg/mL处理的莴苣种子开始发芽,但发芽率很低,且其他处理依然没有发芽迹象,表明玉竹根际土壤浸提液对莴苣种子的萌发有明显的抑制作用。
2.2 玉竹根际土壤浸提液对萝卜和芝麻幼苗生长的影响
由表2可知,不同浓度玉竹根际土壤浸提液对萝卜和芝麻幼苗的生长有不同程度的抑制,对照组萝卜和芝麻的苗高分别为4.36、2.63 cm,根长分别为8.37、4.81 cm。萝卜幼苗的苗高和根长随着浸提液浓度的增加总体呈下降趋势,萝卜和芝麻在T1000处理即浓度为1 000 mg/mL时苗高最低,分别为3.13、0.95 cm,在T2000处理即浓度为2 000 mg/mL时萝卜根长最低,为4.86 cm,T1000处理的芝麻根长最低,为2.00 cm。萝卜T500、T1000与对照差异显著,但各处理之间差异未达显著水平,浓度效应不明显。而各处理对芝麻幼苗的生长呈现出一定的浓度效应,随处理浓度的增加,苗和根的生长抑制越明显。
安徽农业科学2019年
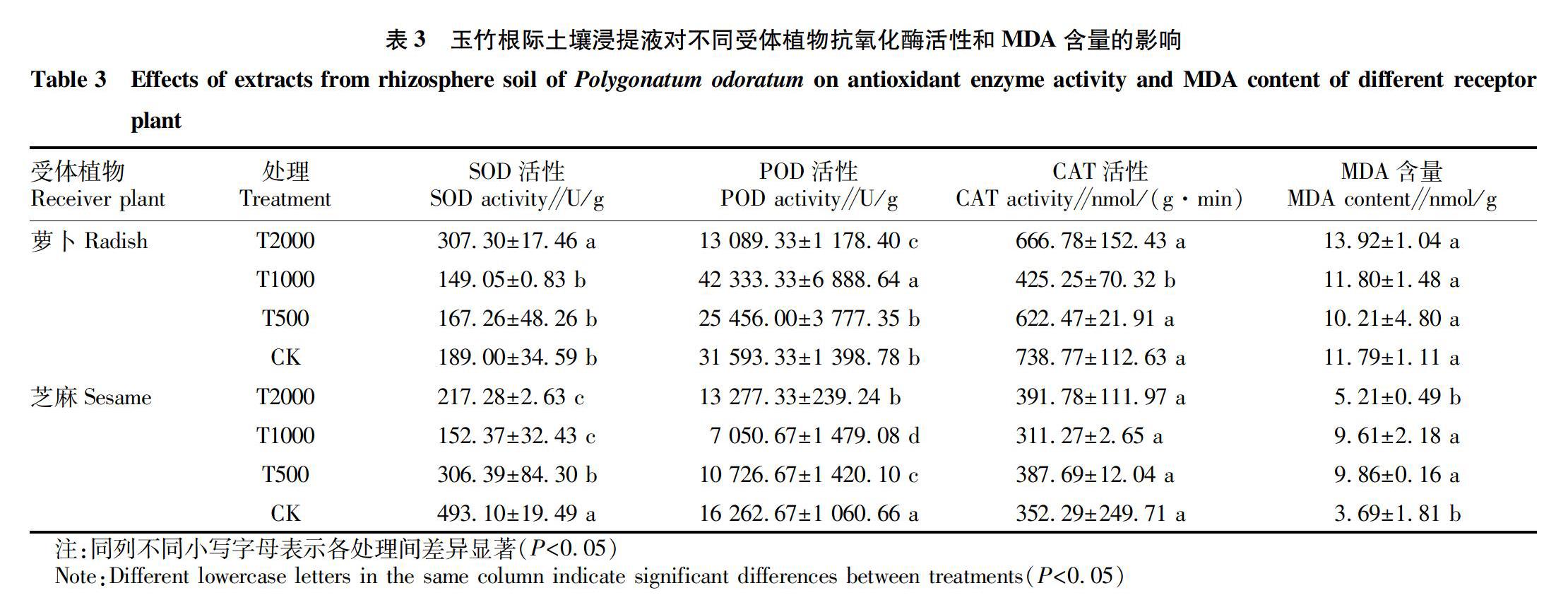
2.3 玉竹根际土壤浸提液对萝卜和芝麻幼苗抗氧化酶活性的影响
2.3.1 对SOD活性的影响。
由表3可见,与对照相比,低浓度处理的萝卜幼苗SOD活性虽有所下降,但差异不显著,当浓度达到T2000处理时SOD活性为307.30 U/g,活性显著升高,表明玉竹根际土壤浸提液可能要达到一定浓度时才可启动萝卜胁迫应答机制,激发萝卜SOD系统。而低浓度玉竹根际土壤浸提液可显著抑制芝麻幼苗的SOD活性,T500处理时SOD活性为306.39 U/g,与对照达显著差异水平,随着处理浓度的增加,芝麻幼苗叶片SOD活性降低,但当达T2000处理时,SOD活性反而升高,SOD活性为217.28 U/g,但差异不显著。
2.3.2 对POD活性的影响。由表3可见,玉竹根际土壤浸提液对萝卜幼苗叶片POD活性的影响表现为随着浓度的升高呈先下降后上升再下降的趋势,其中T500处理虽有所下降,但与对照差异不显著,T1000处活性最高,为42 333.33 U/g,T2000处理的活性降至13 089.33 U/g。而对芝麻幼苗叶片POD活性的影响表现为先下降后上升的趋势,T1000处理的芝麻幼苗叶片POD活性最低,为7 050.67 U/g,对照组POD活性为16 262.67 U/g。
2.3.3 对CAT活性的影响。由表3可见,
随着玉竹根际土壤浸提液处理浓度的增加,萝卜幼苗叶片CAT活性呈现先下降后上升的趋势,T1000处理的萝卜CAT活性最低,为425.25 nmol/(g·min),对照组CAT活性为738.77 nmol/(g·min),二者差异显著,其余三个处理CAT活性无明显差异。不同粗提物浓度处理的芝麻CAT活性均无明显差异。
2.4 玉竹根际土壤浸提液对萝卜和芝麻幼苗MDA含量的影响
由表3可见,不同玉竹根际土壤浸提液浓度处理的萝卜幼苗叶片MDA含量呈逐渐上升趋势,但与对照差异均不显著,T500、T1000、T2000处理的萝卜幼苗MDA含量分别为10.21、11.80、13.92 nmol/g。而玉竹根际土壤浸提液对芝麻幼苗MDA含量的影响显著,低浓度处理对幼苗叶片造成了较大伤害,显著提高了MDA含量,T500、T1000处理的MDA含量分别为9.86、9.61 nmol/g,但当处理浓度达到T2000时,MDA含量反而下降,含量为5.21 nmol/g,与T1000处理差异显著,与蒸馏水(CK)差异不显著。
2.5 玉竹根际土壤浸提液对萝卜和芝麻种子萌发与幼苗生长的化感综合效应
将发芽势、发芽率、发芽指数、苗高、根长、SOD、POD、CAT、MDA这9项指标进行综合分析,可反映玉竹根际土壤对萝卜和芝麻种子萌发与幼苗生长的总体化感效应程度。从表4可看出,化感综合效应在-0.99~-0.15,总体上表现为不同浓度的玉竹根际土壤浸提液对萝卜和芝麻种子萌发与幼苗生长均具有化感抑制作用,且在同一处理浓度下,萝卜受到的抑制效应均低于芝麻。
3 讨论
3.1 玉竹根际土壤浸提液对不同受体植物种子萌发和生长的影响
因種子萌发和生长初期对外界环境的变化较为敏感,所以研究者常把种子萌发与幼苗生长的状况作为植物抗逆性评价的标志[12-14]。一般来说,外界环境胁迫效应越强,对受体植物生长的抑制作用越明显,但不同的植物对环境胁迫的响应不同[15-16]。张志忠等[17]研究发现莴苣对环境胁迫的响应较萝卜更为明显。该研究发现,玉竹根际土壤浸提液的4个浓度均对3种受体植物种子的萌发与生长产生了抑制作用,其中对莴苣种子的影响最明显,7 d内各浓度处理均没有萌发,而对照发芽率已达85.56%,表明玉竹根际土壤浸提液对莴苣种子萌发的化感作用很强,但不同浓度玉竹根际土壤浸提液对莴苣种子萌发的影响还有待进一步研究。
植物化感物质对不同植物的化感作用不一[18-19],化感综合效应也随之改变。随着玉竹根际土壤浸提液浓度的增加,抑制作用总体上呈上升趋势,T5000处理对萝卜和芝麻种子萌发抑制效果最强,综合化感效应分别为-0.98和-0.99。根据化感综合效应分析,相同浓度的玉竹根际土壤浸提液对芝麻种子萌发与幼苗生长的化感综合效应均较萝卜强,表明芝麻对玉竹根际土壤提取液的化感作用更敏感,可作为进一步研究玉竹化感作用的受体作物。玉竹根际土壤浸提液对萝卜种子萌发有一定程度的抑制作用,但对幼苗生长影响较小,可考虑作为玉竹下茬作物选择。
3.2 玉竹根际土壤浸提液对不同受体植物幼苗抗氧化酶活性与MDA含量的影响
正常生长条件下,植物体内的SOD、POD、CAT等保护酶系统能有效清除代谢产生的活性氧[20-21],实现活性氧代谢平衡,而当植物受到外界环境胁迫时,活性氧浓度增加,植物清除自由基的能力减弱,打破活性氧的动态平衡,发生膜脂过氧化作用[22-23],植物细胞受损,生长受到抑制,同时体内抗氧化酶活性也会发生相应的改变[24-25]。该试验研究发现,不同受体植物的抗氧化酶系统对玉竹根际土壤浸提液有不同的响应。T500处理萝卜时,SOD、POD、CAT活性与对照差异均不显著,而对芝麻SOD、POD有显著的抑制作用,表明玉竹根际土壤浸提液对芝麻抗氧化酶活性的抑制作用更明显。随着玉竹根际土壤浸提液浓度的增加,萝卜幼苗叶片SOD、CAT活性呈现先降后升的趋势,POD活性呈现先升后降的趋势,与许可成等[26]、董淑琦等[27]其他作物化感作用的研究结果类似,推测是POD的产物抑制了SOD、CAT的活性。
MDA是膜脂过氧化的指标,张志忠等[17]研究发现,随着空心莲子草的水浸液浓度升高,萝卜和生菜的MDA含量逐渐增加,但无显著性差异。在该试验中,T1000处理显著提高了萝卜POD活性,但各浓度处理对MDA含量均无显著差异,这可能是T1000浓度处理启动了萝卜POD防御系统,T2000处理启动了萝卜SOD、CAT防御系统,有效地缓解了玉竹根际土壤浸提液对萝卜抗氧化酶活性的抑制作用,从而减轻对萝卜叶片的伤害。而随着玉竹根际土壤浸提液浓度的增加,芝麻幼苗叶片SOD、POD活性呈现先降后升的趋势,各处理CAT活性无显著差异,MDA含量逐渐下降,T1000处理SOD、POD活性最低,导致清除氧自由基能力下降,MDA含量显著上升,当处理浓度达T2000时,SOD、POD活性显著上升,导致MDA含量显著下降,这可能是T2000处理激活了芝麻幼苗SOD、POD防御系统,有效减缓了玉竹化感物质的毒害作用。植物受到环境胁迫时,会启动自身的防御系统,提高抗氧化酶活性,来清除因胁迫产生的活性氧,达到体内活性氧代谢的平衡[28]。该试验中萝卜和芝麻响应玉竹根际土壤浸提液可能启动抗氧化酶防御系统的浓度不同,表明不同植物对环境胁迫的响应敏感度不同,可见芝麻更容易受到玉竹根际土壤浸提液的毒害。
综上所述,萝卜、芝麻、莴苣种子对不同浓度的玉竹根际土壤浸提液的胁迫响应的敏感度不同,不同浓度的玉竹根际土壤浸提液对芝麻种子萌发與幼苗生长的化感综合效应较萝卜强,莴苣种子在不同浓度处理中发芽率均很低,推测莴苣可能比萝卜、芝麻对玉竹根际土壤浸提液更敏感。当受到外界环境胁迫时,不同植物的保护酶系统的激活点不一样,且SOD、POD、CAT活性的激活点也不一致,三者共同维持活性氧的动态平衡,减少植物受到外界胁迫时所受到的毒害作用。
参考文献
[1] 国家药典委员会.中华人民共和国药典(2005年版)[S].北京:化学工业出版社,2005:57-58.
[2] 晏春耕,曹瑞芳.玉竹的研究进展与开发利用[J].中国现代中药,2007(4):33-37.
[3] 张重义,林文雄.药用植物的化感自毒作用与连作障碍[J].中国生态农业学报,2009,17(1):189-196.
[4] 杨田甜,杜海荣,陈刚,等.植物化感作用的研究现状及其在农业生产中的应用[J].浙江农业学报,2012,24(2):343-348.
[5] 林文雄,熊君,周军建,等.化感植物根际生物学特性研究现状与展望[J].中国生态农业学报,2007,15(4):1-8.
[6] 张子龙,王文全.药用植物连作障碍的形成机理及其防治[J].中国农业科技导报,2009,11(6):19-23.
[7] 林文雄,何海斌,熊君,等.水稻化感作用及其分子生态学研究进展[J].生态学报,2006,26(8):2687-2694.
[8] 史刚荣.植物根系分泌物的生态效应[J].生态学杂志,2004,23(1):97-101.
[9] 崔翠.渭北黄土区农林复合系统核桃根际土壤及根系分泌物化感作用研究[D].杨凌:西北农林科技大学,2012.
[10] 张利霞,常青山,侯小改,等.不同钠盐胁迫对夏枯草种子萌发特性的影响[J].草业学报,2015,24(3):177-186.
[11] WILLIAMSON G B,RICHARDSON D.Bioassays for allelopathy:Measuring treatment responses with independent controls[J].Journal of chemical ecology,1988,14(1):181-187.
[12] SHARMA N P,SHARMA R.Crop response to abiotc stresses of effluent,salinity and heavy metal I Comparative percentage seed germination in mustard and wheat[J].Agricultural research & technology:Open access journal,2017,3(3):1-5.
[13] PARTHEEBAN C,CHANDRASEKHAR C N,JEYAKUMAR P,et al.Effect of PEG induced drought stress on seed germination and seedling characters of maize(Zea mays L.)genotypes[J].International journal of current microbiology and applied sciences,2017,6(5):1095-1104.
[14] JAMIAN S S,MEHRANI S,ASILAN K S,et al.The effects of salinity stress on seed germination and seedling growth of three medicinal plants[J].International journal of farming and allied sciences,2014,3(3):299-303.
[15] OPARA EMMA U,EYENUKANG,EDUWEM M.Plant stress as initiated by environmental and biological factors A review [J].Scholars journal of agriculture and veterinary sciences,2017,4(5):191-198.
[16] WANG X D,OU YANG C,FAN Z R.Effects of exogenous silicon on seed germination and antioxidant enzyme activities of Momordica charantia under salt stress[J].Journal of animal and plant sciences,2010,6:700-708.
[17] 张志忠,石秋香,孙志浩,等.入侵植物空心莲子草对生菜和萝卜的化感效应[J].草业学报,2013,22(1):288-293.
[18] WEBBER C L III,WHITE P M,JR,LANDRUM D S,et al.Sugarcane field residue and root allelopathic impact on weed seed germination[J].Journal of agricultural science,2018,10(1):66-72.
[19] WEBBER C L III,WHITE P M,JR,LANDRUM D S,et al.Sugarcane field residue and bagasse allelopathic impact on vegetable seed germination[J].Journal of agricultural science,2017,9(11):10-16.
[20] FENG J,SHEN Y B,SHI F H,et al.Changes in seed germination ability,lipid peroxidation and antioxidant enzyme activities of Ginkgo biloba seed during desiccation[J].Forests,2017,8(8):286.
[21] SUBIN M P,FRANCIS S.Phytotoxic effects of cadmium on seed germination,early seedling growth and antioxidant enzyme activities in Cucurbita maxima Duchesne[J].International research journal of biological sciences,2013,2(9):40-47.
[22] 胡一鴻,王梦龙,袁盛建,等.戊二醛胁迫对黑藻光合作用及抗氧化酶活性的影响[J].农业环境科学学报,2013,32(6):1143-1149.
[23] 许秋瑾,金相灿,王兴民,等.不同浓度铵态氮对镉胁迫轮叶黑藻生长及抗氧化酶系统的影响[J].应用生态学报,2007,18(2):420-424.
[24] WEIR T L,PARK S W,VIVANCO J M.Biochemical and physiological mechanisms mediated by allelochemicals[J].Current opinion in plant biology,2004,7(4):472-479.
[25] FU J J,LIU J,YANG L Y,et al.Effects of low temperature on seed germination,early seedling growth and antioxidant systems of the wild Elymus nutans Griseb.[J].Journal of agricultural science and technology,2017,19:1113-1125.
[26] 许可成,魏小红,赵萌,等.麻花秦艽水浸提液对紫花苜蓿和小麦种子萌发和幼苗生长的影响[J].草业科学,2015,32(3):413-420.
[27] 董淑琦,原向阳,胡春艳,等.谷子秸秆水浸提液对下茬冬小麦苗期化感作用的影响[J].中国农业大学学报,2015,20(5):31-38.
[28] 朱鹏锦,庞新华,梁春,等.低温胁迫对甘蔗幼苗活性氧代谢和抗氧化酶的影响[J].作物杂志,2018(4):131-137.
