纤维素分解菌酶活测定空白处理方法的改进
2019-12-27王进军曹慧慧
王进军,沈 谦,曹慧慧,薛 藩
实验教学研究
纤维素分解菌酶活测定空白处理方法的改进
王进军,沈 谦,曹慧慧,薛 藩
(扬州大学 环境科学与工程学院,江苏 扬州 225127)
在酶活测定过程中空白酶活的正确测定具有非常重要的意义。该文以纤维素分解菌的酶活测定为例,介绍了目前处理空白样品的3种主要方法,并经过对比研究,提出目前最佳的空白处理方法为灭活酶液+底物空白,并进一步优化为离心+灭活酶液+底物空白的方法。面对本科生的该综合性实验,将微生物学和生物化学的实验技术相结合,大大提高了学生的实验技能。
纤维素分解菌;空白酶活;空白处理
1 纤维素空白酶活测定的必要性
纤维素分解菌酶活的测定能够直观精确地判定某种微生物分解纤维素能力的大小。康纪婷[1]整理发现,测量纤维素酶活一般有CMC-Na法和FPA滤纸法。值得注意的是,纤维素酶并不是一种特定的酶,而是由内切葡萄糖酶、纤维二糖水解酶和β-葡萄糖苷酶组合而成的复合酶[2]。CMC-Na法主要测定的是菌株产生内切葡萄糖酶的能力,因为内切葡萄糖酶可以直接分解羟甲基纤维素纳从而产生还原糖,CMC-Na法测定出的酶活并不能代表菌株的酶活,但对整个菌株的酶活有参考意义;因为FPA法分解的是滤纸,其主要成分是纤维素,纤维素分解菌在分解滤纸的过程中是内切葡萄糖酶、纤维二糖水解酶和β-葡萄糖苷酶3种酶相互协同分解的结果[3-4],所以FPA法测出的酶活更能代表菌株整体分解纤维素的能力。
这两种方法在测定过程中均要进行空白测定。传统上由于研究者可能采取不同的空白处理方法,使得同一样品的空白值的测定结果不准确、且不具有可比性。因此,在用上述两种方法进行酶活测定时,空白对照组的设置非常关键。因为如果各实验室采取的空白设置各不相同,测定方法不一,测量结果就不具有可比性,也就无法判断酶活的精确数值。另一方面,不同的空白设置对空白值的影响很大。例如,有些空白设置简单而单一,未排除所有可能影响酶活测定的因素,若不能有效地设置空白对照组,将会对酶活的测定产生很大影响。因此,设置空白对照组的目的就在于准确地测出空白值[5],再根据实际值=测量值-空白值,就能够准确地测量一株纤维素分解菌的酶活力。综上,通过规范空白组设置,即可避免国际理论和应用化学协会(IUPAC)[6]对纤维素酶活测定过程无明确空白要求而产生的实验误差,从而使各实验室测量的酶活结果具有可比性。
2 空白设置的思路、方法
2.1 思路、方法
采用CMC-Na法测定纤维素酶活时,取0.5 mL菌液加到1.5 mL的 CMC-Na试剂中,在50 ℃条件下水浴30 min,然后加入1.5 mL的DNS试剂,沸水浴5 min后立即冷却,用蒸馏水定容至25 mL后在520 nm波长处测吸光度[7]。采用FPA滤纸法测定纤维素酶活时,将1.5 g的滤纸加到0.5 mL的菌液中,在50 ℃条件下水浴30 min,然后加入1.5 mL的DNS试剂,沸水浴5 min后立即冷却,用蒸馏水定容至25 mL后在520 nm波长处测吸光度[8]。
实验原理为,纤维素分解菌在适宜的条件下分解CMC-Na或者滤纸产生还原糖,沸水浴时还原糖将DNS试剂还原[9-10],呈现出颜色的变化。在此实验过程中,任何外来的还原糖都会改变酶活力的测定结果。在用滤纸法测定酶活力时,除了分解菌分解滤纸产生的还原糖,还原糖的来源可能还有菌液中自带的和滤纸中自带的。因此,空白处理有以下3种设置方法:底物空白、酶液空白和灭活酶液+底物空白。
2.2 底物空白
底物空白就是在上述实验过程中不加入CMC-Na或滤纸,而是以等体积的蒸馏水代替CMC-Na或滤纸[9],再加入一定量的菌液,然后按照相同的实验步骤测出底物空白的吸光度。因为没有原料可以被纤维素分解菌分解,水浴温度又不足以杀死分解菌释放细胞物质,所以底物空白测出的还原糖只能来源于菌液中自带的还原糖。
2.3 酶液空白
酶液空白就是将上述实验中的菌液用等体积的蒸馏水代替,再按相同的实验步骤测出酶液空白的吸光度。因为没有任何纤维素分解菌分解CMC-Na或滤纸,水浴温度又不足以杀死分解菌释放细胞物质,所以酶液空白测出的还原糖只能来源于CMC-Na溶液或滤纸。
管斌[11]等人研究发现,以蒸馏水作空白测定滤纸酶活时,空白酶活为6.53 U/mL;以底物作空白测定滤纸酶活时,空白酶活为4.48 U/mL[12],空白对酶活测定的差异率达31.4%,使得纤维素酶活的测定值失去了可比性[11](见表1)。
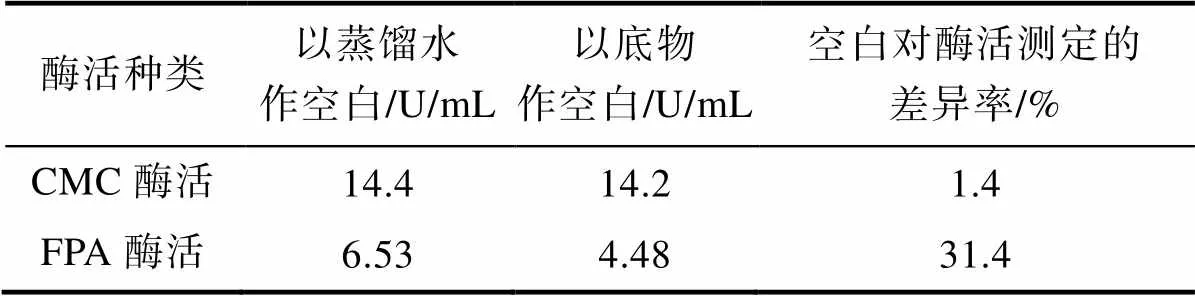
表1 不同空白实验对酶活力测定的影响
这说明用CMC-Na法测定纤维素分解菌酶活,当以蒸馏水和底物作空白时,空白对酶活的差异率为1.4%,可以忽略不计;用FPA法测定纤维素分解菌酶活时,选用酶液空白测定纤维素分解菌空白酶活时,空白酶活的数值将会出现较大偏差,从而影响纤维素分解菌酶活的真实值。
2.4 灭活酶液+底物空白
这种空白处理就是先将待测菌液作灭活处理,再按照上述底物空白的方法进行处理。目前对菌液的灭活有两种方法。一是将菌液在沸水中杀菌5~25 min,另一种是将菌液放入高压蒸汽灭菌锅中灭菌20 min[13]。在邹水洋[14]等人的研究中,100 ℃灭酶活与121 ℃灭酶活相比,会产生较大的负偏差,即偏差程度与保温时间成负相关[14]。在其测定的对象中,酶样A的负偏差为9.2%~31.0%,酶样B的负偏差为13.8%~29.7%[14](见图1)。这说明菌液中含有的纤维素分解酶具有较高的耐热性,在沸水浴中杀菌5~25 min后仍具有部分酶活力;而121 ℃高压蒸汽灭菌20 min后则可彻底灭菌[15-16]。两种灭菌方法的比较如表2所示。
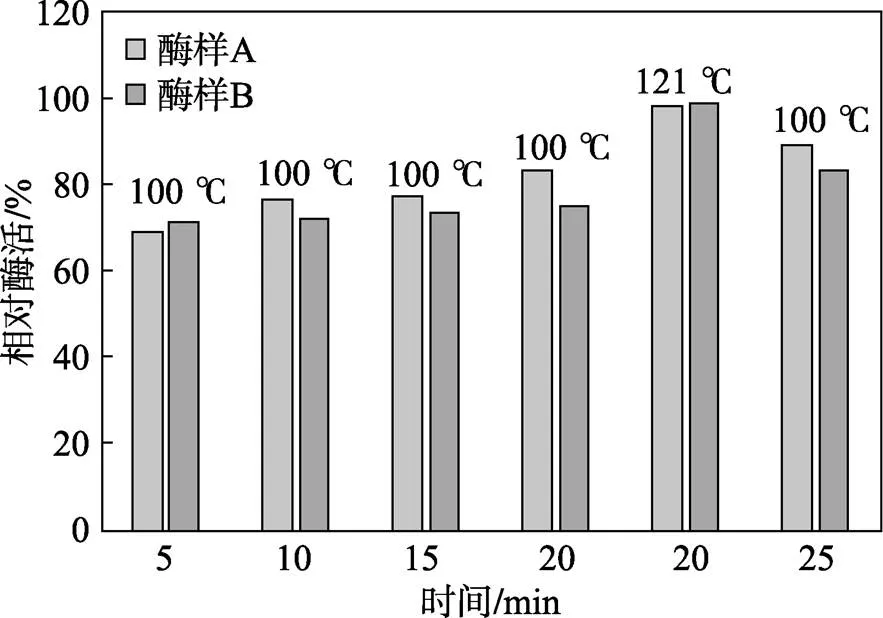
图1 灭酶活时间对酶活力测定的影响

表2 100℃和121℃灭菌的优缺点
因此,如果需要精确地测定酶活力,应选用高压蒸汽灭菌法,如果是简单比较两株菌酶活的高低则可选用沸水浴灭菌法。而不论用哪种灭菌法,灭菌完 成后的菌液中的还原糖只能来源于菌液中自带的还原糖或(和)纤维素分解菌在灭活时细胞裂解释放的还 原糖。
2.5 3种空白测定方法比较
综上所述,3种空白测定方法的优缺点如表3所示。

表3 3种空白酶活测定方法比较
2.6 离心+灭活酶液+底物空白
根据以上3种空白处理方法的对比,灭活酶液+底物空白方法能够将菌液中自带的还原糖和滤纸中的还原糖计算在内,是误差最小的空白处理方法,也是目前测量纤维素分解菌酶活时最常见的空白处理方法,但在灭菌过程中细胞裂解产生的还原糖却被忽略。因此提出先将菌液进行离心处理,再进行灭菌处理的空白处理方法。
实验步骤为,先将菌液在13 770 r/min的高速离心机上离心10 min,然后将离心后的菌液高压灭菌 20 min,最后加入CMC-Na或滤纸,在50 ℃条件下水浴30 min后,加入DNS试剂测量吸光度。
这种空白测定方法,不仅能保留菌液中本身存在的还原糖,而且经过高速离心后,绝大部分的纤维素分解菌沉淀在离心管底部,吸取上清液再进行灭菌时,即可排除由于细胞裂解产生的还原糖对空白测定的干扰。此时还原糖的来源只有菌液本身和滤纸,是误差最小的空白处理方法。
本实验设置了5组不同的处理酶液的方法加以验证:(1)不经过处理的粗酶液;(2)离心(13 770 r/min,离心10 min)后的酶液;(3)121 ℃灭菌后的酶液;(4)121 ℃灭菌后又经离心处理(13 770 r/min,离心10 min)的酶液;(5)先离心处理(13 770 r/min,离心10 min)后121 ℃灭菌的酶液。经过与CMC-Na反应后的吸光度数值如图2所示。

图2 五组样品吸光度对比
第4组与第5组的灭菌和离心顺序不同,目的在于寻找这两种方法的差异性。结果显示,与第5组相比,第4组多出了在灭菌时细胞裂解释放的还原糖,吸光度略大;与第3组相比,第4组少了部分可能黏附在细胞体上的还原糖,吸光度略小。第5组样品的酶液吸光度最小,为0.072,比第3组的0.092高出27.8%,说明菌液经过121 ℃灭活后,菌种释放的一定量的还原糖物质溶解在菌液中;而菌液经过离心处理后,只有极少量的菌种存在于菌液中,所以经过高压灭菌后溶解在菌液中的还原糖物质更少。
本实验初步验证了先离心再灭菌空白处理(方法5)的可行性,并说明空白处理方法的误差最小。
3 教学实践
本实验是我校环境科学与工程学院实验教学中心为本科生设计的综合性实验项目。项目承接环境微生物学实验和基础生物化学实验两门课程,是对其内容的延伸。在这两门实验课程中,学生分别构建了从不同环境样品中筛选出的具有纤维素酶活的微生物,并测定了纤维素酶活。本实验项目是在以上实验基础上,发现并解决在测定酶活过程中的空白处理问题,是对学生了解、掌握并综合运用所学课程知识的一次锻炼和检验,并通过实验完善了知识体系。
该实验持续时间较长,因此需合理安排时间,实验原理讲解应穿插在实验期间的灭菌和离心过程的间隙进行。
4 结语
本研究在滤纸法测定纤维素分解菌酶活时,确定了以121 ℃灭活酶液+底物空白为最佳空白处理方法,可同时排除菌液和滤纸中所含还原糖对实际酶活测定结果的影响。在此基础上又作了进一步优化,即提出了离心+ 121 ℃灭菌+底物空白处理方法,为进一步精确测定酶活空白值提供了新的方法,同时使不同实验室、不同菌种之间酶活的测定结果具有了可比性。
该实验融合了微生物培养技术、生化分析技术和微生物生长特性分析等方面的技能,使学生提升了多学科知识综合运用能力,强化了实践技能和创新能力,开阔了视野,激发了参与实验和科研的积极性和主动性。
[1] 康纪婷,吴翔,甘炳成,等. 纤维素酶活力测定方法[J]. 河北农业科学,2010, 14(4): 151–153.
[2] 汪维云,朱金华,吴守一. 纤维素科学及纤维素酶的研究进展[J]. 江苏理工大学学报,1998(3): 20–28.
[3] 赵钰. 产纤维素酶菌株的筛选及酶学性质研究[D]. 沈阳:沈阳农业大学,2017.
[4] 王盼星,陶施淼,薛藩. 纤维素降解菌研究进展[J]. 绿色科技,2018(12): 161–163.
[5] 张盼,刘婉瑜,李晓秀,等. 高效纤维素优势分解菌的筛选和鉴定[J]. 中国土壤与肥料,2017(2): 149–156.
[6] GHOSE T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 2013, 59(2): 257–268.
[7] 王颖. 纤维素酶产生菌的筛选[J]. 牡丹江医学院学报,2009, 30(4): 90–92.
[8] 张云峰,杨井泉,高磊,等. 产纤维素酶菌株的筛选与产酶测定[J]. 黑龙江畜牧兽医,2018(13): 207–210, 247.
[9] 孙一博. 高效纤维素降解菌的筛选鉴定及特性研究[D]. 哈尔滨:东北农业大学,2013.
[10] 张瑞萍. 纤维素酶的滤纸酶活和CMC酶活的测定[J]. 印染助剂,2002(5): 51–53.
[11] 管斌,谢来苏,丁友昉,等. 纤维素酶酶活力测定方法的校正[J]. 无锡轻工大学学报,1999(4): 20–26.
[12] 姜心,陈伟,周波,等. 纤维素酶活测定影响因素的研究[J]. 食品工业科技,2010, 31(5): 65–68.
[13] 张盼. 高效纤维素分解菌的筛选及其包埋固定化[D]. 哈尔滨:东北农业大学,2017.
[14] 邹水洋,郭祀远.空白实验及测试条件对纤维素酶活测定的影响[J]. 食品工业科技,2010, 31(6): 344–346.
[15] 张席,周晓燕,魏娜,等. 高压蒸汽灭菌器灭菌效果的监测与分析[J]. 食品工业,2011, 32(12): 96–98.
[16] 黄惠兴,王平原,邓远玲,等. 微生物实验室培养基高压蒸汽灭菌效果的监测[J]. 职业与健康,2012, 28(10): 1223–1225.
Improvement of blank treatment method for determination of cellulose-decomposing bacteria enzymatic activity
WANG Jinjun, SHEN Qian, CAO Huihui, XUE Fan
(College of Environmental Science and Engineering, Yangzhou University, Yangzhou 225127, China)
It is very important to determine the blank enzymatic activity correctly in the process of enzymatic activity determination. By taking the determination of cellulose-decomposing bacteria as an example, this paper introduces three main methods of treating blank samples at present, and through comparative study, and puts forward that the best blank treatment method at present is inactivated enzyme solution + substrate blank. The method of centrifugation + inactivated enzyme solution + blank substrate is further optimized. Faced with the comprehensive experiment of undergraduates, the experimental techniques of microbiology and biochemistry are combined, which greatly improves the students’ experimental skills.
cellulose-decomposing bacteria; blank enzyme activity; blank treatment
G642.0; Q936
A
1002-4956(2019)12-0154-03
10.16791/j.cnki.sjg.2019.12.036
2019-03-29
国家自然基金面上项目(81873877);教育部留学回国人员科研启动基金项目(20151098);扬州大学高层次人才科研启动基金、本科专业品牌化建设与提升工程项目(ZYPP2018C017);扬州大学“青蓝工程”、教改课题(YZUJX2016-37C)
王进军(1979—),男,江苏海安,博士,副教授,长期从事“环境微生物学”理论课及实验课教学工作。E-mail: wangjinjun@yzu.edu.cn
