Sakaguchia cladiensis对磺胺甲嘧啶/铜复合污染中抗生素的降解
2019-12-26曾洁仪曾苏杭纪梦钿韩伟江陈烁娜
曾洁仪,曾苏杭,纪梦钿,檀 笑,韩伟江,,陈烁娜*
Sakaguchia cladiensis对磺胺甲嘧啶/铜复合污染中抗生素的降解
曾洁仪1,曾苏杭1,纪梦钿1,檀 笑2,韩伟江1,2,陈烁娜1*
(1.华南农业大学资源环境学院,广东 广州 510642;2.生态环境部华南环境科学研究所,广东 广州 510655)
以某畜禽养殖场土壤筛选分离到的一株对磺胺甲嘧啶(Sulfamethazine,SMZ)具有耐受性的酵母菌(,A5)为研究对象,开展生长特性及其对SMZ-Cu2+复合污染中SMZ降解特性研究.结果表明,SMZ和Cu2+胁迫下,菌A5也能较好生长.降解性能研究显示,菌A5在复合污染体系中反应3d,SMZ去除率达37.3%,共存的Cu2+对SMZ降解具有促进作用.当投菌量为1g/L,溶液pH值为中性,菌A5对1mg/L SMZ的降解效果最佳.透射电镜分析表明,SMZ和Cu2+共存时,菌A5的细胞壁膜破损严重,导致细胞质外流.
磺胺甲嘧啶;铜;复合污染;;微生物降解
磺胺类抗生素和重金属铜常被用作饲料添加剂,用于畜禽疾病防治和促生长,但是大部分抗生素却不能被机体完全吸收,约超过85%会以药物原形或代谢物经排泄物进入环境[1-2],重金属也不能被降解[3-5],从而在畜禽养殖区及周边形成典型的抗生素/重金属复合污染[6].长期胁迫下,势必会诱导多重抗性微生物出现,进而破坏微生物生态系统多样性平衡,对生态环境造成更大危害.因此,开展环境中残留抗生素/重金属去除的研究至关重要.微生物是环境中污染物分解转化的主要参与者,关系到污染物在环境中的归趋.据报道,已有学者从环境中筛选到多种抗生素降解菌[7-11],主要包括有节杆菌属[7]、细杆菌属[8]、无色杆菌属[9]、不动杆菌属[10]、假单胞菌属[11]和红球菌属[12]等,大部分都属于细菌[13].研究显示,这些细菌可将SAs作为唯一碳源或共代谢基质进行分解,环境条件的改变,包括温度[14]、酸碱度[14]、盐度[15]、浊度[16]以及营养物质[17]等都会影响SAs的去除.Zhang等[18]研究发现,外加维生素和氨基酸可以促进降解磺胺甲噁唑(SMX),抗生素浓度影响其抑菌效果,因此SAs初始浓度越高,其降解率越低[19],但是也有相矛盾的研究报道[20-21].微生物和抗生素的类别也是影响降解的主要因素,例如红球菌可以共代谢降解磺胺甲噁唑(SMX)和磺胺甲噻二唑(SMT),但是却不能以单一SAs为碳源生长[12].另外一种红球菌,可以降解SMX,但是当有其它微生物共存时,却失去降解能力[22].由此可见,抗生素降解是一个复杂的过程,尽管已经取得一些研究进展,但是还很不足,而且关于抗生素/重金属复合污染条件下微生物降解的研究还鲜有报道.
鉴于此,本研究选取磺胺甲嘧啶(Sulfamethazine, SMZ)和铜(Cu2+)为研究对象,开展水体SMZ-Cu2+复合污染中SMZ微生物降解特性研究,以期为微生物技术在环境抗生素/重金属复合污染治理中的应用提供参考.
1 材料与方法
1.1 材料
1.1.1 培养基 营养培养基(NB):蛋白胨10g, NaCl 5g,牛肉膏 3g,水1000mL, pH=7.2~7.4.LB培养基:NaCl 10g,酵母提取物5g,胰蛋白胨 10g,水 1000mL, pH=7.0~7.2.无机盐培养基(MSM):NaCl 0.5g,MgCl·6H2O 0.1g,KH2PO40.3g,K2HPO4·3H2O 0.3g,水1000mL, pH=7.0~7.2.上述培养基使用前均置于高压蒸汽灭菌锅,121℃,灭菌30min.固体培养基是在液体培养基中加入质量分数为1.5%~2.0%的琼脂粉,充分混合,灭菌后冷却凝固而制成.
1.1.2 实验试剂 SMZ储备液:称取一定量SMZ (Ehrenstorfer GmbH,德国)于棕色容量瓶中,用色谱纯甲醇溶解定容,配制成100mg/L的SMZ标准储备液,置于4℃冰箱,避光保存备用.Cu2+标液:称取一定量的Cu(NO3)2,用去离子水溶解定容,配制成Cu2+浓度为1000mg/L的溶液,用0.22μm微孔过滤器过滤后,置于4℃冰箱保存待用.磷酸盐缓冲液(PBS, pH=7):NaCl 8.5g,NaHPO4·2H2O 2.2g, NaH2PO4·2H2O 0.4g,水1000mL, 121℃,灭菌30min, 4℃冰箱保存待 用.
1.2 实验方法
1.2.1 SMZ耐受菌的筛选和分离 从珠三角某畜禽养殖场采集土样.称取1g土样,加入含10mg/L SMZ的营养培养基,置于恒温振荡培养箱中150r/ min,30℃避光培养3d后,取10mL培养液转接到含20mg/L SMZ的新鲜营养培养基中,相同条件下继续培养3d.然后同样操作进行转接,每次接种新培养体系中SMZ的浓度增加10mg/L.当接种4次后,即SMZ浓度增至50mg/L时,连续培养7d后,取培养液涂布在固体营养培养基平板上,于30℃恒温培养箱,倒置避光培养1~2d.挑取单一菌落在新平板上划线分离培养,进一步纯化.最后,选取纯化的单菌落进行扩大培养,分别考察其对SMZ的降解效果.
1.2.2 菌体扩大培养和菌悬液的制备 刮取一环目标菌株接种到LB液体培养基中,置于振荡培养箱,25℃,150r/min恒温培养24~36h.取活化至对数期的菌培养液离心(6000r/min,25℃,6min),收集菌体,用无菌水洗涤2次(6000r/min,离心5min).最后用无菌水重悬,配成0.02g/mL的菌悬液待用.
1.2.3 菌A5生长曲线的测定 将活化的目标菌株接种到LB液体培养基中(接种量1%),于25℃, 150r/min恒温振荡培养.总共设置3个不同培养体系,分别为(1)纯营养培养;(2)含20mg/L SMZ;(3)含有20mg/L SMZ和20mg/L Cu2+,分别于0.5,1,2,3,4,6, 8,10,12,24,36,48,72,96,120,144,168,192,216,240h取样,用分光光度计测定培养液在600nm的吸光值(OD600),绘制菌A5的生长曲线.
1.2.4 复合污染中SMZ的微生物降解性能 在含有SMZ和Cu2+(10mg/L)的MSM体系中接种菌A5,以SMZ为唯一碳源,分别考察时间,投菌量,溶液pH值以及污染物初始浓度对菌A5降解SMZ的影响,设计条件如下:
(1)时间:设置单一SMZ和SMZ-Cu2+复合污染降解体系,分别于0.5,1,2,3,5,7,9d取样,分析SMZ残余浓度;
(2)投菌量:于复合污染降解体系,分别设置投菌量为0.5,1,1.5,2g/L;
(3)溶液pH值:于复合污染降解体系,分别调节溶液初始pH值为1~3(酸性),5~6(弱酸),7(中性),9~10(弱碱)和12~14(碱性)的复合污染降解体系;
(4)SMZ初始浓度:于复合污染降解体系,分别设置SMZ初始浓度为0.5,1,3,5mg/L;
除特殊说明,所有反应体系溶液pH值为中性,SMZ浓度为1mg/L,Cu2+浓度为10mg/L,投菌量为1g/L,反应条件为150r/min,25℃,作用48h.以不加菌体系作为空白对照,每组试样做3个平行样.
1.2.5 溶液中SMZ的分析 将样品离心(6000r/ min,8min,25℃),取0.5mL上清液置于1.5mL离心管中,加入等体积的萃取液(0.1%甲酸:乙腈:甲醇=10:3: 1,//),旋涡振荡至完全混合,之后10000r/min离心5min,上清液用0.22μm微孔过滤器过滤到棕色进样瓶,置于4℃保存,待测.
溶液中SMZ用高效液相色谱仪(HPLC, LC- 20A,Shimadzu Japan)进行分析.分析条件: C18反相柱(4.6×250mm,5μm,Thermo Fisher Scientific),柱温30℃,流动相为含0.1%甲酸的高纯水:乙腈=30%: 70%(/),流速为1.000mL/min,进样量为20μL,紫外检测波长为270nm.
1.2.6 菌A5细胞微观结构检测 设置4组实验条件:①不含污染物的MSM,作为空白对照;②含3mg/L SMZ的MSM;③含10mg/L Cu2+的MSM; ④含3mg/L SMZ和10mg/L Cu2+的MSM.所有培养体系接种菌A5,于25 ℃,150r/min恒温振荡培养72h,收集菌体,依次进行固定,脱水,包埋处理,然后将其超薄切片染色后,用透射电镜(TEM,TECNAI G212,FEI Holland)对菌A5的细胞微观结构进行观察.
2 结果与讨论
2.1 SMZ降解菌的筛选与鉴定
经过多次富集培养和筛选,从采集的畜禽养殖场土样中分离得到4株对SMZ具有较好耐受性的菌株,分别命名为A4,A5,A13和A14.对这4株耐受菌降解SMZ的能力进行考察,结果如图1所示.其中菌A5表现出较好的降解能力,反应3d,其对SMZ的去除率最高,达38.2%,而菌A4的降解效果最不理想,在第3d时其对SMZ的降解率只有17.2%.另外,菌A13和A14的降解能力相近,作用3d对SMZ的去除率在25%~28%之间.因此选取降解效果较好的菌A5作为进一步研究的目标菌株,并委托广东省微生物所对其进行鉴定.经过DNA提取,PCR扩增,26S rDNA序列测序及序列对比,鉴定菌A5与酵母菌同源性最高,达99.02%.

图1 耐受菌降解SMZ能力对比
2.2 菌A5的生长特性
分别在营养体系(对照),单一SMZ和SMZ-Cu2+复合污染体系中,考察菌A5的生长特性.如图2所示,纯营养培养时,菌A5经过12h的生长延迟期,之后开始快速生长,进入对数生长期,直到第36h,菌A5生长和死亡速率处于平衡,进入较长的生长稳定期,最后,随着体系中营养物质的消耗,菌体死亡速率超过生长速率,在第168h之后,菌A5逐渐进入衰亡期.此外,从图上可以看出,在单一SMZ和SMZ-Cu2+复合污染的培养体系中,菌A5仍正常生长.但是当培养液中含有单一SMZ时,到达稳定期,菌A5生物量(即OD600)明显较少,而同时含有SMZ和Cu2+的培养体系,菌A5的生物量却跟对照组基本一致.这说明SMZ对菌A5的生长是有一定抑制作用,但当有Cu2+共存时,两者产生交叉抗性,Cu2+增强了菌A5对SMZ的抗性,进而影响SMZ的抑菌效果[23-24].

图2 不同培养体系中菌A5的生长曲线
该实验结果表明,虽然SMZ和Cu2+存在对菌A5生长影响不显著,但是延迟了菌体进入对数期的时间,从12h延缓至24h.这说明菌A5对体系中存在的污染物具有生长适应期,需要通过延迟期对自身代谢调整来重新适应和响应外环境不利条件的胁迫.除此,研究还发现,在含有SMZ和Cu2+的培养体系中,菌A5直到第250h仍没有进入衰亡期,而是一直保持稳定的持续生长.这是因为一旦菌A5适应了新环境,并且在生长过程中受着污染物的持续驯化,到生长后期,即使体系中营养物质消耗殆尽,但是被驯化的菌A5仍可以利用污染物SMZ作为碳源和能源物质来维持生长[25],因此,跟无添加污染物的培养体系相比,其衰亡期推迟. Chen等[26]在研究苯并[a]芘(BaP)的微生物降解时也发现,在BaP存在的培养体系中,可以二次生长,同样推迟进入衰亡期.另一方面,Cu2+作为多种细胞酶激活剂,可以诱导菌A5分泌和激活更多细胞酶,促使体系中有害物质的代谢分解,从而提高菌体适应性[27-28].由于对数生长期的菌体生命力旺盛,代谢活跃,因此在之后的实验中,选取培养12~24h的菌A5开展一系列SMZ降解性能研究.
2.3 SMZ降解随时间变化
分别考察菌A5在单一和复合污染体系中对SMZ降解随时间的变化,结果如图3所示.随时间推移,菌A5对SMZ的降解率逐渐增大,但是由于污染物不同,SMZ降解率增长的情况也不一样.当体系中只含有SMZ时,菌A5在前3d对SMZ的去除率只有10%左右,之后随时间快速增长,到第5d基本稳定,保持在37.0%.而在SMZ-Cu2+复合污染体系中,菌A5对SMZ的去除率从第12h开始就随时间持续上升,到第3d达到最大值,为37.3%,之后基本保持稳定.
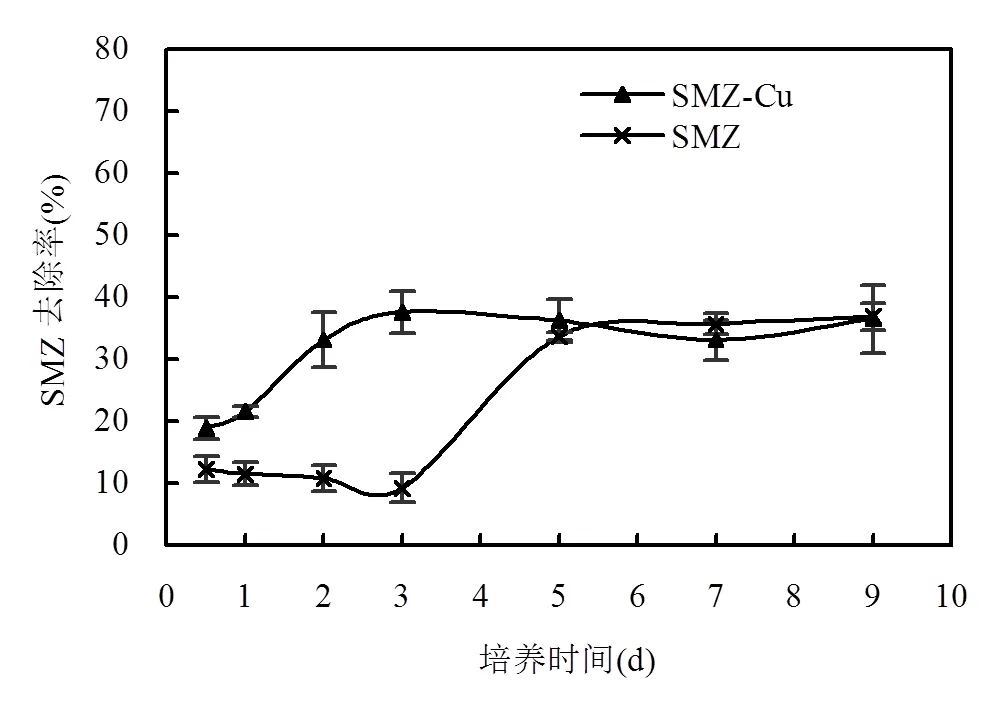
图3 SMZ去除率随时间变化
从结果显示,菌A5降解SMZ经历了迟缓期,再到快速降解,之后趋于稳定,可见菌体在反应初始对外源污染物需要一个适应过程,在这阶段SMZ去除率较低.之后,在SMZ不断诱导应激下,而且体系速效碳源和氮源的缺乏,致使菌A5分泌细胞酶将SMZ作为碳源和氮源分解利用,因此SMZ去除率快速增长,但是随着时间延长,菌体代谢物不断积累,此时菌A5会优先利用更容易分解的代谢物以及SMZ分解产生的小分子物质作为能源,所以SMZ的去除被停滞.大部分金属离子是微生物生长代谢的重要辅助因子,是多种酶的重要激活剂,可协助催化细胞代谢中的氧化等反应.佟瑶等[29]就研究证实,部分金属离子在适当浓度范围内可以作为酶激活剂促进三苯基锡的酶促降解.因此,当体系同时含有Cu2+时,菌A5对SMZ的降解几乎不需经历迟缓期,那是因为铜离子作为多种细胞酶激酶,可以有效激活菌A5各种细胞降解酶,进而将SMZ快速分解利用.
2.4 投菌量对SMZ降解的影响
改变投菌量,考察复合污染情况下,不同生物量对菌A5降解SMZ的影响,结果如图4所示.当投菌量为1g/L时,菌A5对SMZ的降解效果最佳,作用48h, SMZ的去除率可达33.3%,而当投菌量分别为0.5,1.5,2g/L时,菌A5对SMZ的去除率差别不显著,在15.7%~17.1%之间.
从结果显示,投菌量并非越大越好.当投菌量由0.5g/L增加到1.0g/L时,菌A5对SMZ的去除率显著增大,但当投菌量继续增加(>1.0g/L)时,菌A5对SMZ的降解效果反而下降.这是因为SMZ具有一定的抑菌毒性,当生物量较小时,单位质量菌体承受的毒害作用大,菌体的生长受到抑制,进而影响其对SMZ的降解.而如果投菌量持续增大,虽然菌体抵抗SMZ胁迫的能力增强,可以正常生长,但是由于MSM体系中SMZ是唯一的碳源和氮源,随着生物量增大,有限的营养物质势必会成为菌体生长的制约因素,随着一些菌体的死亡,其细胞分解并作为存活下来菌A5利用的能源物质,因此抑制了菌A5对SMZ的分解利用.通过本实验证实,当投菌量为1g/L时,菌A5对SMZ的降解效果最好,所以在后续实验中设定投菌量为1g/L.

图4 投菌量对SMZ降解的影响
2.5 溶液pH值对SMZ降解的影响
环境pH值是微生物活性的敏感因子,微生物的生命活动和物质代谢都与环境pH值密切相关[30-31].同时,环境pH值的改变也会影响某些污染物的化学形态和性质[32].本实验通过改变溶液的初始pH值,研究不同酸碱度对菌A5降解SMZ的影响,结果如图5所示.菌A5对溶液pH值的变化表现出较好的适应性,均能在一定程度去除SMZ,但是不同酸碱度对菌A5降解SMZ的影响还是较显著,中性条件(pH =7)下更有利于菌A5对SMZ的去除,作用48h去除率达39.9%.
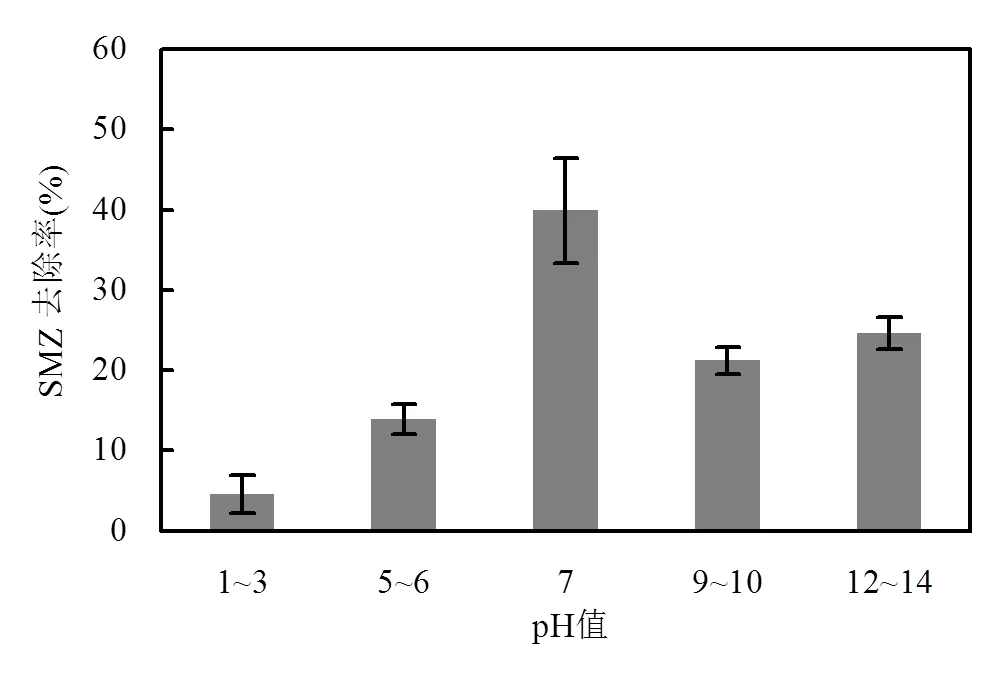
图5 不同溶液pH值对SMZ去除的影响
溶液pH值对SMZ降解的影响主要表现在两方面:一是影响SMZ的水解途径;二是影响微生物生长代谢以及相关酶的合成及活性[26].磺胺类抗生素在中性条件下水解较慢,活性较低[33],但结果显示中性条件SMZ的去除率最佳,可见此时溶液中SMZ以微生物去除为主.从图5还可以看出,碱性条件下,菌A5对SMZ仍有较好去除效果,这是因为菌A5生长过程中会分泌大量的有机酸代谢产物,调节了溶液的pH值,使反应体系趋向中性或弱碱性,从而有利于菌A5对SMZ的去除.而当溶液过酸时(pH£3),会导致H+浓度超过酶的适应范围,引起细胞膜电荷变化,进而影响菌的代谢活性.张珈瑜等[34]研究J2对磺胺二甲基嘧啶降解特性时发现,初始pH=6.0~8.0时,较适宜磺胺二甲基嘧啶的微生物降解,这与本研究结果相似.另外,也有研究表明,溶液酸碱度不同会影响SMZ的化学形态.当溶液为酸性或碱性时,SMZ主要以阳离子或阴离子形态存在,只有当溶液为中性时,SMZ则以非解离状态存在,而不同形态的SMZ会影响其与微生物之间的相互作用[35-36].
2.6 初始浓度对SMZ微生物降解的影响
图6显示的是 SMZ 初始浓度分别为0.5,1.0, 3.0,5.0mg/L 时,菌A5作用48h, 复合污染中SMZ的去除情况.结果表明,菌A5对不同浓度的SMZ均有一定的降解效果.当SMZ的初始浓度为1mg/L时,菌A5对SMZ去除率最好,达38.2%.而随着SMZ浓度的增加,菌A5对其去除率呈下降趋势,这是因为SMZ浓度越大,其对微生物的抑菌毒性越强,不利于微生物生长,抑制菌体的代谢活性[19].另一方面,如果SMZ浓度过低,菌体与SMZ接触的量以及SMZ的传质会受到限制,这在一定程度会阻碍SMZ的微生物降解.

图6 菌A5对不同浓度SMZ的降解
2.7 SMZ/Cu2+胁迫下菌A5细胞微观结构变化
分别收集单一SMZ,单一Cu2+,以及SMZ-Cu2+复合污染处理了3d的菌A5细胞,并以营养培养的菌体为对照,利用TEM观察在不同污染物胁迫下,菌A5细胞微观结构的变化.
从图7(A)可以看出,对照组的菌A5生长状态良好,细胞呈椭圆形,菌体内充盈原生质体,液泡和核区清晰可见,甚至观察到细胞出芽生殖.图7(B)是单一SMZ处理的菌A5细胞,可见少数细胞仍可进行出芽生殖,但有的细胞结构受到破坏,细胞内陷甚至破裂.相比SMZ的影响,单一Cu2+处理的菌A5细胞形态正常(见图7(C)),保持较好的椭圆形,但细胞边缘有一圈明显的白色亮部,可推测在Cu2+影响下,菌A5细胞发生质壁分离;而且在细胞壁表面黏附了很多细微颗粒物,可能是溶液中Cu2+被吸附到细胞表面.图7(D)显示的是SMZ-Cu2+复合污染处理的菌A5,可见细胞破损严重,细胞形状扭曲变形,部分细胞原生质大量流失.由此可见,抗生素SMZ对菌体细胞的影响较明显,尤其是复合污染.但是即使菌体细胞发生变形破损,仍可以对SMZ进行降解,这是因为细胞中发挥作用的降解酶仍没有全部流失,从而保证了细胞的代谢活性;也有可能虽然胞内酶随着细胞破裂流出,但是仍能保持活性,对溶液中的SMZ发挥降解作用.

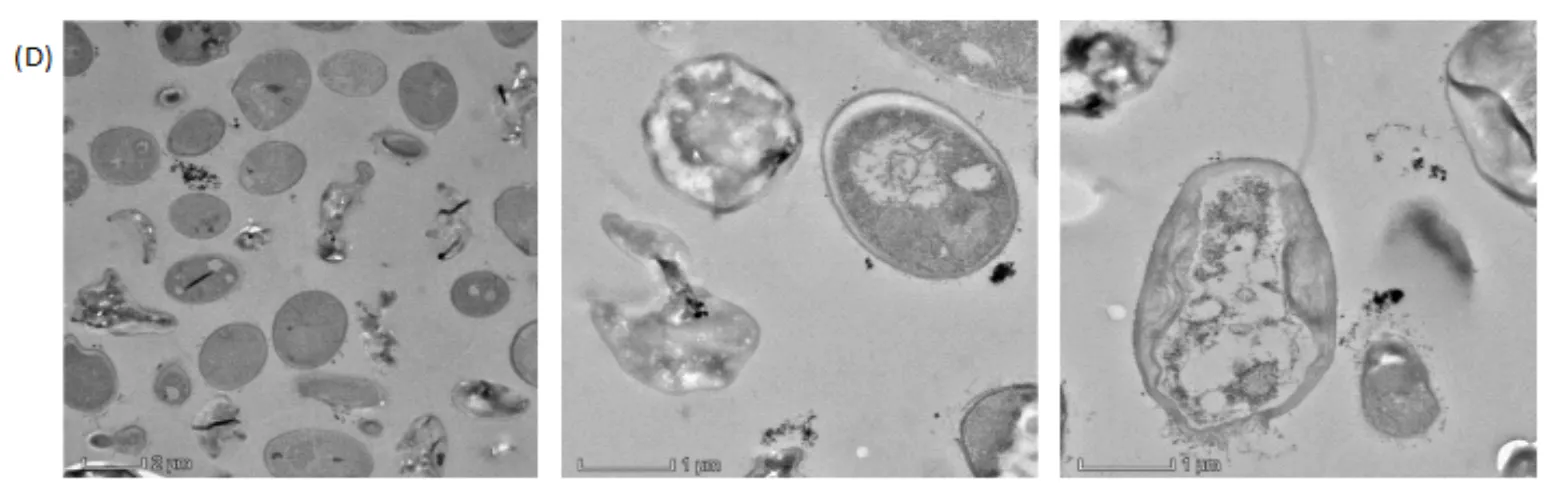
图7 不同处理条件下的菌A5细胞TEM图
(A)对照组;(B)单一SMZ处理;(C)单一Cu2+处理;(D) SMZ-Cu2+复合污染处理
3 结论
3.1 从某畜禽养殖场土壤筛选分离到1株SMZ降解菌,经鉴定为酵母菌,命名为A5.污染物SMZ和SMZ-Cu2+复合污染的存在,菌A5仍能保持正常生长,但是其对数生长期延迟,同时也推迟进入衰亡期.
3.2 SMZ-Cu2+复合污染中,菌A5作用3d,对SMZ的去除率达37.3%,Cu2+的存在可以促进菌A5对SMZ的降解.投菌量,溶液pH值,SMZ初始浓度均会对菌A5降解SMZ产生影响.当投菌量为1g/L, pH值为中性,SMZ初始浓度为1mg/L时,菌A5对SMZ降解效果最佳.
3.3 TEM分析表明,相比Cu2+,SMZ对菌体细胞的影响更显著,尤其在SMZ-Cu2+复合污染胁迫下,菌A5细胞破损严重,细胞形状扭曲变形,部分细胞质流失.
[1] Liu J L, Wong M H. Pharmaceuticals and personal care products (PPCPs): A review on environmental contamination in China [J]. Environment International, 2013,59:208-224.
[2] Radke M, Lauwigi C, Heinkele G, et al. Fate of the antibiotic sulfamethoxazole and its two major human metabolites in a water sediment test [J]. Environmental Science & Technology, 2009,43(9): 3135-3141.
[3] 张家泉,田 倩,许大毛,等.大冶湖表层水和沉积物中重金属污染特征与风险评价 [J]. 环境科学, 2017,38(6):2355-2363. Zhang J Q, Tian Q, Xu D M, et al. Pollution characteristics and risk assessment of heavy metals in water and sediment from daye lake [J].Environmental Science, 2017,38(6):2355-2363.
[4] 张博文,赵甲亭,吴二威,等.滏阳河河流水体中重金属污染特征及其对青海弧菌和斜生栅藻的毒性效应 [J].生态毒理学报,2018,13(1): 179-189.Zhang B W, Zhao J T, Wu E W, et al. Water pollution characteristics of heavy metals in Fuyang River system and their toxicity tosp. Q67and[J]. Asian Journal of Ecotoxicology, 2018,13(1):179-189.
[5] Chen C Q, Zheng L, Zhou J L, et al. Persistence and risk of antibiotic residues and antibiotic resistance genes in major mariculture sites in Southeast China [J]. Science of Total Environment, 2017,580:1175– 1184.
[6] Hu Y A, Cheng H F, Tao S. Environmental and human health challenges of industrial livestock and poultry farming in China and their mitigation [J]. Environment International, 2017,107:111-130.
[7] Deng Y, Mao Y P, Li B, et al. Aerobic degradation of sulfadiazine byspp.: kinetics, pathways, and genomic characterization [J]. Environmental Science & Technology, 2016,50(17):9566-9575.
[8] Topp E, Chapman R, Devers-Lamrani M, et al. Accelerated biodegradation of veterinary antibiotics in agricultural soil following long-term exposure, and isolation of a sulfamethazine-degradingsp. [J]. Journal of Environmental Quality, 2013,42(1): 173-178.
[9] Reis P J M, Reis A C, Ricken B, et al. Biodegradation of sulfamethoxazole and other sulfonamides byPR1 [J]. Journal of Hazardous Materials, 2014,280: 741-749.
[10] Yang C W, Hsiao W C, Chang B V. Biodegradation of sulfonamide antibiotics in sludge [J]. Chemosphere, 2016,150:559-565.
[11] Jiang B C, Li A, Cui D, et al. Biodegradation and metabolic pathway of sulfamethoxazole byHA-4, a newly isolated cold-adapted sulfamethoxazole-degrading bacterium [J]. Applied Microbiology and Biotechnology, 2014,98(10):4671-4681.
[12] Gauthier H, Yargeau V, Cooper D G. Biodegradation of pharmaceuticals byandby co-metabolism [J]. Science of the Total Environment, 2010,408: 1701-1706.
[13] Chen J F, Xie S G. Overview of sulfonamide biodegradation and the relevant pathways and microorganisms [J]. Science of the Total Environment, 2018,640-641:1465-1477.
[14] Zheng T, Cai L, Xu B T, et al. Sulfadiazine biodegradation by: Mechanism and degradation product identification [J]. Chemosphere, 2019,237:124418.
[15] Yang C C, Huang C L, Cheng T C, et al. Inhibitory effect of salinity on the photocatalytic degradation of three sulfonamide antibiotics [J]. International Biodeterioration & Biodegradation, 2015,102:116-125.
[16] Nguyen P Y, Carvalho G, Reis A C, et al. Impact of biogenic substrates on sulfamethoxazole biodegradation kinetics bystrain PR1 [J]. Biodegradation, 2017,28:205-217.
[17] Liang D H, Hu Y Y. Simultaneous sulfamethoxazole biodegradation and nitrogen conversion bysp. JL9 using with different carbon and nitrogen sources [J]. Bioresource Technology, 2019,293:122061.
[18] Zhang Y B, Zhou J, Xu Q M, et al. Exogenous cofactors for the improvement of bioremoval and biotransformation of sulfamethoxazole by[J]. Science of the Total Environment, 2016,565:547-556.
[19] Mao F, Liu X H, Wu K, et al. Biodegradation of sulfonamides byMR-1 andsp. strain MR-4 [J]. Biodegradation, 2018,29:129-140.
[20] Lin B, Lyu J L, Lyu X J, et al. Characterization of cefalexin degradation capabilities of twostrains isolated from activated sludge [J]. Journal of Hazardous Materials, 2015,282:158- 164.
[21] Selvi A, Salam J A, Das N. Biodegradation of cefdinir by a novel yeast strain,sp. SMN03isolated from pharmaceutical wastewater [J]. World Journal of Microbiology and Biotechnology, 2014,30: 2839-2850.
[22] Larcher S, Yargeau V. Biodegradation of sulfamethoxazole by individual and mixed bacteria [J]. Applied Microbiology and Biotechnology, 2011,91:211-218.
[23] 刘爱菊,刘 敏,李梦红,等.Cu,抗生素协同污染对土壤微生物活性的影响 [J]. 生态环境学报, 2013,22(11):1825-1829. Liu A J, Liu M, Li M H, et al. Collaborative effects of Cu and antibiotic on soil microbial activities [J]. Ecology and Environmental Sciences, 2013,22(11):1825-1829.
[24] 傅海霞,刘 怡,董志英,等.抗生素与重金属复合污染的生态毒理效应研究进展[J]. 环境工程, 2016,34(4):60-63+104. Fu H X, Liu Y, Dong Z Y, et al.Progress in research on ecological toxicity of combined pollution of antibiotics and heavy metals [J]. Environmental Engineering, 2016,34(4):60-63+104.
[25] Ni B J, Zeng R J, Fang F,et al. Fractionating soluble microbial products in the activated sludge process [J]. Water Research, 2010, 44(7):2292-2302.
[26] Chen S N, Yin H, Ye J S, et al. Effect of copper(II) on biodegradation of benzo[a]pyrene by[J]. Chemosphere, 2013,90(6):1811-1820.
[27] 王 瑞,魏源送.畜禽粪便中残留四环素类抗生素和重金属的污染特征及其控制[J]. 农业环境科学学报, 2013,32(9):1705-1719. Wang R, Wei Y S. Pollution and control of tetracyclines and heavy metals residues in animal manure [J]. Journal of Agro-Environment Science, 2013,32(9):1705-1719.
[28] Steffen K T, Hatakka A, Hofrichter M. Degradation of benzo[a]pyrene by the litter-decomposing basidiomycete: role of manganese peroxidase [J]. Applied and Environmental Microbiology, 2003,69(7):3957-3964.
[29] 佟 瑶,叶锦韶,尹 华,等.金属离子对三苯基锡酶促降解的影响[J]. 环境科学, 2011,32(3):779-783. Tong Y, Ye J S, Yin H, et al.Effect of heavy metal ions on triphenyltin enzymatic degradation [J]. Environmental Science, 2011, 32(3):779-783.
[30] 郑 蕾,田 禹,孙德智.pH值对活性污泥胞外聚合物分子结构和表面特征影响研究[J]. 环境科学, 2007,28(7):1507-1511. Zheng L, Tian Y, Sun D Z. Effects of pH on the surface characteristics and molecular structure of extracellular polymeric substances from activated sludge [J]. Environmental Science, 2007,28(7):1507-1511.
[31] 刘春光,金相灿,孙 凌,等.pH值对淡水藻类生长和种类变化的影响[J]. 农业环境科学学报, 2005,24(2):294-298. Liu C G, Jin X C, Sun L, et al. Effects of pH on growth and species changes of algae in freshwater [J]. Journal of Agro-Environment Science, 2005,24(2):294-298.
[32] 廖 敏,黄昌勇,谢正苗.pH值对镉在土水系统中的迁移和形态的影响[J]. 环境科学学报, 1999,19(1):83-88. Liao M, Huang C Y, Xie Z M. Effect of pH on transport and transformation of cadmium in soil-water system [J]. Acta Scientiae Circumstantiae, 1999,19(1):83-88.
[33] 王 冉,刘铁铮,王 恬.抗生素在环境中的转归及其生态毒性[J]. 生态学报, 2006,26(1):265-270. Wang Y, Liu T Z, Wang T.The fate of antibiotics in environment and its ecotoxicology: A review [J]. Acta Ecologica Sinica, 2006,26(1): 265-270.
[34] 张珈瑜,彭星星,贾晓珊.磺胺二甲基嘧啶(SM2)高效降解菌J2的分离筛选及降解特性研究[J].环境科学学报, 2019,39(9):2919-2927. Zhang J Y, Peng X X, Jia X S. Isolation and characterization of high efficiency sulfamethazine-degrading bacterium strain J2 [J]. Acta Scientiae Circumstantiae, 2019,39(9):2919-2927.
[35] Gao J, Pedersen J A. Adsorption of sulfonamide antimicrobial agents to clay minerals [J]. Environmental Science and Technology, 2005, 39(24):9509-9516.
[36] Pan L J, Tang X D, Li C X, et al. Biodegradation of sulfamethazine by an isolated thermophile-sp. S-07 [J]. World Journal of Microbiology & Biotechnology, 2017,33(5):85.
Biodegradation of Sulfamethazine in Sulfamethazine/Copper combined pollution by.
ZENG Jie-yi1, ZENG Su-hang1, JI Meng-tian1, TAN Xiao2, HAN Wei-jiang1,2, CHEN Shuo-na1*
(1.College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China;2.South China Institute of Environmental Science, Ministry of Ecology and Environment, Guangzhou 510655, China)., 2019,39(12):5293~5300
To understand the characteristics of sulfamethazine (SMZ) biodegradation in the polluted environment where SMZ and Cu2+co-existed, this study focused on the bio-treatment of SMZ-Cu2+in different conditions by(named A5), a strain resistant to sulfamethazine, which was screened and isolated from the soil of a livestock and poultry farm (Guangzhou, China). The results showed that, with the presence of single SMZ or SMZ-Cu2+combined pollution in the culture medium, strain A5 still maintained a good growth trend.was an effective strain to remove SMZ from pollution system. The presence of Cu2+was beneficial for A5 to decompose SMZ. The degradation rates of SMZ reached 37.3% in 3d. Under the condition of 1g/L of inoculum, 1mg/L initial concentration of SMZ, and neutral pH, the removal effect of strain A5 on SMZ was the best. The transmission electron microscope (TEM) analysis showed that the cells of strain A5 were severely damaged when SMZ and Cu2+co-existed in solution, leading to the outflow of cytoplasm.
sulfamethazine;copper ions;combined pollution;;biodegradation
X172
A
1000-6923(2019)12-5293-08
曾洁仪(1997-),女,广东茂名人,华南农业大学本科生,主要从事环境污染微生物修复研究.发表论文2篇.
2019-05-10
广东省自然科学基金项目(2017A030313062,2018A030310203);广州市科学计划项目(201804010208)
* 责任作者, 讲师,chenshuona@scau.edu.cn
