呕吐毒素降解菌的筛选、鉴定及应用
2019-12-26马召稳于思颖
梁 含,马召稳,于思颖,李 旺
(河南科技大学动物科技学院,河南洛阳 471023)
呕吐毒素学名为脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),是镰刀菌属的一种次级代谢产物,特别是禾谷镰刀菌。DON 广泛存在于大麦、小麦、玉米及燕麦等饲料原料和成品饲料中,DON 污染饲料是引起动物饲料中毒的重要原因[1-2]。我国的饲料原料及饲料成品中DON 污染特别严重,农业部饲料质量监督检验测试中心在全国对饲料原料及配合饲料的检测发现,2008—2014 年DON 的检出率高达90% 左右,平均超标率为30%左右[3]。DON 可与核糖体60S 亚基的肽转酶活性中心结合,触发核糖体应激反应,抑制DNA、RNA 和蛋白合成,诱导细胞凋亡,破坏肠道、免疫系统,并且具有遗传毒性,对动物健康产生严重影响,DON 是饲料中检出率和超标率最高的一种真菌毒素[4]。有研究表明,猪对饲料中的DON 非常敏感,0.1~0.2 mg/kg 的剂量就会导致拒食和呕吐,当摄入0.5 mg/kg DON 后,5~7 min 就会引起呕吐拒食、生长能力下降及对传染病的抵抗力下降[5]。中国《饲料卫生标准》规定 DON 在猪配合饲料、犊牛配合饲料和泌乳期动物配合饲料中最高限量为≤1 mg/kg[6]。
DON 化学性质很稳定,具有很强的热抵抗力,在加工、储存及高温高压下很难对其毒性造成破坏。目前对DON 的降解方法主要有物理脱毒法、化学脱毒法和生物转化法。物理脱毒主要采用霉菌毒素吸附法,包括黏土、硅铝酸盐、硅藻土、酯化甘露聚糖、葡甘露聚糖等。但霉菌毒素吸附剂对DON 的吸附效率太低,不足5%[7]。化学反应法是利用DON 在强碱、强酸等作用下会转化成无毒物质,但强碱、强酸和强氧化剂不仅会大大破坏饲料的口感和营养,也会带来饲料的二次污染。与物理、化学脱毒方法相比,生物转化法不会引入其他化学试剂的污染也不会造成原料营养的丢失[8]。由于生物转化法具有高效、环保、针对性强等优点,成为未来用于霉菌毒素脱毒的一种有效途径。研究报道,已从多种样品中(如土壤、受污染玉米、牛瘤胃液、鸡肠道内容物等)筛选到对DON 具有降解能力的菌株[9],并对单菌的降解能力进行了研究。本试验拟以多种培养基、不同的培养方式从不同类型的样本中筛选对DON 降解能力高的新菌株,研究其降解DON 的能力,并根据微生物的协同作用将不同菌种组合应用到饲料原料的脱毒处理中,得到能有效降解DON 的天然饲料菌种组合,为饲料中DON 的去除提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验样品 土壤、淤泥和发霉秸秆样品采自河南科技大学;鸡肠道内容物、鲫鱼肠道内容物、牛瘤胃液、猪粪和牛粪等样品采自河南周边养殖场;自制发霉玉米和530 实验室提供的发霉苜蓿样品,共10 份。
1.1.2 主要试剂 DON 标准品购于天津一方科技有限公司,纯度≥95.0%;向10 mg DON 标准品中加入10 mL灭菌水,放于4℃下保存、备用。DON 的ELISA 常规慢速检测试剂盒购自北京华安麦科生物技术有限公司;聚合酶链式反应(PCR)所需试剂购于TaKaRa 公司;细菌基因组抽提试剂盒购于北京天根生化科技有限公司。
1.1.3 主要仪器 酶标仪(Multiskan FC)、Bio-metro PCR 仪;高压蒸汽灭菌锅、恒温培养箱、超净工作台、电泳槽、离心机、凝胶成像系统、显微镜、恒温摇床等。
1.1.4 主要培养基 LB 固体培养基:酵母提取物 5 g,胰蛋白胨 10 g,NaCl 10 g,琼脂 15 g,加入 1 L 的无菌蒸馏水中,121℃高压灭菌20 min。使用前加DON标准品使其终浓度为2 μg/mL。LB 液体培养基:除无琼脂外,成分同LB 固体培养基。使用前加DON 标准品使其终浓度为1 μg/mL。
NA 固体培养基:10 g 蛋白胨,5 g NaCl,3 g 牛肉粉,琼脂15 g,溶解于 1 000 mL 无菌蒸馏水中,121℃下灭菌20 min。使用前加DON 标准品使其终浓度为2 μg/mL。NA液体培养基:除无琼脂外,成分同NA 固体培养基。使用前加DON 标准品使其终浓度为1 μg/mL。
MRS 固体培养基:葡萄糖20 g,蛋白胨10 g,酵母提取物5 g,牛肉膏10 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,吐 温1 g,K2HPO42 g,柠 檬 酸三胺2 g,乙酸钠5 g,琼脂15 g,蒸馏水定容至1 L,121℃高压灭菌20 min。使用前加DON 标准品使其终浓度为2 μg/mL。MRS 液体培养基:除无琼脂外,成分同MRS 固体培养基。使用前加DON 标准品使其终浓度为1 μg/mL。
1.1.5 引物 上海生工生物工程有限公司合成试验中菌株16S rDNA 片段的扩增所需要的通用引物。上游引物:5´-AGAGTTTGATCCTGGCTCAC-3´,下游引物:5´-AAGGAGGTG ATCCAG CC-3´。
1.2 试验方法
1.2.1 样品的处理 所采样品各取1 g,每个样品中加入10 mL 无菌水,充分震荡得悬浮液,备用。
1.2.2 DON 降解菌株的初筛 取上述混悬液100 μL 分别涂布于含有DON 的3 种改良固体培养基中,好氧、厌氧2 种方式培养,置37℃恒温培养箱中培养24 h,挑取在培养基上生长的形态不同的单菌落进行纯培养。
1.2.3 DON 降解菌株的纯化 将初筛得到的形态不同的单菌落划线于新的与其相对应的改良固体培养基平板上,如此反复划线3~4 次以纯化菌株。
1.2.4 DON 降解菌株的复筛 将上述经过纯化的菌株接种到含1 μg/mL DON 的改良液体培养基中,好氧菌在37℃、180 r/min 下培养直至菌液浑浊,厌氧菌静置于37℃恒温箱中。设置空白对照。用ELISA 测空白对照和菌液中DON 含量,对初筛菌种进行复筛,并保存降解能力强的DON 降解菌。
1.2.5 DON 降解菌的鉴定 形态学观察:将通过复筛得到的菌株划线接种于无机盐固体培养基平板上,在37℃下培养24 h,观察菌落形态、色泽和菌体特征。挑取新鲜的单菌落进行革兰氏染色,显微镜下观察菌体生理形态。
16S rDNA 序列分析鉴定:以25 μL 体系进行PCR扩增。由上海生工生物工程有限公司进行DNA 扩增的序列测定。将测序结果在GenBank 中进行BLAST 比对,对每个菌种选取15 个同源性在98%以上不同命名的菌株,下载这些菌株的16S rDNA 序列,用Mega 软件构建系统演化树,比较菌种之间的亲缘关系,确定其种属。
PCR 反应程序:预变性94℃ 2 min;变性94℃30 s,复性56℃ 30 s,延伸72℃ 1 min 30 s,35 个循环;终延伸72℃ 10 min,4℃保存。
PCR 反应体系25 μL:上、下游引物(10 μmol/L)各1 μL,10×Ex TaqBuffer 2.5 μL,dNTP 2 μL,模板(基因组DNA)1 μL,ExTaq 酶 0.5 μL,ddH2O 17 μL。
1.2.6 DON 降解菌的应用 选择LB01(枯草芽孢杆菌)、NA06(解淀粉芽孢杆菌)和MRS16(植物乳杆菌)作为发酵菌种,分别培养至6×109、2×109、3.5×109CFU/mL。通过菌种组合试验设计接种于无机盐液体培养基中,经过一系列单因素发酵试验,确定发酵参数:发酵温度37℃,10 mL 菌液或组合菌液(即单菌种10 mL、双菌种组合各5 mL、三菌种组合各3.3 mL 以此类推)、40 mL无菌水加入到100 g 天然饲料麸皮中,每个处理设置3个重复,以不加发酵液处理的为空白对照。分别于发酵48、72、96 h 时取样,参照罗俊聪等[10]用ELISA 试剂盒检测发酵麸皮中 DON 毒素含量,重复测定3 次取平均值。
1.2.7 DON 的测定及降解率 不同发酵处理的麸皮样品分别在48、72、96 h 取样,用ELISA 方法测定其DON 含量,DON 降解率=(空白组DON 含量-样本组DON 含量)/空白组DON 含量×100%
2 结果
2.1 菌株的筛选 用3 种含有DON 的改良固体培养基以好氧和厌氧2 种方式共筛选到单菌落80 株。将这些菌株分离纯化后接种含有DON 的改良液体培养基中,好氧菌在37℃、180 r/min 下培养直至菌液浑浊,厌氧菌静置于37℃恒温箱中培养,至底层菌体出现沉淀。用ELISA 测空白对照和菌液中DON 含量,得到16 株对DON 有降解能力的菌株,如表2 所示。根据培养基的不同进行编号,来自LB 培养基的编号为LB01、LB02、LB03、LB04;来自NA 培养基的编号为NA05、NA06、NA07、NA08、NA09;来 自MRS培养基的编号为MRS10、MRS11、MRS12、MRS13、MRS14、MRS15、MRS16。根据降解率的高低和培养基、培养方式的不同选择LB01、NA06 和MRS13 号菌株进行后续鉴定和应用。

表1 不同菌株对DON 的降解率
2.2 菌株的形态学特征 如图1 所示,所筛菌株中LB01号菌株菌落形态呈乳白色,不透明,表面干燥没有光泽,中间褶皱边缘不整齐;NA06 号菌株菌落呈白色不透明,有隆起,不透明,干燥,表面粗糙,菌落边缘不规则;MRS13 号菌株菌落呈乳白色半透明,菌落凸起边缘整齐,表面湿润且光滑,直径在0.4~2.0 mm。

图1 菌株的菌落形态
如图2 所示,LB01 号菌株染色结果为阳性,在显微镜下观察菌体呈长杆状,两端钝圆,以成对或链状排列,孢囊无明显膨胀,无伴孢晶体。NA06 号菌株为革兰氏阳性菌,长杆状,有芽孢,有荚膜。MRS13 号菌株为革兰氏阳性菌,在显微镜下观察菌体呈短杆状,且其菌体的排列方式有单个和链状排列,无芽孢。

图2 革兰氏染色图片
2.3 分子生物学鉴定 使用细菌基因组DNA 提取试剂盒从新鲜菌液中提取细菌基因组DNA,以菌株LB01、NA06、MRS13 的基因组DNA 为模板进行16S rDNA保守序列扩增。由图3 可知,在1 000~2 000 bp 扩增到1 条特异性条带,与细菌16S rDNA 大小相符。将扩增产物进行序列测定。序列测定结果进行BLAST(https://www.ncbi.nlm.nih.gov/)比对。LB01 号与枯草芽孢杆菌菌株MSC46(KM222187.1)同源性最高达到99%。NA06 号菌株与解淀粉芽孢杆菌菌株EnBalf13(KP792638.1)同源性最高达到99%。MRS13 号菌株与植物乳杆菌菌株Sourdough-H04(MG754699.1)同源性最高达到99%。
图3 菌株的 16S rDNA 片段 PCR 扩增结果
2.4 基于16S rDNA 序列的系统遗传发育树分析 由图4 可知,LB01 号菌株与KM222187.1(枯草芽孢杆菌)亲缘关系最近,结合其菌落特征、菌体特征和DNA 同源性比对结果,将LB01 号菌株确认为枯草芽孢杆菌。NA06 号菌株与KP792638.1(解淀粉芽孢杆菌)亲缘关系最近,结合其菌落特征、菌体特征和DNA 同源性比对结果,将NA06 号菌株确认为解淀粉芽孢杆菌。MRS13 号菌株与MG754699.1(植物乳杆菌)亲缘关系最近,结合其菌落特征、菌体特征和DNA 同源性比对结果,将MRS13 号菌株确认为植物乳杆菌。
2.5 菌株对麸皮中DON 毒素的降解 空白对照组DON含量为701.1 μg/kg。各样品降解率结果如表2 所示,LB01 和MRS13 的组合对物料中DON 降解效果最好,在发酵48 h 时降解率最高达到71%。说明枯草芽孢杆菌和植物乳杆菌在对DON 降解时具有一定的协同作用。

图4 菌株的亲缘关系
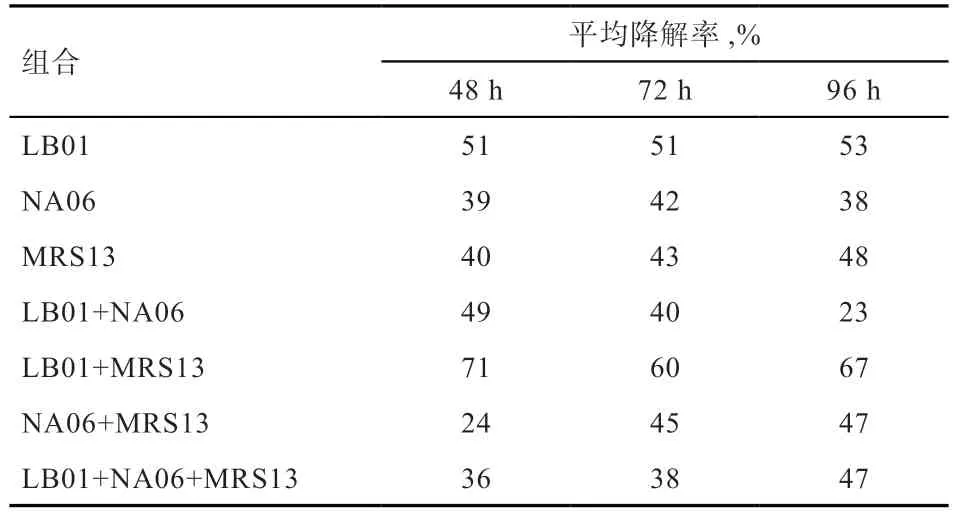
表2 组合菌种发酵对麸皮中DON 的降解
3 讨 论
由于DON 给养殖业带来的危害巨大,物理、化学处理方法又各有缺点,故生物处理DON 成为研究的热点。研究发现,许多微生物如酵母菌、细菌、真菌等可以将DON 转化为其他无毒或低毒物质,达到去除或减少饲料中的霉菌毒素的目的[11]。谭剑等[12]从受污染的玉米中筛选到1 株能降解DON 菌株,经鉴定为枯草芽孢杆菌。李晓凤等[13]从土壤中筛选得到1 株能降解DON 的菌株,经鉴定为发酵型肠杆菌。本试验从土壤、淤泥、发霉玉米、肠道内容物等样品中筛选出16 株能够降解DON 的菌株,其中从土壤样品中筛选到2 株、淤泥样品中3 株、鸡肠道内容物2 株、自制发霉玉米5株、牛粪2 株、猪粪和发霉秸秆分别为1 株,经鉴定降解DON 的微生物菌种主要为枯草芽孢杆菌、解淀粉芽孢杆菌和植物乳杆菌,与上述文献相符。
这些菌种对DON 的降解会随着菌种不同和DON浓度、来源等出现较大变化。程亮等[14]筛选得到了1株假单胞杆菌,在 30℃与含有100 μg/mL 的 DON 无机盐培养基摇瓶培养14 d 后,降解率可达56.61%。徐剑宏等[11]分离出1 株德沃斯氏菌DDS-1,将其应用到DON 浓度为25 μg/kg 的饲料中,菌株对DON 的降解率达到75.47%。微生物菌种可以通过自身代谢过程所产生的一系列物质最终将DON 转化成对人和动物无害的物质。Garda-Buffon 等[15]研究报道,真菌类和乳酸菌类菌株对DON 主要是具有吸附作用。目前发现的微生物对DON 生物降解主要包括2 大类:肠道或瘤胃厌氧菌将DON 转化为去环氧化合物DOM-1;好氧菌将DON 氧化成3-酮-DON,同时生成3-epi DON[16]。由此可以推测,本试验对DON 降解最高的组合即枯草芽孢杆菌和植物乳杆菌组合,对DON 的降解机理既有生物转化作用,又有吸附作用。
本试验以麸皮中的DON 作为降解对象,其含量和存在方式较标准液有很大区别。试验所筛菌种在初筛和复筛时均是对DON 标准品的降解,但是在对麸皮中的天然DON 进行降解时差异很大。通过菌种的组合可提高DON 的降解率,说明枯草芽孢杆菌、解淀粉芽孢杆菌和植物乳杆菌等菌种具有降解天然DON 的能力,不同菌种在对天然DON 降解时有协同作用。
4 结 论
本试验中,初筛和复筛得到具有降解能力的菌株16 株,降解率最高达66.7%;选择其中3 株,经形态学和分子生物学鉴定,确定为枯草芽孢杆菌、解淀粉芽孢杆菌和植物乳杆菌;对其进行不同组合发酵麸皮,枯草芽孢杆菌和植物乳杆菌的组合对发酵麸皮中DON 的降解最高,在48 h 达71%。
