兴义鸭MEF2C 基因启动子区序列克隆与分析
2019-12-26杨华婷李兴才赵忠海师新彩
杨华婷,李 辉,李兴才,赵忠海,师新彩
(贵州大学动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025)
肌细胞增强因子2(Myocyte Enhancer Factor 2,MEF2)属于转录调节因子MADS-Box 家族,是一种特定的转录因子。在脊椎动物中,MEF2基因家族由4 个基因组成,包括MEF2A、MEF2B、MEF2C和MEF2D,它们在肌肉生成、神经系统发育和分化、肝纤维化方面均有重要作用[1-2]。MEF2 是广泛存在于肌肉细胞的DNA 结合活性因子,可与大多数肌肉发育相关基因的启动子或增强子结合,激活其活性,对肌肉发生具有重要作用[3]。Brand[4]研究发现,MEF2 能和肌肉肌酸酶(Muscle Creatine Kinase,MCK)基因启动子中A/T DNA 序列特异性结合,增强MCK 的转录活性。MEF2 作为一种重要的转录调节因子,其特定的结构可使它与其他转录因子相互作用。温见燕等[5]研究发现,MEF2C 可以通过作用于DOK5 启动子区的MEF2 结合位点,调节DOK5 的转录活性;王炜[6]报道,MEF2C 与IPO13 启动子上E-BOX 元件结合之后,促进了IPO13 的表达。临床上MEF2C 已成为治疗人类先天性心脏病[7]、胶质母细胞瘤[8]以及心血管发育异常[9-10]等疾病的靶向基因。畜禽中相关研究报道,MEF2C基因中新发现的多态性(RFLP/Bsr I)可能成为牛胴体和肉质性状的潜在遗传标记[11],MEF2C基因多态位点可以作为黄牛生长早期辅助标记选择的分子标记[12]。程波[13]确定了MEF2C基因与山羊臂三头肌肌纤维直径和密度分别呈极显著负相关和显著正相关。这些研究主要集中在MEF2C基因多态性、表达差异及关联性分析等方面。
近年来,对特定基因的启动子研究层出不穷,但关于MEF2基因家族的启动子研究报道较少,且关于鸭MEF2C基因的研究报道鲜见。因此,本实验以兴义鸭作为研究对象,直接测序结合DNAStar 筛选启动子区SNPs 位点;生物信息学在线软件预测该序列转录因子结合位点和核心启动子区,分析其SNPs 位点对转录因子结合位点的影响,并对SNPs 位点与屠宰性状进行关联性分析,以期为MEF2C基因功能的深入研究提供理论依据。
1 材料与方法
1.1 实验材料 随机选取来自贵州省兴义市落火坪村52只55 日龄的饲养环境一致、健康的兴义鸭作为实验材料。根据《家禽生产性能名词术语和度量统计方法》(NY/T 823-2004)进行屠宰测定,其余样品由冰盒带回实验室,根据组织基因组DNA 提取试剂盒[天根生化科技(北京)有限公司]说明书步骤分别提取52 只兴义鸭组织DNA,利用1%琼脂糖凝胶电泳检测DNA 效果,利用紫外分光光度计检测DNA 浓度,-20℃保存备用。DNA 提取试剂盒、DL2000 Marker、Goldview Ⅰ型核酸染料等主要试剂购自天根生化科技(北京)。
1.2 引物设计及PCR 扩增 根据GenBank 上已公布的鸭MEF2C基因序列(登录号:NW_004677103.1),利用Primer3.0 设计1 对特异性引物扩增MEF2C基因启动子区域。上游引物:5'-TGACACATTCTGCGTTACGG-3',下游引物:5'-AGCCTCCTTCTTCAGCACTT-3',扩增片段长度为1 780 bp,退火温度62℃。以DNA 样品为模板进行PCR 扩增。PCR 扩增为30 μL 体系:2×Taq PCR Master Mix(With Dye)15 μL,上、下游引物各2 μL、基 因 组DNA(100 ng/μL)2 μL、ddH2O 9 μL。PCR 反应程序:95℃预变性5 min;94℃变性45 s,62℃退火35 s,72℃延伸55 s,31 个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测PCR 产物,合格样送往英潍捷基(上海)贸易有限公司进行PCR 直接测序。
1.3 生物信息学分析
1.3.1 鸭MEF2C基因核心启动子预测 运用3 种生物信息学软件预测鸭MEF2C基因核心启动子区域,其在线软件分别为Promoter Scan:https://www-bimas.cit.nih.gov/molbio/proscan/;Neural Network Promoter Prediction:http://www.fruitfly.org/seq_tools/promoter.html;Promoter 2.0:http://www.cbs.dtu.dk/services/Promoter/。
1.3.2MEF2C基因启动子转录因子结合位点预测 运用生物信息学在线软件预测MEF2C基因启动子区转录因子结合位点以及可能结合的转录因子,3 种在线软件分别是Alibaba2.1:http://gene-regulation.com/pub/programs/alibaba2/index.html;JASPAR:http://jaspar.binf.ku.dk/Tfsitescan:http://www.ifti.org/。
1.4 SNPs 筛选及关联性分析 扩增好的PCR 产物送往英潍捷基(上海)贸易有限公司进行双向测序,利用DNASTAR 软件等对测序结果进行拼接比对,筛选SNPs 位点。运用SPSS 18.0 软件进行基因多态性与屠宰性状的关联分析。
2 结果与分析
2.1 基因PCR 扩增结果 1% 琼脂糖凝胶电泳检测MEF2C基因启动子片段,经凝胶成像系统观察可知,PCR 产物扩增条带特异性良好,明亮清晰、单一无杂带,且与预期目的片段大小相符(图1),可用于下一步分析。
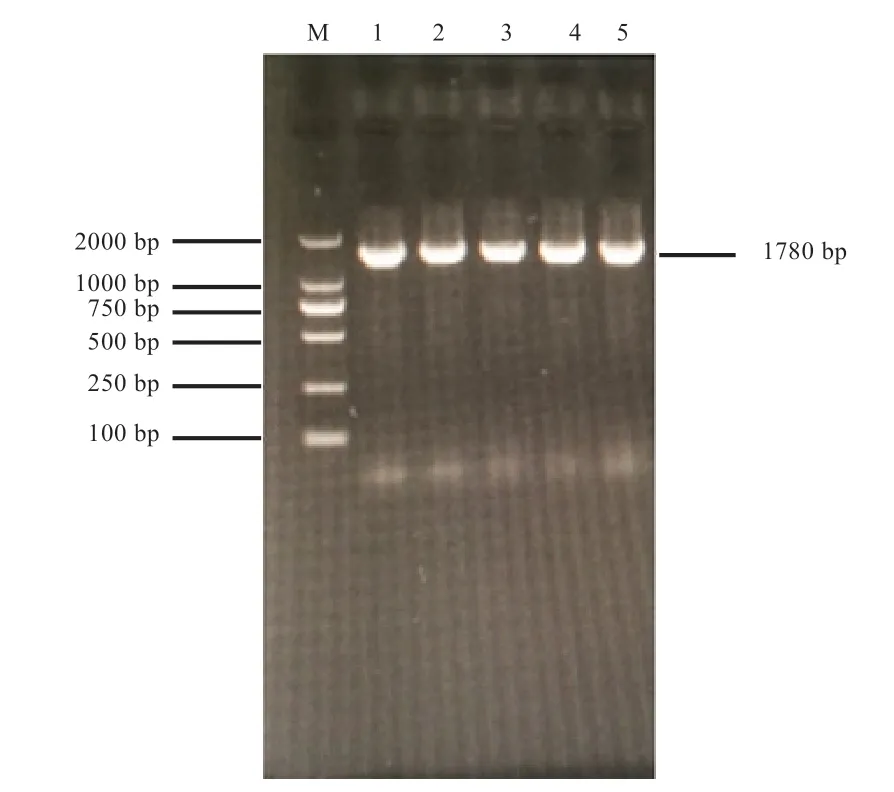
图1 兴义鸭MEF2C 基因启动子区PCR 结果
2.2 序列分析 Megalign、SeqMan 程序BLAST 分析发现,兴义鸭MEF2C基因启动子区存在8 个SNPs 位点,分别为T-190A、A-232G、A-285G、A-617T、G-1420A、A-1437C、T-1504G、A-1524G(图2)。
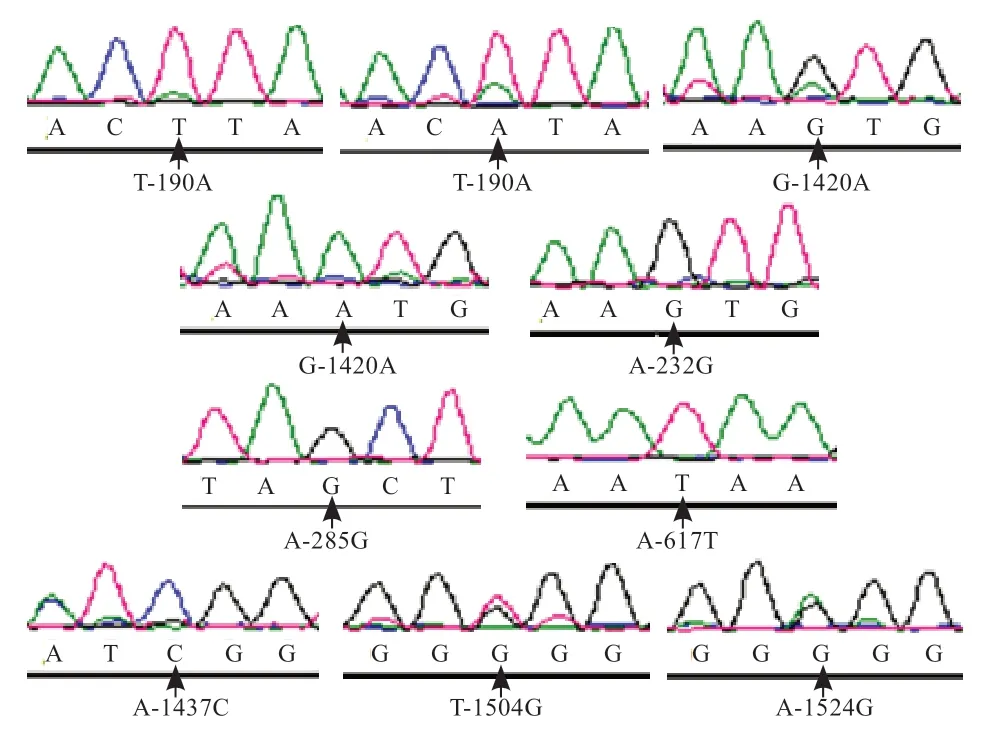
图2 8 个SNPs 位点测序峰图
2.3MEF2C基因核心启动子预测结果 生物信息学软件预测MEF2C基因核心启动子区域,结果表明,MEF2C基因启动子具备显著的核心启动子识别特征。各在线软件预测核心启动子区域结果见表1。3 种在线软件均预测得到MEF2C基因核心启动子区,Promoter 2.0 软件在-800 bp 处预测出1 个极大可能性的核心启动子区域;Neural Network Promoter Prediction 软件在-1 229~-1 279 bp 范围内也预测出了1 个高评分的核心启动子区域。大部分SNPs 位于核心启动子区域内,由此推测这些突变位点可能影响着MEF2C基因的表达调控。
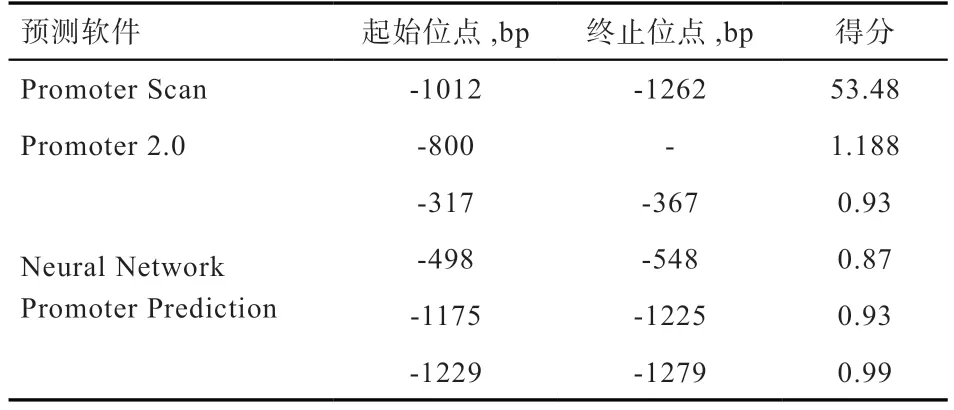
表1 核心启动子区分析结果
2.4MEF2C基因SNPs 突变对转录因子结合位点的影响不同在线软件分析预测发现,MEF2C基因启动子区突变位点造成重要的转录因子结合位点发生明显变化(表2)。通过Alibaba2.1 在线软件预测得到MEF2C基因启动子区碱基突变前后转录因子的变化结果(表3),-190处发生T>A 突变,可能导致原来的HOXA4、GCN4 2个转录因子消失而重新生成了新的转录因子Oct-1 的结合位点;-232 位点(A>G)可能引起原有的Pit-1a 转录因子消失;在-1420 位点(G>A),突变可能使原来的IRF-1 转录因子改变成了ICSBP。因此,这些SNP位点导致一部分原有的转录因子结合位点的消失和新转录因子结合位点的生成,很有可能对MEF2C基因表达产生重要影响。
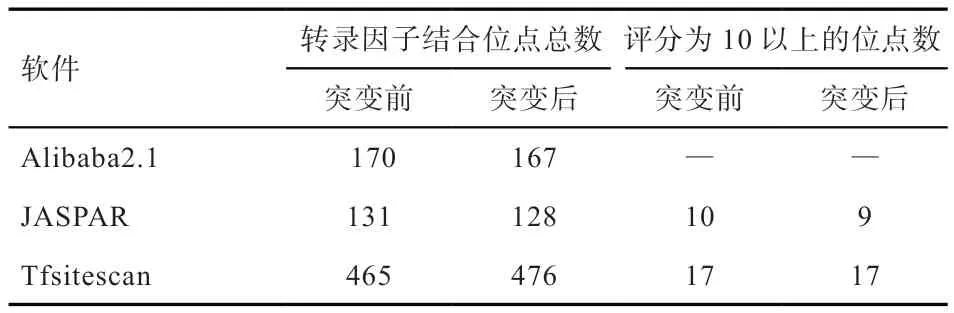
表2 不同软件对MEF2C 基因启动子转录因子结合位点的预测结果
2.5MEF2C基因启动子SNPs 与屠宰性状的关联性分析结合Chromas、SeqMan 2 种软件分析发现,有6 个多态位点仅检测出1 种基因型,分别是A-232G(GG)、A-285G(GG)、A-617T(TT)、A-1437C(CC)、T-1504G(TG)、A-1524G(AG),该6 个突变位点不具备基因多态性,所以不列入分析讨论。而另外的T-190A、G-1420A 位点在本实验群体中存在TT、TA(GA、AA)2 种基因型,2 个多态位点的基因型频率、等位基因频率、杂合度、有效等位基因数及多态信息含量见表4。T 等位基因为T-190A 位点优势等位基因,该等位基因频率高达0.817 3;同时经χ2适合性检验得到2 个多态位点符合Hardy-Weinberg 平衡(P>0.05)。T 检验分析T-190A、G-1420A2 个位点与屠宰性状的相关性,结果见表5。T-190A 位点对活重的影响达到显著水平(P<0.05),对屠体重(P=0.096)、半净膛(P=0.095)、半净膛率(P=0.076)3 个屠宰指标的影响接近显著水平,而对其他屠宰性状无显著影响。G-1420A 位点对腿肌率的影响达到显著水平(P<0.05)。
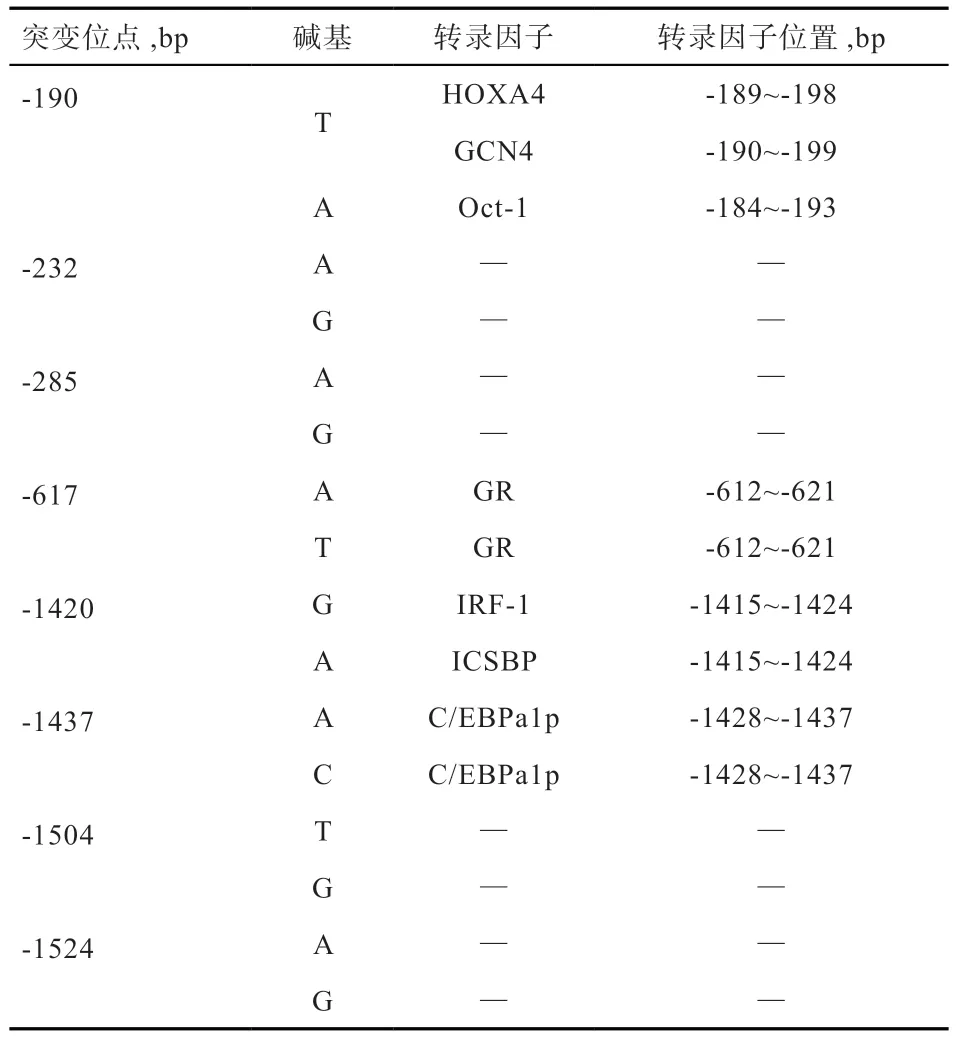
表3 MEF2C 基因启动子区SNP 突变前后转录因子变化结果
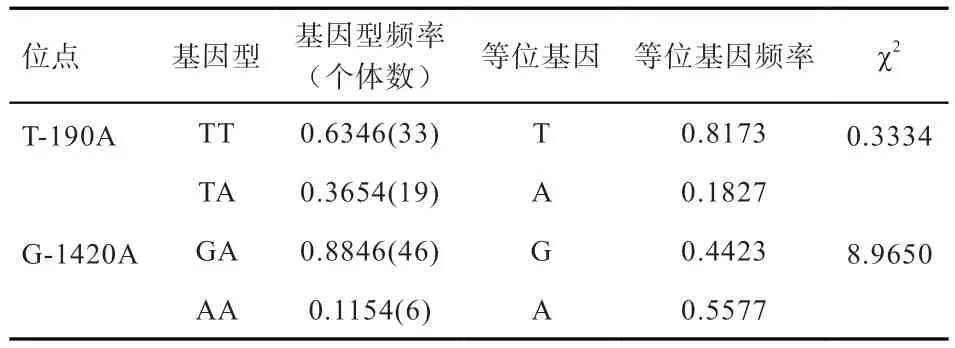
表4 MEF2C 基因启动子多态位点的遗传特性
3 讨 论
MEF2C基因属于MEF2基因家族成员,广泛存在许多细胞和组织中,对细胞分化、肌肉发育具有重要的调控作用。启动子是位于基因中转录起始位点上游的特定DNA 片段,是基因中不可缺少的部分,在基因的表达过程中,转录起始阶段最为关键,这一阶段主要发生RNA 聚合酶与启动子的相互作用,启动子结构改变会影响其与RNA 聚合酶的亲和力、启动子序列的变异,直接影响基因的表达水平。王帅[14]报道,MEF2C基因启动子的低频突变可作为预防和治疗心肌梗死的新靶点;邱进等[15]研究发现,MEF2C基因启动区SNPs位点大大提高其转录活性而使得人类先心病发病率上升;Materna 等[9]研究发现,MEF2C 对血管发育的需求仅次于心脏的需求,小鼠在敲除MEF2C基因之后出现心功能不全而导致血管重构失败;Jin 等[16]研究表明,生肌决定因子MyoD 参与MEF2C基因的转录调控,突变或缺失都会影响其转录活性。目前,关于畜禽类MEF2C基因启动子相关报道较少。本实验在兴义鸭MEF2C基因启动子区鉴定得到8 个SNPs,对兴义鸭屠宰性状均产生影响。不同软件预测核心启动子区结果有差异。本研究综合多个软件分析,大大提高了预测结果的准确性。本实验得到的突变位点处于核心启动子区域,其突变可能在调控MEF2C基因表达中发挥重要作用,T-190A 可能消除了HOXA4 和GCN4 转录因子的结合位点,新产生Oct-1 转录因子。HOXA4 转录因子是HOX基因家族成员之一,对细胞分化、增殖及信号传导等产生重要影响[17],GCN4 转录因子具有特异性识别DNA 序列的功能,从而影响许多基因的转录[18],新生的Oct-1 既具有转录抑制作用,又具有激活作用,Oct-1 本身直接与启动子结合,又可以结合其他转录因子作用在启动子上来调控基因的表达[19]。T-190A、G-1420A 对附近的转录因子结合位点影响显著,说明2个SNPs 位点可直接影响转录因子与调控序列的结合。

表5 T-190A、G-1420A 与兴义鸭屠宰性状的关联分析
本研究发现,T-190A 突变位点对转录因子结合位点影响较大,TT 基因型频率远远大于TA 基因型频率,T 为该突变位点的优势等位基因。关联性分析发现,得到T-190A 与活重有显著关联,而与屠体重、半净膛、半净膛率的关联性接近显著,G-1420A 与腿肌率的关联性达到显著水平,与其他性状未达到显著水平,可能是实验群体样本数少,需增加样本数进行更深入的研究。T-190A、G-1420A 突变可能是重要的功能性SNPs 位点,MEF2C基因SNPs 研究结果为进一步分析MEF2C基因启动子功能提供理论基础。
4 结 论
兴义鸭MEF2C启动子序列测定共检测到8 个SNPs,生物信息学预测得到MEF2C基因核心启动子区域,其中部分SNPs 位点可能导致转录因子以及转录因子结合位点的改变,从而导致基因表达的改变。T-190A 和T-1420A2 个突变位点可能是重要的功能性突变位点,对MEF2C基因表达的影响需要加大样本量来作进一步研究。本研究对MEF2C基因启动子区SNP 的结果为进一步分析MEF2C基因启动子功能和阐明MEF2C基因表达调控奠定基础。
