BPI 基因在梅山猪初生断奶以及成年阶段的组织表达谱分析
2019-12-26魏宗友吴圣龙包文斌
靳 健,杨 荔,魏宗友,吴圣龙,包文斌*
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.江苏省太仓市畜牧兽医站,江苏太仓 215400)
杀菌/通透性增强蛋白(Bactericidal/Permeability-Increasing Protein,BPI)作为一种重要的抗菌蛋白[1],具备杀灭革兰阴性菌、中和内毒素以及免疫调节等重要生物学功能,尤其是其对细菌不易产生耐药性,具有替代抗生素的应用前景[2]。细菌性和病毒性腹泻是导致初生到断奶阶段仔猪死亡的重要接触性传染病,其中大肠杆菌是引起仔猪细菌性腹泻的主要病原菌之一[3]。虽然当前饲养管理水平的提高和疫苗的使用在一定程度上减少了仔猪细菌性腹泻的发生,但从遗传本质上提高仔猪抗腹泻能力,才是当代育种追求的目标。在临床中发现在断奶后仔猪细菌性腹泻的发病率呈现十分明显的下降趋势,特别是到了成年以后,该病的发病率几乎为零。目前已有研究表明,BPI基因表达水平可能对断奶仔猪抵抗大肠杆菌 F18 菌株起到重要的调控作用[4-5]。
本课题组前期通过分析苏太断奶仔猪抗大肠杆菌 F18菌株侵染抗性组和易感组之间小肠组织BPI基因的差异表达,推断BPI基因在肠道组织中的高度表达有利于断奶仔猪对大肠杆菌F18 菌株侵染的抵抗[6]。Zhu 等[7]研究发现,在35 日龄时,苏太猪空肠和十二指肠中BPI基因表达水平有显著差异。本研究以中国优良地方品种梅山猪为实验对象,通过实时荧光定量PCR 检测初生、断奶和成年(性成熟和体成熟)等4 个重要发育时期(1、35、134、158 日龄)的12 个组织中BPI基因的mRNA表达水平,比较分析BPI基因在各组织中的表达差异以及不同发育时期同一组织中BPI基因的表达规律,为进一步研究BPI基因的功能和调控机制提供理论依据。
1 材料与方法
1.1 实验动物 本实验所用梅山猪来自江苏省太仓市梅山猪国家级保种场,分别从5 个家系中筛选出毛色、体形和体重等外貌表型基本一致的健康全同胞个体,保持饲养条件一致且饲养管理良好。分别在初生、断奶、性成熟、体成熟4 个重要发育时期(即1、35、134、158日龄)从5 个不同家系中各随机宰杀1 头,即每个发育时期各5 头,取心脏、肝脏、脾脏、肺脏、肾脏、胃、肌肉、胸腺、淋巴结、十二指肠、空肠和回肠共12 个组织样品,现场随即液氮保存,带回实验室备用。
1.2 引物设计及合成 参照GenBank 数据库中BPI基因序列(登录号:NM_001159307),利用Primer Premier 5.0软件,遵照引物跨外显子的原则设计BPI基因qPCR 引物;分别以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)和β肌动蛋白(β-actin,ACTB)基因作为内参基因,引物合成交由生工生物工程(上海)公司完成。引物信息见表1。
1.3 总RNA 提取以及cDNA 合成 利用Trizol(诺唯赞生物科技有限公司,南京)法提取不同发育时期梅山猪各组织总RNA,提取步骤严格按照Trizol Reagent说明书操作,并以1% 甲醛变性琼脂糖凝胶电泳检测RNA 完整性,使用ND-1000 核酸/ 蛋白浓度测定仪测定浓度与纯度,产物-70℃保存备用。
使用反转录试剂盒(诺唯赞生物科技有限公司,南京)合成cDNA。反应体系10 μL:5×qRT SuperMix II 2 μL,总RNA 500 ng,RNase free ddH2O 补足至10 μL。反应程序为25℃ 10 min,50℃ 30 min,85℃ 5 min,4℃保存。
1.4 实时荧光定量PCR 分析 使用qPCR 试剂盒(诺唯赞生物科技有限公司,南京)进行反应。20 μL 反应体系:cDNA 2.0 µL,正、反向引物(10 μmol/L)各0.4 µL,(2×)AceQ qPCR SYBR Green Master Mix 10 µL,(50×)ROX Reference Dye II 0.4 µL,灭 菌 蒸 馏 水6.8 µL,每个样本设置3 个重复组进行检测。qPCR 反应程序:95℃预变性 5 min;(95℃ 10 s,60℃ 34 s)× 40 个循环反应。为了检测有无非特异性扩增产物产生,在扩增反应结束后采集多个信息点,进行熔解曲线分析。反应程序:95℃反应 15 s,60℃反应 1 min;95℃反应15 s。
1.5 统计分析 相对定量结果采用2-ΔΔCt 法进行分析处理[8],以1 日龄肌肉组织的平均△Ct 为参照。利用SPSS 17.0 软件对BPI基因在梅山猪不同组织中的表达差异进行比较均值(M)单因素(ANOVA)分析;对BPI在同一组织不同发育时期的表达差异采用一般线性模型(GLM)的Multivariate 统计方法分析。P<0.01表示差异极显著,P<0.05 代表差异显著。
2 结果与分析
2.1 总RNA 的纯度与完整性 对提取的组织总RNA 经1%甲醛变性琼脂糖凝胶电泳检测,结果呈现28 S、18 S、5 S 共3 条清晰明亮的条带(图1),A260nm/A280nm在1.8~1.9,可用于后续实验。
图1 组织总RNA 凝胶电泳结果
2.2 实时荧光定量PCR 的扩增曲线、熔解曲线 由图2可知,熔解曲线是单峰曲线,说明反应特异性好,无引物二聚体及非特异性扩增,可用于进一步分析。
2.3BPI基因在梅山猪不同组织中表达谱分析 由图3可知,4 个不同发育时期BPI基因在不同组织中均表现出相对一致的组织表达谱,即BPI基因在心脏、肝脏、脾脏、肌肉和胸腺中的表达普遍很低,而在肠道组织(十二指肠、空肠和回肠)中的表达从初生到成年一直都非常高。值得注意的是,在初生和35 日龄断奶时,BPI基因在胃中的表达水平很低,成年阶段在胃中高度表达。
2.4 不同发育阶段梅山猪胃肠道组织表达差异分析 由图4 可知,胃中BPI基因的相对表达量从初生到成年158 日龄逐渐增加,且158 日龄的表达水平极显著高于其他日龄,而初生和断奶阶段表达程度差异不明显。35日龄断奶时,小肠组织中BPI基因的mRNA 表达水平均极显著高于其他3 个日龄。在断奶后十二指肠、空肠和回肠的相对表达量逐步下降,134 日龄与158 日龄的表达水平均极显著低于35 日龄。
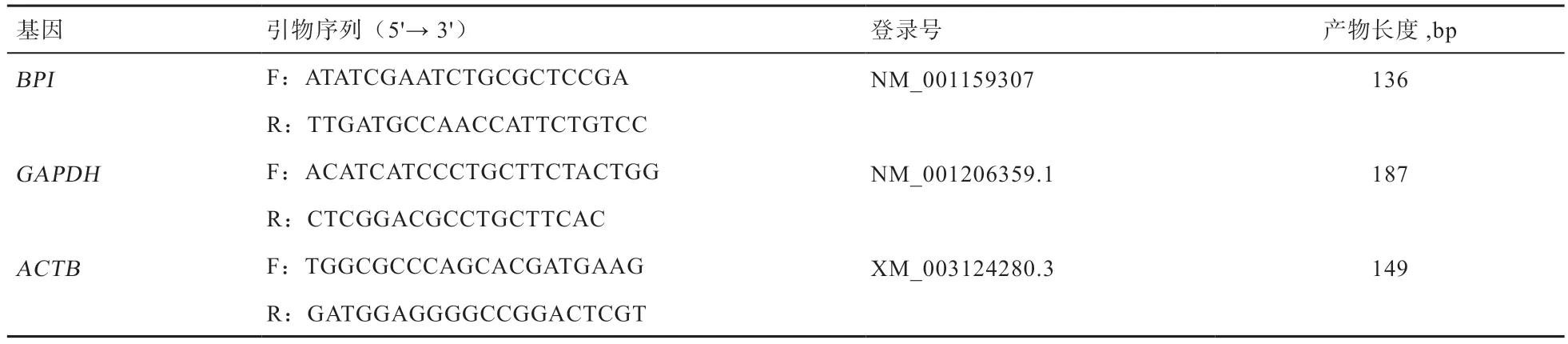
表1 实时荧光定量 PCR 引物

图2 不同基因qPCR 产物的熔解曲线和扩增曲线
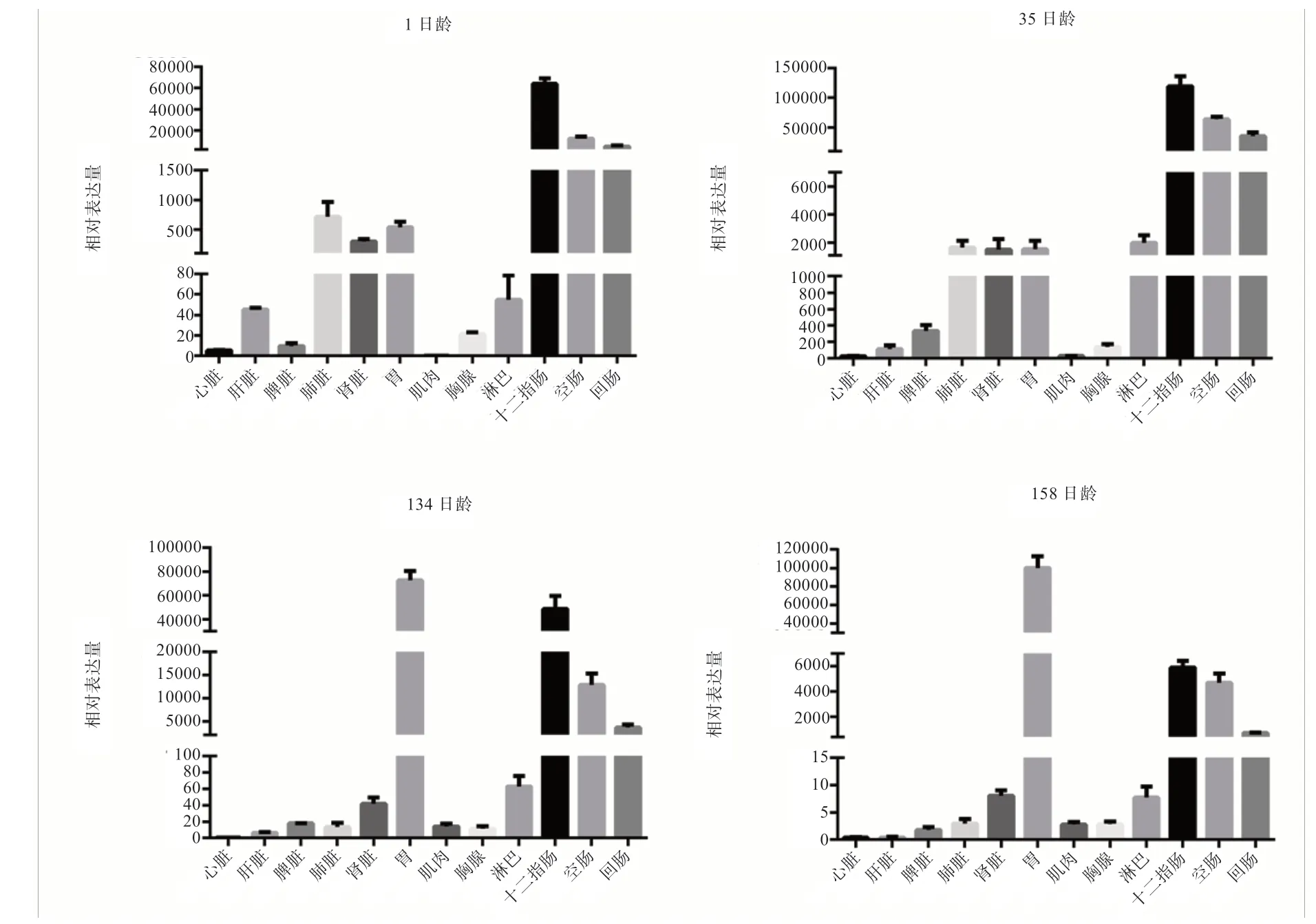
图3 不同日龄梅山猪各组织中BPI 基因的表达谱
3 讨 论
本研究结果表明,BPI基因在小肠组织中的表达量一直保持较高水平,而在心脏、肝脏、脾脏、肌肉和胸腺中表达水平一直很低或基本不表达,可见,在梅山猪中BPI基因的表达也具有十分明显的组织特异性,与本课题前期研究的苏太断奶仔猪BPI基因的组织表达谱结果一致[5]。肠道是大肠杆菌等革兰阴性细菌感染和定殖的主要部位,BPI基因在4 个不同发育时期梅山猪肠道组织中均具有很高的表达水平,提示BPI基因在肠道组织中发挥了重要的生物学功能,BPI基因对仔猪抵御肠道中大肠杆菌等革兰阴性细菌的侵染可能具有直接调控作用。断奶应激是造成仔猪腹泻的重要因素[9-10],在35日龄断奶时小肠和胃组织中BPI基因的表达均发生明显上调,提示仔猪可能通过提高消化系统中BPI基因的表达量来发挥体内细菌清除等功能。此外,不同组织中BPI基因的表达水平随着日龄的增加呈现不一致的变化规律。其中肌肉中BPI基因相对表达量在不同发育时期均没有显著差异,一直处于稳定且低水平表达。本实验中,尽管BPI基因在4 个不同发育时期心脏和肝脏中的表达水平有所差异,但总体表达水平均较低,该结果与本课题组前期在其他品种中的研究结果一致[7]。因此,可以确定在梅山猪整个生长发育的不同时期,心脏、肝脏和肌肉这些组织都不是BPI基因发挥生物学功能的主要场所。
BPI基因在猪胃肠道中高表达是由于大肠杆菌等革兰阴性菌入侵胃肠道之后发生还是先天性免疫以抵抗大肠杆菌,这种因果关系并不清晰。在没有无特定病原体(Specific Pathogen Free,SPF)猪作为实验材料的局限下,本实验在相对无菌环境下选取初生梅山猪(刚刚出生,仔猪尚未吃初乳),这种情况下仔猪受到外界大肠杆菌等革兰阴性菌的侵染微乎其微,但值得关注的是,在断奶和成年阶段肠道和胃中特异性高度表达的BPI基因,此时在肠道中依然高度表达,在胃中表达量却很低。消化器官胃组织中BPI基因的相对表达量在35 日龄断奶后随着日龄增加而急剧上升,且158 日龄时的表达水平极显著高于其他日龄。众所周知,仔猪在断奶期间自身的免疫系统尚未完全发育成熟,加之没有了母乳提供的被动免疫,此时,不成熟的肠道功能面临自身和被动免疫力之间的缺口、断奶期饲料中微生物的感染以及大量应激因子;此外,中性粒细胞是仔猪抵御感染的第一道防线,但是应激状态会缩短猪中性粒细胞的寿命[11]。上述诸多因素导致断奶仔猪容易受大肠杆菌等革兰阴性菌侵染,进而导致细菌性腹泻等疾病的发生。有研究表明,相对于外来品种,我国地方猪品种梅山猪具有很强的抗病力[12],结合本研究结果,推断梅山猪表现出具有较强的腹泻病抗性可能与BPI基因在其胃肠道中持续高度表达具有直接关系。BPI蛋白是中性粒细胞、嗜酸性粒细胞、外周血单核细胞产生的,并非肠道细胞分泌[13-14],因而推断梅山仔猪肠道中BPI基因的高度表达可能是来自于肠道细菌侵染部位的中性粒细胞等所分泌,从而使得仔猪具备较强的抗病能力。
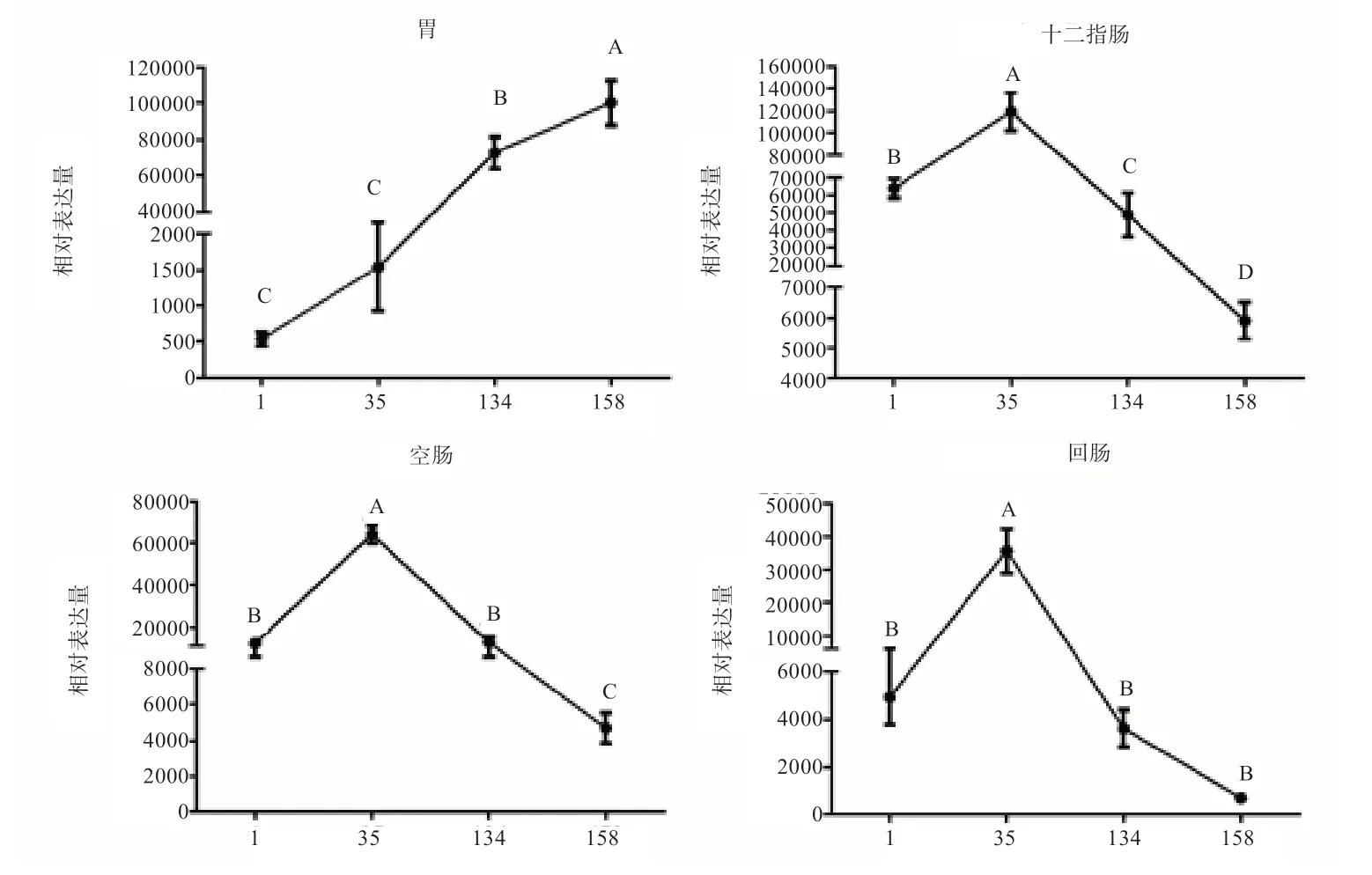
图4 不同日龄梅山猪胃肠道中BPI 基因的表达变化趋势
4 结 论
本研究揭示了BPI基因在中国地方猪品种梅山猪不同生长发育时期的组织表达规律,发现BPI基因在胃肠道组织中特异性高度表达,提示肠道和胃组织是BPI基因发挥生物学功能的主要场所,BPI基因在肠道介导的免疫反应过程中可能起到了重要的调控作用,肠道中BPI基因的高度表达是仔猪从初生就具有的抵抗大肠杆菌等病原感染的固有免疫的一部分,而在胃中的表达很可能是其后天为了抵御不断侵染的大肠杆菌等病原的结果。本研究结果为今后利用生物工程手段开展仔猪抵抗细菌性腹泻的分子育种提供了一定的理论依据和实验基础。
