HPLC-DAD法同时测定三种来源丹参饮片中水溶性和脂溶性成分
2019-12-25张敏敏赵志国刘伟崔莉王岱杰王晓赵恒强
张敏敏,赵志国,刘伟,崔莉,王岱杰,王晓,赵恒强
(齐鲁工业大学(山东省科学院)山东省分析测试中心 山东省中药质量控制技术重点实验室,山东 济南 250014)
丹参为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根和根茎[1],现代药理学研究表明,丹参具有抗血栓、抗炎、抗氧化、改善微循环等作用[2-4],临床上广泛用于心脑血管等疾病的治疗。丹参主要产地包括山东、河南、四川以及云南等地,其中,山东已成为当前全国最大的丹参产地和丹参制商品集散地[5]。四川为丹参的道地产区,是临床上公认的丹参质量最佳产区。不同来源丹参饮片质量存在参差不齐的情况,而有关这种差异情况缺乏系统的研究,严重制约着各地丹参的充分开发利用。
丹参的有效成分主要是脂溶性的丹参酮类和水溶性的丹酚酸类[6-8]。目前,2015版《中国药典》对于丹参的质控要求仅限于规定隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA三种丹参酮总含量和一种丹酚酸(丹酚酸B)的含量[1]。中药是多成分、多靶点的复杂体系,有限的指标难以全面反映中药的质量。而且,药典中丹参酮和丹酚酸的测定需采用不同的条件进行,测定方法较为复杂繁琐。近年来,已有学者发展了丹参酮和丹酚酸的HPLC同时测定方法[9-12],为本研究提供了技术参考。
本研究发展了超声辅助提取-HPLC-DAD同时测定丹参饮片中6种水溶性和脂溶性化学成分(咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA)的方法,并对不同来源的丹参饮片进行对比研究,研究结果将为丹参饮片的合理利用和质量评价研究提供数据支持。
2 材料与方法
2.1 实验仪器及材料
Thermo Scientific UltiMate 3000超高效液相色谱仪(美国Thermo Scientific公司),配有二元梯度泵、在线脱气机、自动进样器、柱温箱、DAD检测器;CPA225D型十万分之一电子分析天平(德国Sartorius公司);SB-5200D型高功率数控超声波仪(宁波新芝生物科技股份有限公司);FW100型高速万能粉碎机(天津市泰斯特仪器有限公司)。
对照品为咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA(上海源叶生物科技有限公司,纯度均大于98%);甲醇、乙腈(美国Tedia公司,色谱纯);乙醇(国药集团,分析纯);甲酸(美国ROE公司,色谱纯)。丹参样品购于济南市各药店及药材市场,经山东省分析测试中心王晓研究员鉴定为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根和根茎。具体样品信息见表1。
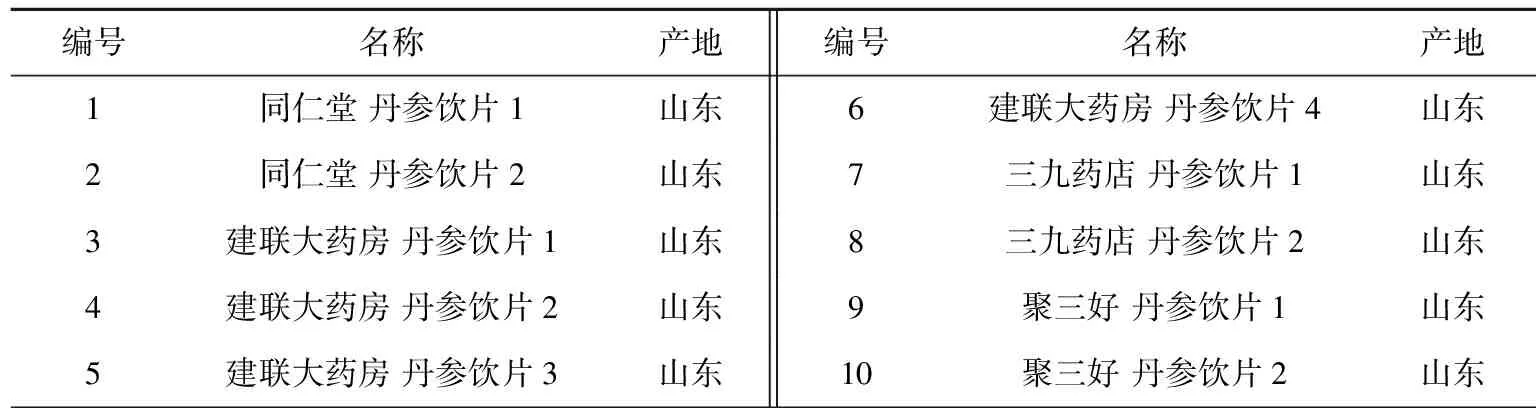
表1 样品信息

续表1
2.2 实验方法
2.2.1 供试品溶液的制备
取丹参饮片粉碎,过4号筛。精密称取丹参药材粉末0.2 g,加入20 mL 80%甲醇水溶液,称重,超声恒温提取30 min,冷却至室温称重后用80%甲醇水溶液补足失重。提取液经0.22 μm滤膜抽滤后备用。
2.2.2 对照品溶液的制备
精密称取咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA 对照品适量,加甲醇配制成浓度分别为1.70、2.40、1.00、1.30、1.20、1.00 mg·mL-1的对照品储备溶液,4 ℃存储备用。使用时,用甲醇稀释上述标准储备溶液,配制成不同浓度的单标溶液。各取单标溶液适量,配制所需浓度的混合标准溶液。
2.2.3 色谱条件
Luna C18(4.6 mm×250 mm,5.0 μm)柱。流动相A为乙腈,流动相B为水(0.6 %乙酸),流速1.0 mL·min-1,进样量10 μL,检测波长254 nm。梯度洗脱:0~5 min,3%~7% A;5~8 min,2%~22% A;8~15 min,22%~70% A;15~25 min,70%~90% A;25~30 min,90%~100% A。
3 结果与讨论
3.1 色谱条件优化
本文考察了Kromosial C18(4.6 mm×250 mm,5.0 μm)、Agilent SB C18(4.6 mm×250 mm,5.0 μm)、Agilent TC C18(4.6×250 mm,5.0 μm)和Luna C18(4.6 mm×250 mm,5.0 μm)色谱柱针对丹参中咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA 6种成分的分离效果。结果表明,采用Luna C18(4.6 mm×250 mm,5.0 μm)色谱柱时,峰型和分离度较好。因此,选用Luna C18(4.6 mm×250 mm,5.0 μm)色谱柱对丹参饮片提取物进行色谱分析。
对比了相同比例的乙腈-水和甲醇-水体系对提取物的分离效果。结果发现,采用乙腈-水体系时,丹参饮片提取物分离效果明显较好,故采用乙腈-水体系作为流动相。由于丹参提取物成分复杂,等度洗脱难以实现上述6种成分的色谱分离,因此采用梯度洗脱对丹参提取物进行分析。
咖啡酸、迷迭香酸、丹酚酸B等成分属于酸性成分,易造成色谱峰拖尾,在流动相中加入一定量的弱酸可以抑制有机酸的电离从而改善色谱峰峰型。考察了水相分别加入不同比例的乙酸(0.2%、0.4%、0.6%和0.8%)对丹参提取物色谱分离的影响,结果发现水相中加入0.6%乙酸时色谱峰对称性较好、峰型尖锐。
另外,柱温对色谱峰分离度、峰型和保留时间等均具有一定的影响。先后调节柱温箱温度在25、30、35、40和45 ℃时比较得出,当柱温为40 ℃时,色谱峰分离度和峰型明显较好,可以用于后续研究。
在波长选择上,经二极管阵列检测器考察各类成分在不同波长(190~600 nm)下的紫外吸收波长。结果表明,在254 nm下各类成分均有吸收,且各化合物具有较好的分离度和灵敏度,因此选择254 nm作为检测波长。在优化后的色谱条件下,丹参提取物的色谱分离图如图1所示。
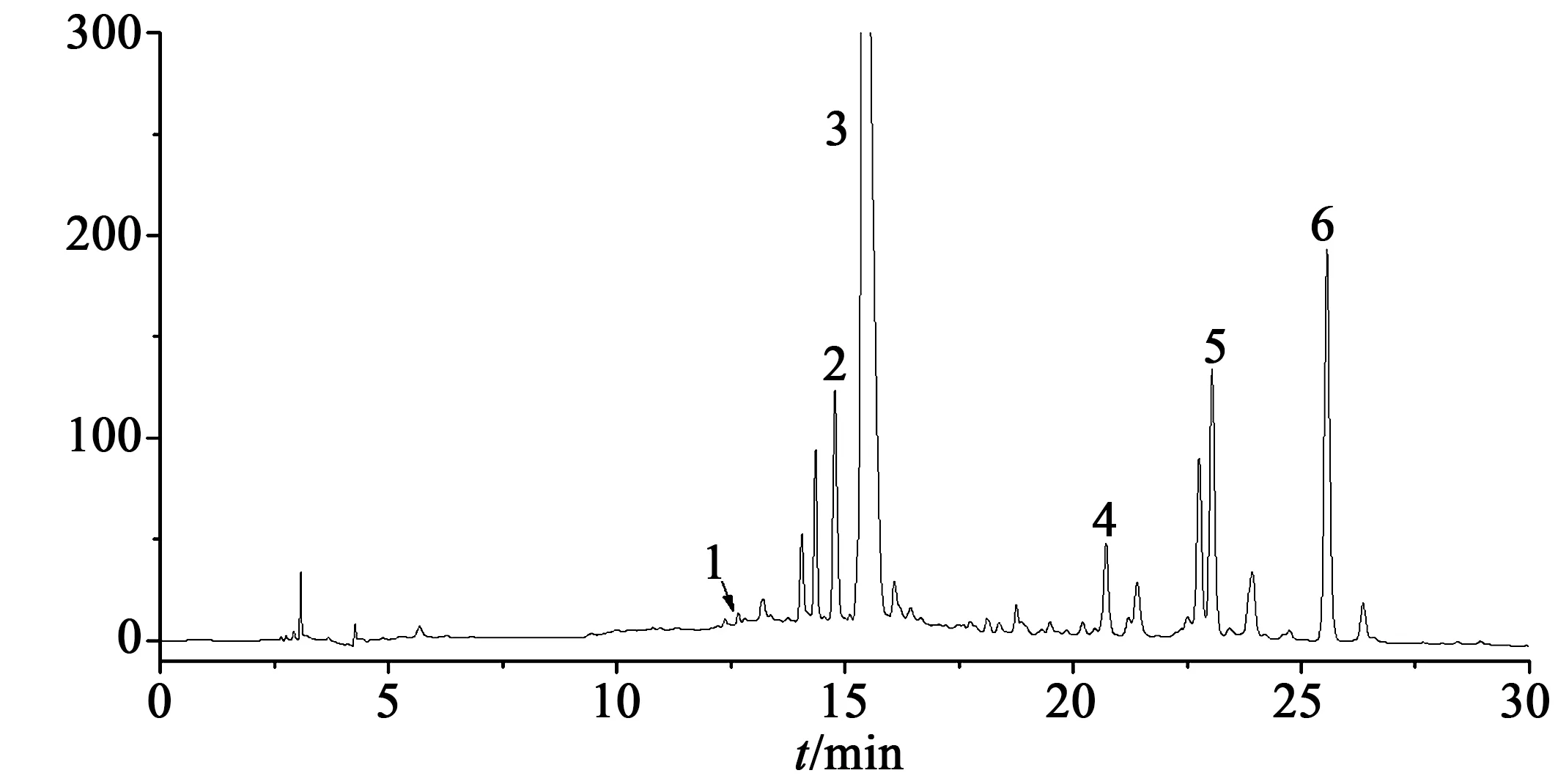
1 咖啡酸;2 迷迭香酸;3 丹酚酸B;4 二氢丹参酮Ⅰ;5 隐丹参酮;6 丹参酮ⅡA
3.2 方法学考察
3.2.1 线性关系考察
分别精密吸取6种对照品溶液适量,按照不同比例稀释得到不同浓度的混合对照品溶液。按照3.1的色谱条件进样分析,以峰面积为纵坐标(y),化合物浓度为横坐标(x)绘得各化合物标准曲线,各化合物的回归方程、相关系数、线性范围、检测限(3倍信噪比计算)、定量限(10倍信噪比计算)见表2 。由表2中可以看出,在给出的线性范围内各化合物所建立的标曲线性良好,可以用于后续的定量分析。
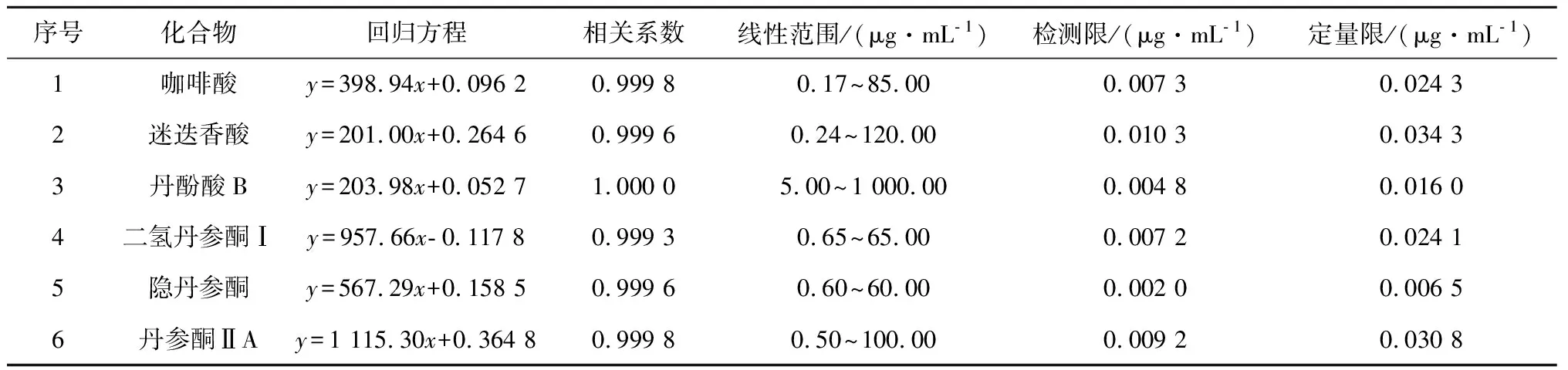
表2 6种成分的回归方程、检测限和定量限
3.2.2 精密度实验
精密称定丹参样品0.2 g,处理后按2.2.3的色谱条件连续进样6次,分别测出6种化合物的峰面积和保留时间,计算出各个化合物的峰面积和保留时间的相对标准偏差。6种化合物峰面积的相对标准偏差分别为2.294%、0.804%、1.000%、2.914%、0.329%、0.081%;保留时间的相对标准偏差分别为0.020%、0.025%、0.083%、0.013%、0.015%、0.011%,说明仪器精密度良好。
3.2.3 重复性实验
精密称定同一丹参样品6份,分别用2.2.1制备供试品溶液的方法处理,精密吸取5 μL进样分析,经过计算得到6种化合物峰面积的相对标准偏差分别为2.692%、2.451%、2.380%、1.944%、2.137%、2.952%;保留时间的相对标准偏差分别为0.210%、0.020%、0.031%、0.041%、0.034%、0.173%,说明该方法的重现性较好。
3.2.4 稳定性实验
取丹参样品分别于0 、2 、4 、8 、12 、24 h进样分析,检测和计算得到6种化合物峰面积的相对标准偏差分别为3.333%、2.659%、2.305%、1.620%、0.961%、2.512%;保留时间的相对标准偏差分别为0.020%、0.053%、0.115%、0.008%、0.012%、0.010%。由于其保留时间的相对标准偏差均小于1%,峰面积的相相对标准偏差均小于4%,说明该样的化学性质在24 h内较稳定。
3.2.5 加标回收率
精密称取丹参样品6份,每份0.2 g,分别精密称定加入咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA标准品适量,按上述供试品溶液制备方法处理后进样分析。其平均回收率(n=6)分别为94.42%、92.32%、101.04%、94.82%、95.39%、104.19%,相对标准偏差分别为2.87%、1.98%、3.01%、2.95%、3.71%和4.19%。结果表明,各目标成分加标回收率为92.32%~104.19%,回收率良好。
3.3 含量测定
取17批不同来源的丹参样品,采用2.2.1样品溶液制备方法进行制备,分别进样分析,得出上述6种化合物的相应峰面积,根据上述方法中回归方程算出各化合物的含量,平行3次取平均值。
利用Origin7.5 对所有含量测定数据按来源分组处理,得到带误差棒的柱状图,见图2。由图2中可以看出,来源于四川的丹参饮片中的6种成分含量均高于源自山东和云南的,尤其以丹酚酸B、隐丹参酮和丹参酮ⅡA的含量较为明显。6种成分的总平均含量为 (11.72±0.71)mg·g-1。

图2 三组丹参饮片中各化合物含量柱状图
不同来源丹参饮片中各化合物的含量均有差异。山东产丹参饮片的二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA 3种丹参酮的含量高于云南产丹参饮片,来源于山东和云南的丹参饮片中上述3种丹参酮总含量分别为 (3.52±0.17)mg·g-1和(3.14±0.17)mg·g-1。而源自山东的丹参饮片中咖啡酸、迷迭香酸和丹酚酸B的含量低于源自云南的丹参饮片,这两个地区丹参饮片中3种酚酸总含量分别为(37.75±2.26)mg·g-1和(54.09±0.27)mg·g-1。
3.4 聚类分析
聚类分析又称群分析,是研究样品或指标分类问题的一种统计分析方法,同时也是数据挖掘的一个重要算法。本研究中以17批不同来源的丹参饮片样本为研究对象,以HPLC法测得的6种水溶性和脂溶性成分的含量为变量,进行聚类分析,以得到各样本间的聚集关系,见图3。
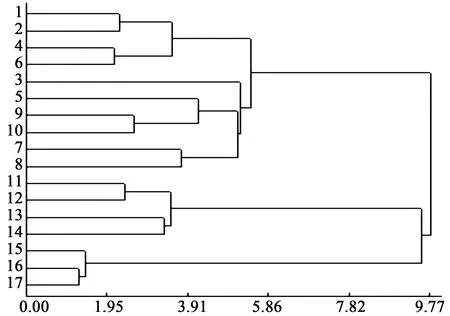
图3 17批丹参饮片样本的聚类分析图谱
由聚类结果可以看出,图3中1~10批样本为一组,11~14号样本为一组,15~17号样本为一组分别聚集,结合表1中样品来源信息可知这三组样本分别来源于山东、四川和云南,该聚集关系与样品信息高度一致。其中四川组和云南组聚集关系较近,推测可能是由于四川与云南地理来源较为接近,丹参药材的种植条件(环境、气候等)较为相似,造成所含化学成分具有相似的分布规律。其次,各组内部也存在聚集关系差异,11~14号样本组即四川组样本中,11、12号和13、14号分别聚集较近,可能是由于这两组饮片分别来源于四川不同产区。山东组中由于样本量较大且来源复杂,其内部聚集划分等级和组别较多。
可以看出,采用本研究测定的丹参中6种水溶性和脂溶性成分含量结果结合聚类分析,可以较好地实现对不同来源丹参饮片样品的区分,可以较为明显地表现出各样本间的差异关系。
4 结论
本研究发展了超声辅助提取-HPLC-DAD同时测定丹参饮片中6种成分,即咖啡酸、迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮和丹参酮ⅡA的方法。研究表明,该方法简单、快速,可以实现丹参中不同极性成分的同时提取、分析。应用该方法对山东、四川和云南不同来源的丹参饮片进行分析表明,三个来源丹参饮片中各化合物的含量均存在一定差异,结合聚类分析可以实现其来源区分,进一步证明了其产地差异性。
但由于受到样品数量的限制,详细的差异分析有待进一步研究。本研究为了解不同来源丹参饮片的质量现状及合理利用提供了科学依据。
