新型手性硫脲的合成与表征
2019-12-25王建玲马志伟
王建玲,马志伟
(河南牧业经济学院,河南 郑州 450046)
自上世纪70年代脯氨酸被成功用于催化分子内不对称Aldol反应以来,2000年,Barbas等人又报道了分子间的直接不对称Aldol反应。这些较早的不对称催化方法,不仅为手性合成提供了一种简便的方法,同时吸引了众多化学工作者将有机小分子化合物作为催化剂的研究兴趣。
尽管脯氨酸在大多反应中表现出了优异的不对称催化性能,但其自身的缺点也是不容忽视的。例如,有一些传统有机溶剂中,脯氨酸的溶解性能较差,从而影响其发挥作用;再如,以平面芳香醛为底物的直接不对称Aldol反应中,选择性较差等。因此,为了提高反应活性、立体选择性和底物的适用范围,化学工作者们在开创脯氨酸类似物方面做了大量工作。
硫脲类化合物最初主要用于分子识别领域。近些年来,由于其优秀的氢键代体结构,被引入催化剂分子中,并发挥了不错的效果。
为了使某一催化剂的作用更加优秀,有时合适的添加剂或共催化化合物可以起到至关重要的作用。例如,已有文献报导的脯氨酸催化的直接不对称Aldol反应中,少量水的加入,可以明显加快反应速率,并提高产物的对映选择性。
为此,我们考虑将脯氨酸与新型手性硫脲联合起来,共同来催化反应。一方面,硫脲的加入,可以改变脯氨酸的溶解性和反应活性;另一方面,通过二者之间的氢键作用,可以在反应过渡态中,更好地发挥催化剂的作用,从而提高产物的对映选择性。新型手性硫脲的合成路线如图1所示。
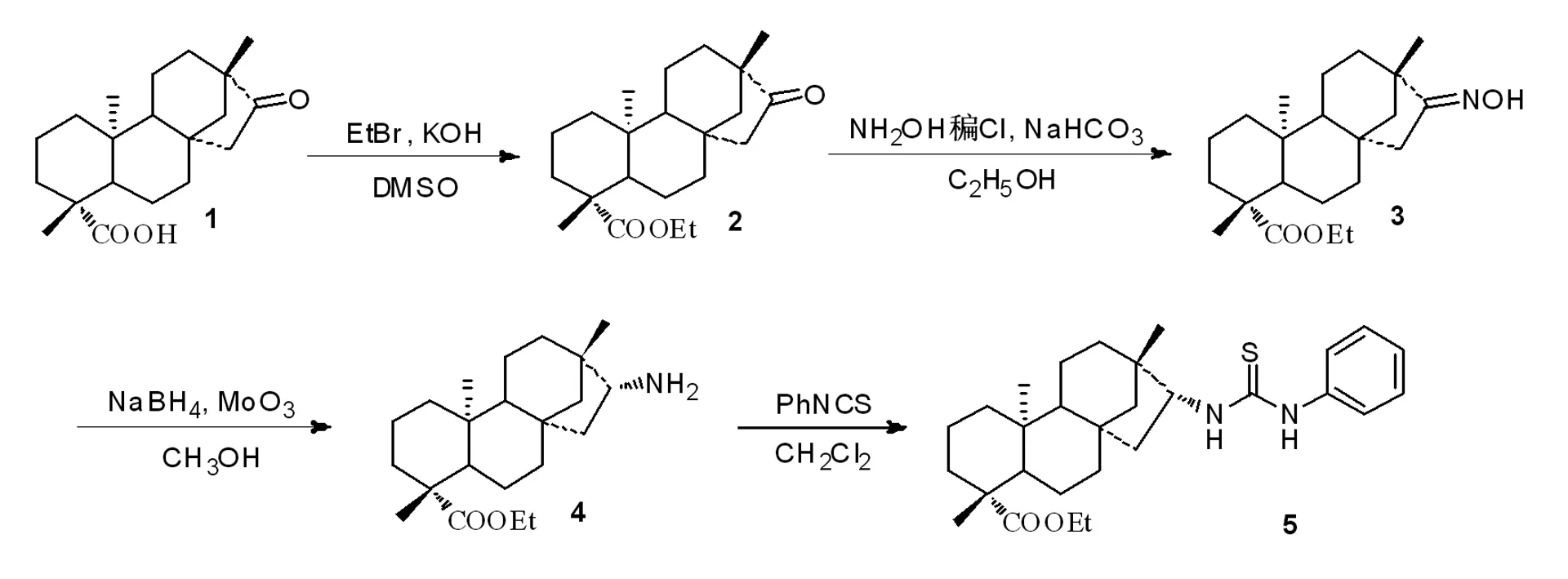
图1 新型手性硫脲的合成路线
1 主要仪器
XT5A显微熔点仪、Bruker DPX 400(400MHz)型超导核磁共振仪(内标为TMS)、Thermo Nicolet IR200型红外光谱仪(KBr压片)、Waters Micromass Q-Tof MicroTM高分辨质谱仪(电喷雾离子源)、Labtech-2006型高效液相色谱仪。
2 化合物的合成与表征
将天然产物甜菊糖的水解产物异斯特维醇(化合物1)10 g、氢氧化钾2 g、溴乙烷2 mL加入DMSO(70 mL)中。室温条件下搅拌反应过夜。加入500 mL冰水稀释、搅拌、过滤得粗品,经柱层析分离后得白色固体纯品化合物2。产率92%;熔点125.0~126.8℃;1H NMR (400 MHz,CDCl3): δ 0.76 (s,3H),0.83~1.06 (m,4H),1.17 (s,3H),1.21 (s,3H),1.25 (t,J = 7.2 Hz,3H),1.39~1.46 (m,5H),1.57~1.87 (m,8H),1.98 (m,1H),2.16 (m,1H),2.95 (m,1H),4.09 (q,J = 7.2 Hz,2H); IR (KBr,cm-1): ν 1145,1450,1729,2846,2925,2956; HR-MS (m/z): calcd.for C22H34O3Na[M+Na]+369.2406,found 369.2404。
将化合物2(0.34 g,1 mmol)、盐酸羟胺(0.10 g,1.5 mmol)和碳酸氢钠(0.13 g,1.5 mmol)加入乙醇(25 mL)中,加热回流反应2 h。减压蒸除溶剂后,乙酸乙酯萃取,有机相经干燥、过滤、浓缩后得白色固体产品即化合物3。可不经纯化,直接用于下步反应。白色固体,产率96%;熔点42.2~44.0℃;1H NMR (400 MHz,CDCl3): δ 0.76 (s,3H),0.83~1.08 (m,4H),1.09 (s,3H),1.17 (s,3H),1.19~1.22 (m,2H),1.25 (t,J = 7.1 Hz,3H),1.38~1.47 (m,4H),1.56~1.89 (m,7H),2.01 (m,1H),2.16 (m,1H),2.96 (m,1H),4.07 (m,2H); IR (KBr,cm-1): ν 574,721,791,848,928,1027,1096,1151,1178,1232,1298,1319,1376,1449,1722,2846,2938,3305; HR-MS (m/z): calcd.for C22H35NO3Na [M+Na]+384.2515,found 384.2514。
将化合物3(3.61 g,10 mmol)、三氧化钼(2.19 g,15 mmol)加入甲醇(30 mL)中,而后在冰浴条件下,向体系中分批加入硼氢化钠(1.90 g,50 mmol),加毕,室温条件下搅拌反应过夜。过滤,滤液用二氯甲烷萃取,有机相经干燥、过滤、浓缩后得白色固体产品即化合物4。可不经纯化,直接用于下步反应。白色固体,收率77%;熔点186.5~188.0℃;1H NMR (400 MHz,CDCl3) δ 0.72 (s,3H),0.83 (s,3H),0.96~1.05 (m,4H),1.15 (s,3H),1.24 (t,J = 7.2Hz,3H),1.30~1.35 (m,6H),1.55~1.80 (m,9H),2.13-2.17 (m,1H),2.86~2.90 (m,1H),4.05~4.10 (m,2H); 13C NMR (CDCl3): δ 13.2,14.0,18.8,20.4,21.6,24.8,28.8,33.2,38.1,40.1,41.4,41.6,41.7,42.8,43.5,55.6,56.4,57.0,59.7,61.0,177.4,178.1; IR (KBr,cm-1): 1047,1093,1150,1176,1230,1373,1450,1660,1721,2844,2938,3354; HR-MS (m/z): calcd.for C29H43N2O6[M+H]+348.2903,found 348.2902。
将化合物4(0.35 g,1.0 mmol)、异硫氰酸苯酯(0.14 g,1.0 mmol)加入二氯甲烷(20 mL)中,室温条件下搅拌反应过夜。将体系浓缩得粗品,经柱层析分离后得白色固体纯品化合物5。白色固体,收率94%;熔点93.5~94.6℃;1H NMR (400 MHz,CDCl3,TMS): δ 0.63 (s,3H),0.80 (dt,J = 13.2,4.0 Hz,1H),0.91 (s,3H),0.94~1.05 (m,4H),1.14 (s,3H),1.22~1.27 (m,5H),1.30~1.45 (m,4H),1.50~1.65 (m,5H),1.76~1.80 (m,2H),2.05 (t,J = 12.8 Hz,2H),2.13 (d,J = 14.2 Hz,1H),4.01~4.14 (m,2H),4.44 (s,1H),6.24 (d,J = 8.0 Hz,1H),7.21 (d,J = 8.0 Hz,2H),7.31 (t,J = 7.2 Hz,1H),7.44 (t,J = 4.0 Hz,2H),7.84 (s,1H); 13C NMR(100 MHz,CHCl3): δ 13.3,14.1,14.2,18.8,284.9,28.8,34.7,37.9,38.0,39.9,40.9,43.6,55.4,60.0,60.4,62.5,125.0,127.2,130.1,136.3,177.5,180.6; IR (KBr,cm-1): ν 696,751,1027,1095,1152,1180,1237,1308,1450,1497,1528,1598,1719,2846,2940,3293,3386; calcd.for C29H43N2O2S [M+H]+: 483.3045,found 483.3044。
3 新型硫脲(化合物5)与脯氨酸催化的2-硝基苯甲醛与环己酮的直接不对称Aldol反应
将脯氨酸(0.025 mmol,2.9mg),硫脲5(0.025 mmol,12.1mg)和1.8 mL正乙烷加入反应瓶中,而后加入环己酮(4 mmol,0.4 mL),室温搅拌15 min后,加入2-硝基苯甲醛(0.25 mmol),室温搅拌反应2天。反应结束后,在体系中加饱和食盐水,而后用乙酸乙酯萃取。合并有机相后,用饱和食盐水洗涤,干燥后,过滤、浓缩得粗品。经薄层色谱分离得目标产物。
液相分离条件为:HPLC (for anti-isomer): Chiralcel OD-H,UV 254,i-PrOH/Hexane = 5/95,flow rate 1.0 mL/min,tR 17 min (major),tR 21 min (minor).
结果为:产率85%,dr值(anti/syn)为64/36,ee值为60%。
4 结论
本文成功合成了一个未见文献报道的新型手性硫脲化合物5。合成方法简便,且目标产物收率高。此硫脲可与脯氨酸一周催化芳香醛和环己酮的直接不对称Aldol反应,所得加成产物具有较高的收率,但非对映选择性和对映选择性结果不理想。对此催化体系的优化及目标催化剂在其他反应中的应用探索工作仍在进行中。
