茯砖茶对NAFLD大鼠肠道黏膜屏障及肝损伤的保护作用研究
2019-12-25左高隆陈美艳林勇林海燕刘仲华吴文亮
左高隆,陈美艳,林勇,3*,林海燕,3,刘仲华,3,吴文亮
茯砖茶对NAFLD大鼠肠道黏膜屏障及肝损伤的保护作用研究
左高隆1,2,陈美艳1,2,林勇1,2,3*,林海燕1,2,3,刘仲华1,2,3,吴文亮1,4
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128;4. 湖南省农业科学院茶叶研究所,湖南 长沙 410125
为探讨茯砖茶对高脂诱导的非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)大鼠肠黏膜屏障及肝损伤的保护作用,将SD雄性大鼠随机分为正常组、NAFLD组、茯砖茶低、高剂量组,每组8只。通过分析大鼠的采食量、体重变化、血脂指标、肝脏指标及病理切片来评估NAFLD大鼠模型的构建情况及茯砖茶的干预作用。通过分析空肠与结肠病理及PAS染色切片、绒毛高度/隐窝深度值(V/C值)、血清二胺氧化酶(DAO)和脂多糖(LPS)活力评估肠道完整性和通透性;通过分析空肠上皮间淋巴细胞(JIL)数量和血清肿瘤坏死因子(TNF-α)活力评估肠道相关炎症。结果表明,茯砖茶能减少NAFLD大鼠的采食量和体重,降低血脂水平,减少血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活力,并抑制肝脏的脂质聚集和炎细胞浸润。茯砖茶还降低了血清炎症因子TNF-α和血清LPS的水平,并使血清DAO活力上升。同时,茯砖茶抑制了NAFLD大鼠空肠和结肠绒毛中发生的炎细胞浸润现象,减少了空肠绒毛脱落、断裂、稀疏和紊乱现象,增加了空肠绒毛V/C值,降低了空肠上皮间淋巴细胞数量,增加了空肠和结肠的杯状细胞数量。这些结果说明,茯砖茶能够有效的改善高脂饮食诱导的肠道黏膜屏障及肝损伤,起到防治NAFLD的作用。
茯砖茶;非酒精性脂肪肝病(NAFLD);肠道屏障
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)表现为肝实质细胞脂质贮积和脂肪变性,与肥胖、胰岛素抵抗等代谢综合症密切相关[1]。据报道,全球NAFLD的患病率约为24%[2],Day等[3]提出的“二次打击”学说是目前被广泛接受的NAFLD发病机制。然而,越来越多的研究表明肠道稳态与NAFLD的发生和发展有着紧密联系,特别是“肠-肝轴”理论的提出为研究肠道与NAFLD之间的关系提供了依据[4]。NAFLD患者普遍存在肠道屏障损伤,当肠道功能被破坏时,会增加肠道通透性,导致促炎性细菌成分如脂多糖(Lipopolysaccharide,LPS)易位,刺激toll样受体4(TLR4),并通过门静脉进入肝脏,引起肝脏炎症应激反应和全身的胰岛素抵抗,进而促使NAFLD发生和发展[5]。已有大量研究表明,茶叶可以调节肠道菌群,并能够很好地改善胰岛素抵抗、肝脏脂质聚集和炎症等与肥胖相关的代谢综合征[6-7]。茯砖茶是湖南极具特色的黑茶,经过冠突散囊菌发酵,促进了茶叶中有机成分的转化,产生了大量氧化产物、水解产物和有机酸等物质[8]。我们之前的研究表明茯砖茶能够调节高脂血症小鼠的脂质代谢紊乱并减轻肝脏的氧化应激[9]。也有文献报道,喂食茯砖茶能够降低高脂饮食大鼠的体重和肝脏脂肪变性,并抑制高脂血症的发展[10];茯砖茶能够对肠道病原菌产生抑制作用,并改变肠道菌群的构成[11-12]。基于此,我们推测茯砖茶能够对NAFLD大鼠的肠道黏膜屏障损伤起到保护作用,从而能改善NAFLD相关症状。本文从体重、器官指数、炎症因子、内毒素水平、肠肝损伤等角度,探究茯砖茶对NAFLD大鼠肠道黏膜屏障及肝损伤的保护作用。
1 材料和方法
1.1 试验材料
1.1.1 茶叶样品
茯砖茶(700 g包装)由湖南中茶茶业有限公司安化茶厂提供,经黑毛茶紧压发花干燥后制成(生产日期:2013年10月28日,批号:051)。
1.1.2 试验动物
SD雄性大鼠由湖南斯莱克景达实验动物有限公司提供,体质量为(100±20) g,生产许可证号:SCXK(湘)2016-0002。
1.1.3 饲料配方
高脂饲料:参照《保健食品检验与评价技术规范-辅助降血脂功能评价方法》(2012年修订),配方为基础饲料63.6%、蔗糖20.0%、猪油15.0%、胆固醇1.2%、胆酸钠0.2%。
1.2 仪器与试剂
1.2.1 试剂
总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-c)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-c)、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate transaminase,AST)、二胺氧化酶(Diamine oxidase,DAO)测定试剂盒购自南京建成生物工程研究所。肿瘤坏死因子(Tumor necrosis factor,TNF-α)、脂多糖(LPS)Elisa测定试剂盒购自卡迈舒(上海)生物科技有限公司。
1.2.2 仪器
LC10AT-VP Plus高效液相色谱系统(日本岛津公司)、MIKRO 22R冷冻离心机(德国Hettich公司)、Modulyod-230冷冻干燥机(美国Thermo公司)、Thermo Scientific Varioskan Flash酶标仪(美国Thermo公司)、UV-2550紫外分光光度计(日本Shimadzu公司)、AEU-210湘仪电子天平(长沙湘仪天平仪器公司)、Allegra X-22R台式离心机(美国贝克曼公司)、移液枪(美国Thermo公司)、压力蒸汽灭菌锅(上海中安医疗器械厂)、病理切片机(上海徕卡仪器有限公司)、石蜡包埋机(武汉俊杰电子有限公司)。
1.3 试验方法
1.3.1 茶样干粉制备
取适量茯砖茶样品,按料液比1∶10,沸水浸提3次,每次浸提20 min,滤纸过滤,合并浸提液,减压浓缩至一定体积,于–20℃预冻12 h,放入冷冻干燥机干燥24 h,收集茶粉后于–20℃保存。
1.3.2 茯砖茶感官审评和生化成分测定
茶叶审评采用密码审评方法,称取3 g茶样,150 mL开水冲泡5 min。从外形、汤色、香气、滋味、叶底5项因子进行两次感官审评;水浸出物测定:依据GB/T 8305—2013方法;茶多酚总量测定:依据GB/T 8313—2018;游离氨基酸总量测定:依据GB/T 8314—2013;可溶性糖总量测定:蒽酮-硫酸比色法;咖啡碱含量测定:高效液相色谱法(HPLC)。
1.3.3 动物模型的构建和给药标准
参照已有研究[13]建立动物模型和给药标准,取体质量为(100±10) g的SPF级雄性SD大鼠,在温度(25±2)℃和湿度40%~60%的环境中自由饮食基础饲料和饮用水。适应性饲养一周后,将大鼠随机平均分为4组:正常组、NAFLD模型组、茯砖茶低剂量组(233 mg·kg-1)、茯砖茶高剂量组(700 mg·kg-1),每组8只。每日上午9点对茯砖茶组大鼠灌胃不同剂量的茯砖茶水提物,均用蒸馏水配置2 mL,正常组和NAFLD组大鼠灌胃相同体积的蒸馏水。其中正常组大鼠喂食基础饲料,其余组大鼠喂食高脂饲料,共持续56 d。最后一次灌胃后禁食不禁水24 h,将大鼠麻醉,主动脉取血,解剖收集肝脏、脾脏和肠道,迅速称重后于–80℃保存。给药标准:选择茶叶人体推荐量(成人60 kg每日饮用10 g干茶,即166.7 mg·kg-1)的5、15倍为茯砖茶组的低、高剂量浓度。每只大鼠每日给予茶粉剂量(mg·kg-1)=166.7×倍数×浸提率(28%)。
1.3.4 大鼠体质量和采食量的测定
大鼠体质量每7 d称取一次。每日给各组大鼠定量添加350 g饲料,定期回收并称取当日剩余饲料,计算采食量。
1.3.5 血清指标的测定
主动脉取血后,放入EP管中,在4℃静置2 h后,于4℃下3 500 r·min-1离心15 min,取上清液。严格按照试剂盒说明书操作步骤检测血清TG、TC、HDL-c、LDL-c、ALT、AST、LPS、DAO和TNF-α含量。
1.3.6 器官指数测定
将大鼠各器官用4℃生理盐水洗净血渍,滤纸吸干表面水分后称其湿重。器官指数=器官湿质量(g)/大鼠体质量(g)×100%。
1.3.7 大鼠组织病理学观察
大鼠肝脏和肠道病理切片制备:分别取每只大鼠肝脏、空肠和结肠组织的相同部位,在10%福尔马林液下固定,固定后经流水冲洗数小时。制备石蜡切片,HE染色,显微镜下拍照观察。另对空肠和结肠组织进行PAS染色,显微镜下拍照观察。组织切片倍数为100×和200×。
1.3.8 大鼠空肠绒毛长度、隐窝深度和上皮间淋巴细胞数量的测定
利用Caseviewer图像分析软件对大鼠的空肠绒毛高度和隐窝深度进行测定。每组随机选取4只大鼠的空肠HE染色切片,每张切片选取2根形态结构完整的绒毛,计算绒毛长度/隐窝深度(Villus height/Crypt depth,V/C)的比值;统计绒毛上每100个空肠细胞间分布的上皮间淋巴细胞数量。
1.3.9 数据处理

2 结果与分析
2.1 茯砖茶感官审评及主要化学成分分析
本次试验使用的茯砖茶样品菌花较多,汤色橙黄,叶底黑褐,香气和滋味纯正;图1表明,其水浸出物、茶多酚、咖啡碱、可溶性糖含量和氨基酸总量分别为28.94%、11.02%、5.28%、5.49%和0.97%。其结果与已有文献报道[14]相近,基本符合茯砖茶的主要内含物质品质特征。
2.2 茯砖茶对NAFLD大鼠体重和采食量的影响
表1表明,与正常组比较,NAFLD组体重从第28天开始显著增加(<0.05),这说明喂食高脂饮食一定时间后能够明显增加大鼠体重;与NAFLD组比较,茯砖茶高剂量组从第7天到第56天体重显著减少(<0.05),茯砖茶低剂量组在第7、21、35、42、49、56天体重显著减少(<0.05),接近甚至低于正常值。这些表明茯砖茶能够有效降低NAFLD大鼠的体重。此外,采食量方面,正常组、NAFLD组、茯砖茶低剂量组相差不大,而茯砖茶高剂量组采食量下降明显。
2.3 茯砖茶对NAFLD大鼠血清指标的影响
表2表明,与正常组比较,NAFLD组血清TG、TC和LDL-c水平都极显著增加(<0.01),HDL-c水平极显著降低(<0.01),这说明喂食高脂饮食能够明显改变大鼠血脂水平;与NAFLD组比较,茯砖茶组血清TG、TC和LDL-c水平都极显著降低(<0.01),HDL-c水平极显著升高(<0.01)。此外,与正常组比较,茯砖茶低剂量组血清TG、LDL-c和茯砖茶高剂量组血清TG、TC、HDL-c、LDL-c水平无显著性差异(>0.05)。这说明茯砖茶能够有效改善NAFLD大鼠的血脂水平,使其接近于正常水平。
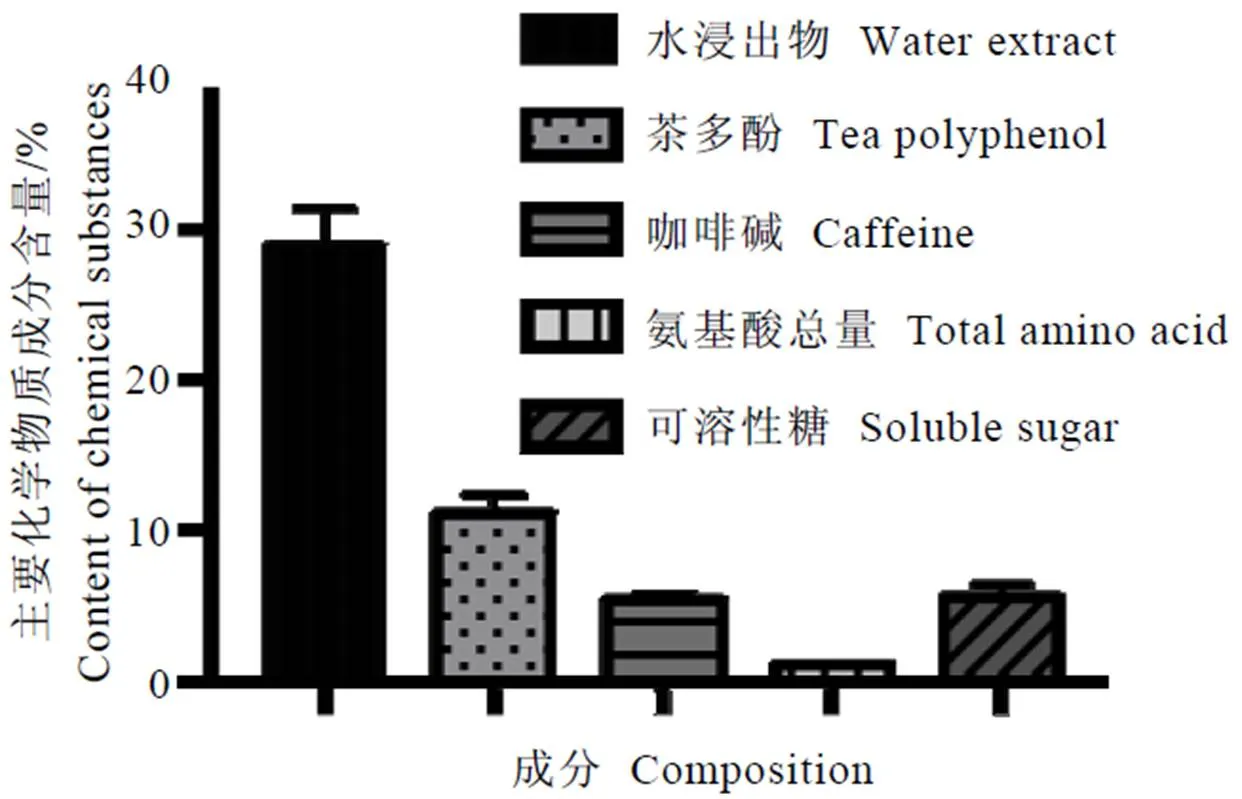
图1 茯砖茶主要化学成分分析结果
2.4 茯砖茶对NAFLD大鼠肝脏损伤的影响
表3表明,与正常组比较,NAFLD组肝体比、脾体比、血清AST和ALT活力极显著增加(<0.01),这说明高脂饮食能够引起肝脏损伤;与NAFLD组比较,茯砖茶低剂量组的肝体比和血清ALT活力以及茯砖茶高剂量组的肝体比和脾体比显著降低(<0.05),茯砖茶低剂量组的脾体比和血清AST活力以及茯砖茶高剂量组的血清AST和ALT活力极显著降低(<0.01);此外,与正常组比较,茯砖茶低剂量组脾体比、血清ALT活力和茯砖茶高剂量组血清AST、ALT活力无显著性差异(>0.05)。这说明茯砖茶能够有效减轻NAFLD大鼠的肝脏损伤。

表1 茯砖茶对大鼠体重和采食量的影响(n=8)
注:与NAFLD组比较,*<0.05,**<0.01;与正常组比较,#<0.05,##<0.01。下同
Note: Compared with NAFLD group,*<0.05,**<0.01. Compared with normal group,#<0.05,##<0.01. The same below
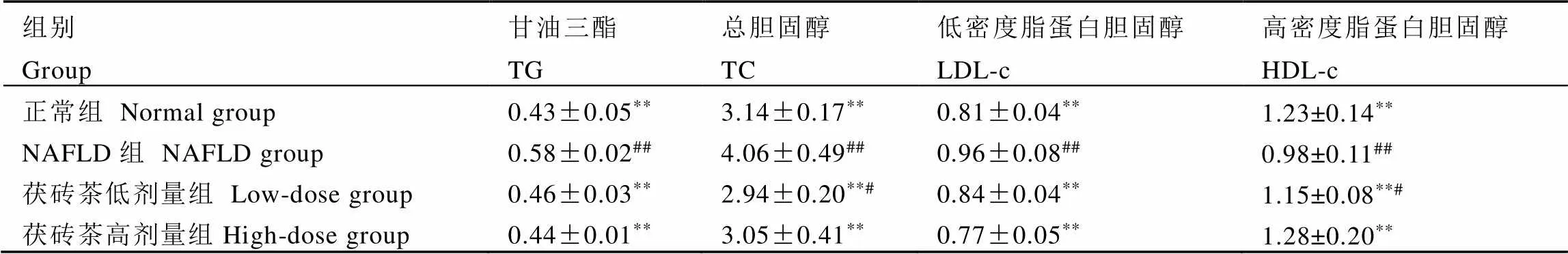
表2 茯砖茶对大鼠血清指标的影响(n=8)

表3 茯砖茶对大鼠器官指数和肝脏指标的影响(n=8)
2.5 茯砖茶对NAFLD大鼠肝脏组织形态结构的影响
图2表明,与正常组比较,NAFLD组肝脏肥大,颜色泛白。油红染色切片显示,NAFLD组肝脏有大量脂质聚集。HE染色切片显示,NAFLD组黑色箭头处存在炎细胞浸润现象,红色箭头处存在脂质聚集现象。这说明高脂饮食会引起大鼠肝脏产生炎症和发生脂质紊乱;与NAFLD组比较,茯砖茶组肝脏较瘦小,颜色红润。油红染色切片显示,茯砖茶组尤其高剂量条件下肝脏脂质聚集现象明显减少。HE染色切片显示,茯砖茶组无炎细胞浸润和脂质聚集现象。这说明茯砖茶能够减轻NAFLD大鼠肝脏炎症并改善脂质代谢紊乱。
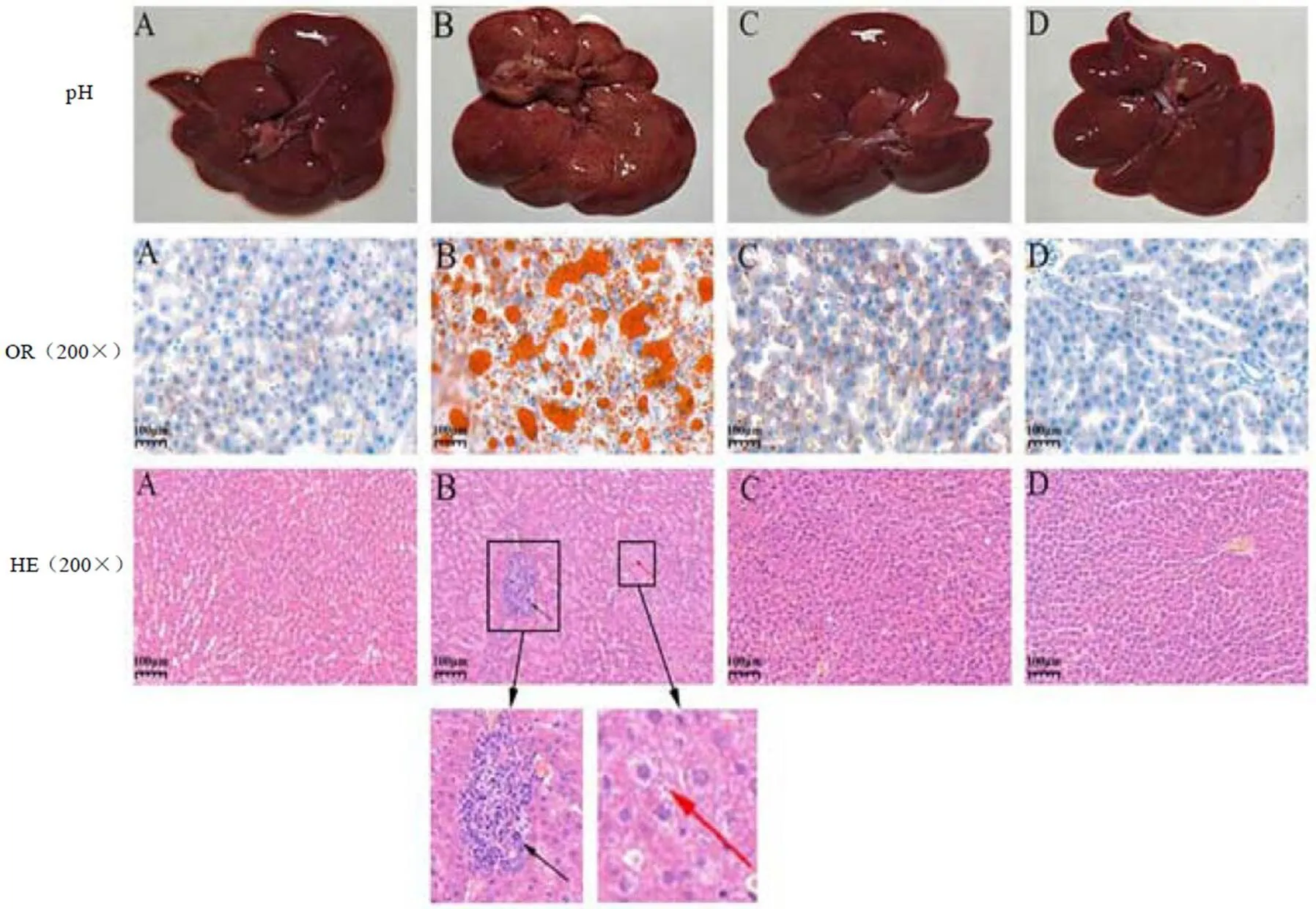
注:A:正常组;B:NAFLD组;C:茯砖茶低剂量组;D:茯砖茶高剂量组;PH:照片;OR:油红染色切片;HE:HE染色切片。下同
2.6 茯砖茶对NAFLD大鼠炎症的影响
表4表明,与正常组比较,NAFLD组血清DAO活力极显著降低(<0.01),血清LPS、TNF-α活力和空肠上皮间淋巴细胞数量极显著增加(<0.01),这说明高脂饮食会破坏大鼠肠道黏膜完整性,增加肠道通透性和引发炎症;与NAFLD组相比,茯砖茶组血清DAO活力极显著增加(<0.01),血清LPS活力和空肠上皮间淋巴细胞数量均极显著降低(<0.01),而TNF-α活力在茯砖茶低高剂量组中分别显著和极显著降低(<0.05和<0.01);此外,与正常组比较,茯砖茶组血清DAO、TNF-α活力和空肠上皮间淋巴细胞数量无显著性差异(>0.05)。这说明茯砖茶能够有效保护NAFLD大鼠肠道黏膜完整性,降低肠道通透性和减轻炎症。
2.7 茯砖茶对NAFLD大鼠肠道形态结构的影响
表5表明,与正常组比较,NAFLD组空肠绒毛高度和V/C值极显著减少(<0.01),隐窝深度极显著增加(<0.01),这说明高脂饮食会破坏大鼠的肠道完整性及吸收功能;与NAFLD组比较,茯砖茶组空肠绒毛高度和V/C值极显著增加(<0.01),隐窝深度极显著减少(<0.01);此外,与正常组比较,茯砖茶组空肠绒毛高度、隐窝深度和V/C值基本无显著性差异(>0.05)。这说明茯砖茶能够改善NAFLD大鼠的肠道完整性及吸收功能,并使其接近于正常状态。大鼠肠道病理组织切片表明(图3),与正常组比较,NAFLD组空肠绒毛大量断裂,排列紊乱,有明显从肠黏膜上脱落的现象,空肠与结肠黑色箭头处存在炎细胞浸润。这说明高脂饮食会破坏大鼠肠道形态结构的完整性,增加肠道炎症;与NAFLD组比较,茯砖茶组的空肠绒毛排列整齐,紧密,绒毛完整性高,且空肠和结肠都未产生炎症,无病理特征。这说明茯砖茶能够对NAFLD大鼠的肠道形态结构完整性起到保护作用,并减轻肠道炎症。大鼠肠道PAS染色切片表明(图4),与正常组比较,NAFLD组空肠和结肠黑色箭头处杯状细胞数量较少,稀疏且分布不均。这说明高脂饮食会破坏肠道的黏液屏障;与NAFLD组比较,茯砖茶组杯状细胞数量丰富,分布紧密且均匀。这说明茯砖茶能够保护肠道的黏液屏障。
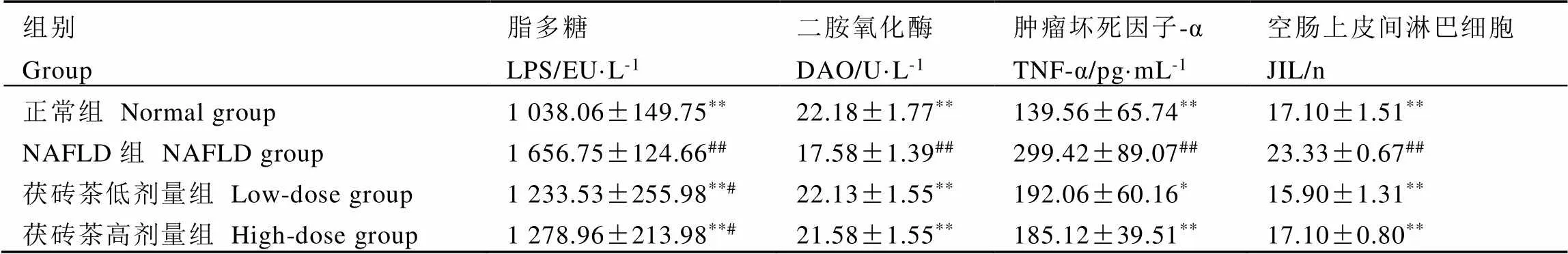
表4 茯砖茶对大鼠肠道黏膜屏障损伤指标的影响(n=8)

表5 茯砖茶对大鼠空肠绒毛的影响(n=8)
3 讨论
NAFLD是全球一个严重的健康问题,然而目前针对于NAFLD的防治措施仅限于饮食调节和体重控制。因此,寻求能有效防治NAFLD的植物资源是当前研究的热点。许多研究表明,绿茶中儿茶素等物质对于高脂饮食动物的体重调节、脂质代谢紊乱、葡萄糖代谢等具有十分有益的作用[15]。与绿茶相比,茯砖茶不仅能够调节脂质代谢,且降低血清TG含量的能力更强[16],这可能是由于茯砖茶真菌发酵过程中产生了类异戊二烯糖酐、黄芪甙和异牡荆黄素等新化合物[17]。Gangarapu等[18]发现,对肠道屏障功能保护可作为一种防治NAFLD及其相关疾病的新手段。之前有研究证明茯砖茶能够改变高脂饮食大鼠肠道菌群并保护大鼠肝脏,但并未对其保护肠道黏膜屏障方面展开研究[11-12]。我们旨在从肠道黏膜屏障的角度探究茯砖茶对于NAFLD的保护作用。
通过给NAFLD大鼠灌胃茯砖茶,我们发现茯砖茶能够有效降低其体重,且高剂量茯砖茶对于体重的减轻效果更加显著,这与Foster等[12]的结果一致。然而,大鼠的采食量随茯砖茶剂量增加而逐渐降低,这可能是由于茶叶中的咖啡碱、儿茶素以及膳食纤维进入胃肠道后影响了饱腹感信号激素的分泌从而使饱腹感上升[19]。血脂升高提示可能存在脂质代谢紊乱[20]。茯砖茶显著降低了NAFLD大鼠的血脂水平,这对于调节NAFLD大鼠脂质代谢紊乱起到了重要作用,除茶多酚和茶多糖等物质外,还可能与茯砖茶经冠突散囊菌为优势微生物发酵后产生的降脂类物质有关[21]。ALT和AST是肝损伤的敏感指标,茯砖茶显著降低了NAFLD大鼠血清中ALT和AST水平。此外,大鼠病理组织切片表明,茯砖茶减少了NAFLD大鼠肝脏炎症和脂质聚集,这可能与茯砖茶内含茶多酚和茶多糖等物质密切相关[22]。这些现象说明,茯砖茶能够对NAFLD大鼠肝脏损伤起到保护作用。

图4 大鼠肠道PAS染色切片(100×)
肠道黏膜屏障损伤后,LPS易位进入体循环并通过TLR4/核因子-kB(NF-kB)通路介导炎症反应,同时降低瘦素水平,诱发胰岛素抵抗,这也是NAFLD产生的重要原因[5]。我们发现茯砖茶降低了NAFLD大鼠血清LPS和TNF-α水平,这可能是由于茯砖茶的摄入降低了肠道革兰氏阴性细菌数量,而发挥这种功效的物质可能为茶多酚[7]。DAO主要存在于小肠黏膜,其活性是小肠黏膜完整性和成熟度的指标[23],茯砖茶增加了NAFLD大鼠血清中的DAO水平。同时肠道PAS染色表明,茯砖茶增加了肠道杯状细胞数量。杯状细胞分泌的黏蛋白构成了肠道的黏液屏障,能够避免有害细菌和物质与小肠黏膜上皮接触并减少肠道机械损伤[24]。小肠上皮间淋巴细胞是肠道免疫系统最先发生免疫反应的细胞[25],茯砖茶显著减少了NAFLD大鼠空肠的上皮间淋巴细胞数量,表明茯砖茶能够减少病原微生物对肠道屏障的入侵,这可能是因其富含的茶多糖等物质对肠道菌群失调起到了调节作用[26]。小肠绒毛的V/C值是小肠绒毛完整性及消化吸收功能的重要指标[27]。茯砖茶抑制了由高脂饮食引起的V/C值降低,表明其能够改善NAFLD大鼠的肠道完整性及消化吸收功能。肠道HE染色切片显示茯砖茶保护了NAFLD大鼠肠道黏膜屏障的完整性并减少肠道炎症,可能是由于茯砖茶内含儿茶素等物质通过NF-kB途径抑制了肠道炎症[28]。此外,茶多糖经肠道微生物发酵后产生的短链脂肪酸也有利于抑制炎症和脂质代谢紊乱[29]。因此,我们认为茯砖茶能够有效保护NAFLD大鼠肠道黏膜屏障,这也可能是减少肠道LPS进入体循环的一个重要原因。
综上所述,本研究表明茯砖茶能够对高脂饮食诱导的NAFLD起到防治作用。这主要是因为茯砖茶能够对NAFLD大鼠肠道黏膜屏障损伤起到保护作用,减少LPS进入体循环,降低血清炎症因子,改善肝脏脂质代谢紊乱和炎症损伤。我们的研究从肠道黏膜屏障的角度完善了茯砖茶对于NAFLD的防治作用,然而具体的分子机制还有待进一步探究。
[1] Papatheodoridi M, Cholongitas E. Diagnosis of non-alcoholic fatty liver disease (NAFLD): current concepts [J]. Current Pharmaceutical Design, 2018, 24(38): 4574-4586.
[2] Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity [J]. Hepatology, 2010, 40(6): 1387-1395.
[3] Day CP, James OF. Steatohepatitis: A tale of two “hits” ? [J]. Gastroenterology, 1998, 114(4): 842-845.
[4] Marshall JC. The gut as a potential trigger of exercise-induced inflammatory responses [J]. Can J PhysiolPharmacol, 1998, 76(5): 479-484.
[5] Backhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage [J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723.
[6] Zhou CJ, Huang S, Liu JQ, et al. Sweet tea leaves extract improves leptin resistance in diet-induced obese rats [J]. Journal of Ethnopharmacology, 2013, 145(1): 386-392.
[7] Kayashima Y, Murata S, Sato M, et al. Tea polyphenols ameliorate fat storage induced by high-fat diet in[J]. Biochemistry & Biophysics Reports, 2015, 4(4): 417-424.
[8] 彭晓赟, 梁法亮, 李冬利, 等. 茯砖茶中冠突散囊菌的次级代谢产物及其生物活性研究[J]. 中草药, 2013, 44(14): 1881-1886.
[9] 林勇, 刘仲华, 林海燕, 等. 茯砖茶水提物对高脂血症小鼠脂质代谢的影响及其抗氧化作用的研究[J]. 食品安全质量检测学报, 2015(5): 1561-1566.
[10] Li Q, Liu Z, Huang J, et al. Anti-obesity and hypolipidemic effects of Fuzhuan brick tea water extract in high-fat diet-induced obese rats [J]. Journal of the Science of Food & Agriculture, 2013, 93(6): 1310-1316.
[11] Wang Y, Xu A, Liu P, et al. Effects of Fuzhuan brick-tea water extract on mice infected withO157:H7 [J]. Nutrients, 2015, 7(7): 5309-5326.
[12] Foster MT, Gentile CL, Cox-York K, et al. Fuzhuan tea consumption imparts hepatoprotective effects and alters intestinal microbiota in high saturated fat diet-fed rats [J]. Molecular Nutrition & Food Research, 2016, 60(5): 1213-1220.
[13] 吴文亮, 刘仲华, 林勇, 等. 陈年六堡茶对高脂血症小鼠的调脂护肝作用研究[J]. 茶叶科学, 2018, 38(4): 104-112.
[14] 沈程文, 邓岳朝, 周跃斌, 等. 湖南茯砖茶品质特征及香气组分研究[J]. 茶叶科学, 2017, 37(1): 38-48.
[15] Frank T, Michael B. The potential role of green tea catechins in the prevention of the metabolic syndrome-a review [J]. Phytochemistry, 2009, 70(1): 11-24.
[16] 王蝶, 黄建安, 叶小燕, 等. 茯砖茶减肥作用研究[J]. 茶叶科学, 2012, 32(1): 81-86.
[17] Luo ZM, Du HX, Li LX, et al. Fuzhuanins A and B: The B-ring fission lactones of flavan-3-ols from Fuzhuan brick-tea [J]. Journal of Agricultural & Food Chemistry, 2013, 61(28): 6982-6990.
[18] Gangarapu V, Yildiz K, Ince AT, et al. Role of gut microbiota: obesity and NAFLD [J]. Turkish Journal of Gastroenterology the Official Journal of Turkish Society of Gastroenterology, 2014, 25(2): 133-140.
[19] Carter BE, Drewnowski A. Beverages containing soluble fiber, caffeine, and green tea catechins suppress hunger and lead to less energy consumption at the next meal [J]. Appetite, 2012, 59(3): 755-761.
[20] 李林清. 超声诊断脂肪肝与血脂、血糖、肝功能指标、肥胖之间的相关性分析[J]. 甘肃科技, 2013, 29(18): 136-137.
[21] 吕嘉枥, 郑欣欣, 马亚宁. 冠突散囊菌液体发酵产降脂类物质的初步研究[J]. 陕西科技大学学报(自然科学版), 2014, 32(6): 115-118.
[22] 林朝悦, 程波. 油茶及茶多酚抗炎作用及其机制研究[J]. 皮肤病与性病, 2011, 33(4): 190-193.
[23] Mennigen R, Bieganski T, Elbers A, et al. The histamine-diamine oxidase system and mucosal proliferation under the influence of aminoguanidine and seventy percent resection of the rat small intestine [J]. Agents & Actions, 1989, 27(1/2): 221-223.
[24] 唐秀莹, 陈正礼, 罗启慧, 等. 大豆异黄酮对大鼠肠道上皮内淋巴细胞、杯状细胞及瘦素长型受体的影响[J]. 浙江大学学报(农业与生命科学版), 2013, 39(3): 343-350.
[25] Xu RJ, Wang F, Zhang SH. Postnatal adaptation of the gastrointestinal tract in neonatal pigs: a possible role of milk-borne growth factors [J]. Animalence& Veterinary Medicine, 2000, 66(2): 95-107.
[26] Chen G, Xie M, Wan P, et al. Fuzhuanbrick tea polysaccharides attenuate metabolic syndrome in high-fat diet induced mice in association with modulation in the gut microbiota [J]. J Agric Food Chem, 2018, 66(11): 2783-2795.
[27] 李可洲, 李宁, 黎介寿, 等. 短链脂肪酸对大鼠移植小肠形态及功能的作用研究[J]. 世界华人消化杂志, 2002, 10(6): 720-722.
[28] Navarro-Peran E, Cabezas-Herrera J, Sanchez-Del-Campo L, et al. The anti-inflammatory and anti-cancer properties of epigallocatechin-3-gallate are mediated by folate cycle disruption, adenosine release and NF-κB suppression [J]. Inflamm Res, 2008, 57(10): 472-478.
[29] Chen G, Xie M, Wan P, et al. Digestion under saliva, simulated gastric and small intestinal conditions and fermentationby human intestinal microbiota of polysaccharides from Fuzhuan brick tea [J]. Food Chem, 2018, 244(1): 331-339.
Protective Effect of Fu Brick Tea on Intestinal Mucosal Barrier and Liver Injury in NAFLD Rats
ZUO Gaolong1,2, CHEN Meiyan1,2, LIN Yong1,2,3*, LIN Haiyan1,2,3, LIU Zhonghua1,2,3, WU Wenliang1,4
1. Key Lab of Tea Science of Ministry of Education, Hunan Agricultural University, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Hunan Collaborative Innovation Center for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 4. Tea Research Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China
To explore the protective effect of Fu brick tea on intestinal mucosal barrier and liver injury in rats with high-fat induced non-alcoholic fatty liver disease (NAFLD).SD male rats were randomly divided into normal, NAFLD, low-dose and high-dose Fu brick tea groups, 8 rats each group. The establishment of NAFLD rat model and the intervention effect of Fu brick tea were evaluated by analyzing the feed intake, weight change, blood lipid index, liver index and pathological section of rats. Intestinal integrity and intestinal permeability was assessed by pathological and PAS staining sections of jejunum and colon, villus height/crypt depth (V/C value) serum diamine oxidase (DAO) activity and lipopolysaccharide (LPS) activity. Intestinal-related inflammation was assessed by the number of jejunum intraepithelial lymphocytes (JIL) and the activity of serum tumor necrosis factor-alpha (TNF-α). The results show that Fu brick tea could reduce the feed intake andbody weight of NAFLD rats, decrease blood lipid levels, reduce the activity of aspartate aminotransferase (AST) and alanine aminotransferase (ALT) in serum, and inhibit lipid accumulation and inflammation in the liver. Fu brick tea also reduced the levels of serum inflammatory factors TNF-α and serum LPS and increased the activity of serum DAO. Moreover, Fu brick tea inhibited inflammatory cell infiltration in jejunum and colon villi of NAFLD rats, reduced the jejunum villus shedding, fracture, sparse and disorder, increased the jejunum villus V/C value, and decreased the number of jejunum intraepithelial lymphocytes, and increased the number of goblet cells in the jejunum and colon. These data indicate that Fu brick tea could effectively improve the intestinal mucosal barrier and liver injury induced by high-fat diet, which could be used to prevent and treat NAFLD.
Fu brick tea, non-alcoholic fatty liver disease (NAFLD), intestinal barrier
TS272.5+4;R574
A
1000-369X(2019)06-631-10
2019-04-08
2019-07-08
湖南省研究生科研创新项目(CX20190518)、作物种质创新与资源利用重点实验室开放研究项目(15KFXM14)
左高隆,男,硕士研究生,主要从事茶叶功能成分利用相关研究。
ly2005306@163.com
