多回波CSE-MRI评价淫羊藿苷对去势大鼠骨髓脂肪的影响
2019-12-24蒋蕾黄冕赵亦卿李鑫东李冠武于吉利常时新
蒋蕾, 黄冕, 赵亦卿, 李鑫东, 李冠武, 于吉利, 常时新
淫羊藿苷(icariin,ICA)在骨的代谢过程中具有双重作用,即促进骨形成及抑制骨吸收[1-2]。有证据表明,ICA可促进间充质干细胞成骨分化、抑制其成脂分化[3-4]。提示研究骨髓脂肪具有现实意义,但绝大多数研究仍停留在细胞层次,在活体动物上探讨其作用的相关研究较少。
磁共振波谱成像(MRS)是普遍认可的定量评估脂肪及其代谢物的一种安全、准确、无创的影像检查技术。但MRS也存在不足之处,如一次扫描仅能获得覆盖较小感兴趣区域的代谢物信息,匀场及扫描时间长,图像后处理复杂、繁琐、耗时,而且在小动物成像方面受到诸多限制。化学位移编码(chemical shift encode,CSE)水-脂分离MRI,尤其是多回波T2*校正技术可准确定量分析脂肪,得到真正意义上的质子密度脂肪分数,但需考虑T1偏倚、噪声偏倚、T2*衰减及多脂峰模型等混杂因素。T2*校正衰减效应对定量分析骨髓或肝脏质子密度脂肪分数(proton density fat fraction,PDFF)十分重要[5-6]。因此,本研究拟在活体水平利用CSE-MRI技术探讨ICA对骨质疏松大鼠骨髓脂肪的作用,为ICA应用于临床实践提供理论依据。
材料与方法
1.实验动物及分组设计
48只3月龄雌性SD大鼠适应环境14天后,随机均分为4组:假手术(sham-operated,SHAM)组、去卵巢(ovariectomized,OVX)对照组、OVX+雌二醇(estradiol,E2)对照组及标准剂量ICA干预组(OVX+ICA)。术后7天开始给药(目的是使OVX大鼠血清雌二醇水平明显降低[7])。ICA干预组给予ICA灌胃(ICA标准品,高效液像色谱证实纯度>98%),剂量为每天125 mg/kg[8]。OVX+E2对照组则给予E2,剂量为每天25 μg/kg,生理盐水配制。SHAM组及OVX组则给予等量去离子水,给药时间、次数与前2组相同。实验前及实验后每周记录各组实验大鼠的体重,以便于调整给药剂量,给药剂量每周按体重调整一次,给药持续时间12周,每周给药6次。
2.双能X线吸收测量仪骨密度检测
采用双能X线吸收测量仪进行检查,随机配置有小动物成像分析软件。利用小动物模式进行扫描,获取实验大鼠腰椎(L4~L5)及左侧股骨的密度(bone mineral density,BMD),单位为g/cm2。每天扫描前常规完成一次DXA质量保证测试。本研究期间,其变异系数在0.34%~0.60%范围内波动。
3.CSE-MRI检查
使用Siemens virio 3.0T MRI扫描仪和4通道相控阵大鼠专用线圈。俯卧位,常规行左侧股骨冠状面T2WI扫描后,采用3D-GRE T2*衰减校正6回波水-脂分离成像技术。扫描参数:TR 5.91 ms,TE 2.45 ms/△3.675 ms,层厚1.5 mm,视野14 cm×14 cm,翻转角9°,矩阵192×192,带宽650 Hz/像素,激励次数2,扫描时间54 s。扫描结束后,多回波CSE-MRI数据采用商业MATLAB(v2014-64bit,MathWorks,Natick,MA)进行处理。选择经过股骨中线的图像,在股骨远端手工绘制ROI,避开骨皮质。每个样本测量2次,计算骨髓脂肪分数(marrow fat fraction,FF),取其均值作为最终分析结果。
4.血清E2及骨代谢标志物
应用ELLSA试剂盒 ,通过测定吸光度(Immunodiagnostic Systems,Boldon,UK)进行标准曲线绘制,利用标准曲线来计算待测样本的含量,指标包括E2、Ⅰ型胶原交联C末端肽(β-CrossLaps,β-CTX)及总Ⅰ型胶原氨基端延长肽(aminoterminal propeptide of type I procollagen,PINP)。
5.骨髓脂肪细胞定量分析
左侧股骨远端使用4%多聚甲醛固定24h后,使用10% 乙二胺四乙酸脱钙液(PH 7.3),4℃脱钙。每两天更换新的脱钙液,28天后脱钙结束。之后进行包埋,在冠状面方向切取4 μm厚薄片,HE染色,中性树胶封片。采用Leica Q-win Plus图像分析系统对脂肪细胞进行定量分析,每张切片上下、左右随机选择5个200倍光镜视野,进行骨髓中脂肪细胞的定量计数,包括脂肪细胞平均直径(μm)、每个视野内脂肪细胞密度(个/mm2)及脂肪细胞总面积/骨髓面积(除骨小梁外的所有区域)的百分比(%),将5个视野内各指标测量值的均值作为最终分析结果。
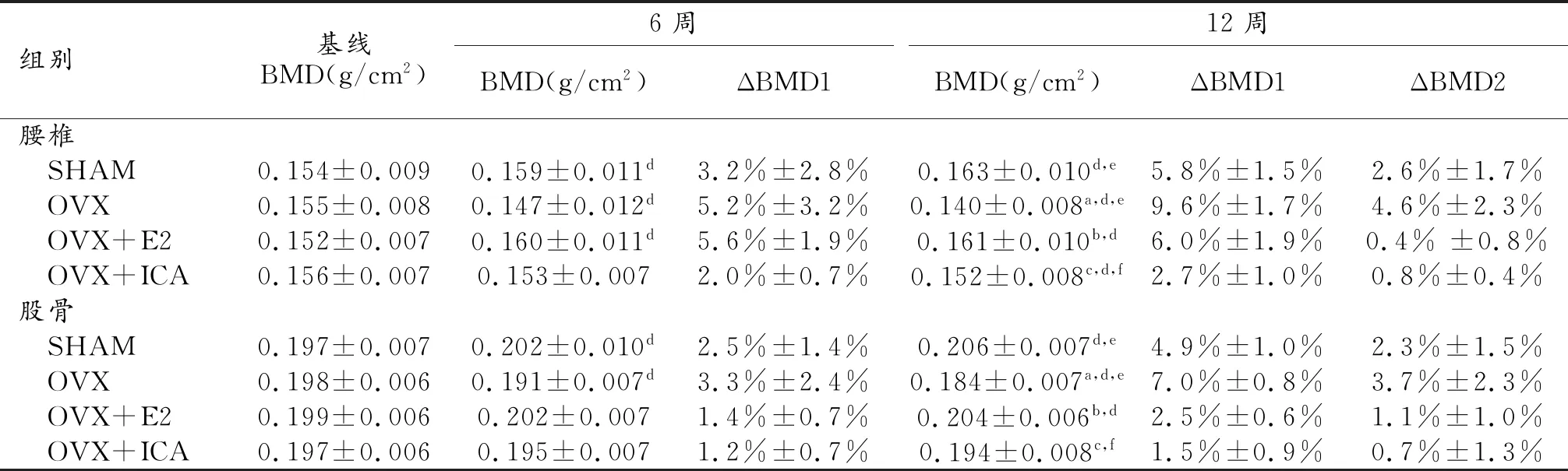
表1 各时点四组大鼠骨密度比较
注:同时点不同组比较:与SHAM组比较,aP<0.001,fP<0.05;与OVX组比较,bP<0.001,cP<0.05。同组不同时间点比较:与基线(0周)比较,dP<0.05;与前一时点比较,eP<0.05。ΔBMD1代表较基线水平的变化率,ΔBMD为较前一个时间点的变化率。

表2 各时点四组大鼠骨髓FF值及组间比较
注:同时点不同组比较:与SHAM组比较,aP<0.001;与OVX组比较,bP<0.001,cP<0.001。同组不同时间点比较:与基线0周比较,dP<0.05,eP<0.01;与前一时点比较,fP<0.05,gP<0.01。ΔFF代表2个时间点之间FF值的变化率。
6.统计学处理
使用IBM SPSS 23.0统计软件包,采用Shapiro-Wilk检验判断数据的正态性,符合正态性分布的计量数据采用均数±标准差来表示,FF值及BMD的组间比较采用重复测量方差分析,通过球形检验的结果判断重复测量数据之间是否存在相关性后,采用重复测量的多元方差分析模型对时间与分组的交互作用进行分析,其它研究参数在多组间的比较采用单因素方差分析(多重比较Bonferronid)。以P<0.05为差异具有统计学意义。
结 果
1.大鼠一般情况
在造模过程中及3次MRI、DXA扫描过程中因为麻醉意外引起的大鼠死亡情况:SHAM组3只,OVX组2只、OVX+E2组1只、OVX+ICA组2只。在整个给药过程中,不明原因死亡:OVX+E2组1只,OVX+ICA组1只。骨标本处理不当引起标本不能使用:OVX组1只、OVX+E2组1只。因此,剩余36只动物有完整的实验数据。
2.大鼠BMD变化
表1为各组大鼠腰椎及股骨BND的动态变化。二元重复测量方差分析显示,OVX组腰椎或股骨BMD随时间推移呈明显渐进性降低,与基线相比,在第6周时,腰椎及股骨BMD分别降低3.3%、5.2%;在第12周时,则分别降低9.6%、7.0%。OVX组腰椎骨丢失率从第6周的7.5%增加至第12周的14.1%,股骨骨丢失率则分别为5.4%、10.7%。二元方差分析提示,同一时间点不同组别比较,至第12周时,OVX组与SHAM组BMD差异存在统计学差异。E2治疗,腰椎及股骨BMD值基本恢复至SHAM组水平。ICA治疗,可在一定程度上恢复由于雌激素缺乏所致的骨丢失,但BMD不能恢复至SHAM组水平。
3.四组大鼠不同时间点股骨FF值的变化
在各时间点四组大鼠股骨FF值的测量值及组间比较结果见表2。在基线水平,四组FF值的差异无统计学意义(F=2.393,P=0.684);而第6周和12周时,四组间FF值的差异具有统计学意义(F=9.692,P<0.001;F=30.456,P<0.001)。图1为大鼠股骨各个时间点CSE-MRI图像。重复测量方差分析示,OVX组骨髓FF值随时间进程呈明显增高,FF值在每两个时间点的差异均有统计学意义;OVX组在第6周、第12周时FF值分别较基线时增高40.0%、69.4%%,而且第12周较第6周增高21.7%。二元方差分析示,在第6周和12周,OVX组FF值较SHAM组明显增高。 E2治疗后,FF呈现时序性降低;给予ICA治疗后,各时间点FF值与OVX组比较,差异均有显著统计学意义;而SHAM组的FF值与OVX+E2和OVX+ICA组间在各个时间点的差异均无统计学意义(P>0.05)。

图1 SHAM组第12周大鼠股骨CSE-MRI,测量FF=13.6%。a)脂像;b)水像 。 图2 OVX组第0周大鼠股骨CSE-MRI,FF=14.9%。a)脂像;b)水像。 图3 OVX组第6周大鼠股骨CSE-MRI,FF=20.0%。a)脂像;b)水像。 图4 OVX组第12周大鼠股骨CSE-MRI,FF=27.1%。a)脂像;b)水像。图5 OVX+E2组第12周大鼠股骨CSE-MRI,FF=14.0%。a)脂像;b)水像 。 图6 OVX+ICA组第12周大鼠股骨CSE-MRI,FF=15.6%。a)脂像;b)水像。

图7 骨髓组织病理图(×200,HE)。a)SHAM组,可见骨髓腔内有散在分布的脂肪细胞及骨小梁 ;b)OVX组,可见脂肪细胞明显增多、增大,骨小梁稀疏;c)E2组,脂肪细胞减少、体积缩小;d)ICA组,可见脂肪细胞减少,体积缩小,骨小梁结构较OVX组增多。

表3 各组动物血清雌二醇及骨代谢指标的比较
注:a与SHAM组比较,P<0.01;b与OVX组比较,P<0.01;c与E2组比较,P<0.05;d与SHAM组比较,P=0.001;e与OVX组比较,P<0.01。
4.四组大鼠血清E2及骨代谢标记物变化
四组大鼠血清E2及骨代谢标记物的测量值及组间比较结果见表3。OVX术后,E2水平明显下降,外源性补充E2,可维持血清E2水平。与SHAM组相比,OVX+E2组血清E2水平无明显差异。给予ICA治疗,血清E2水平高于OVX组而低于SHAM组和OVX+E2组(P均<0.05)。与SHAM组相比,OVX 组的PINP和CTX水平均升高(P<0.01),且CTX增高的程度比PINP显著。与OVX组相比,OVX+ICA组的PINP增高、而CTX降低(P<0.01)。

表4 各组动物骨髓脂肪细胞定量分析结果
注:a与SHAM比较,P<0.001;b与OVX比较,P<0.001。
5.四组大鼠骨髓脂肪细胞定量分析
四组大鼠骨髓脂肪细胞定量分析结果见表4、图7。与SHAM组相比,OVX组骨髓脂肪细胞4个指标值均明显升高(P<0.001),分别增高163%、29.5%、57.3%和40.0%;与OVX组相比,OVX+E2组和OVX+ICA组骨髓脂肪细胞4个指标值均明显降低(P<0.001);骨髓脂肪细胞4个指标值在OVX+E2及OVX+ICA组间的差异无统计学意义(P>0.05)。
讨 论
CSE-MRI在评估脂肪组织方面不仅可提供定量及定性信息,而且考虑了骨髓内脂肪组织空间分布不均质性的问题。而且,CSE-MRI PDFF还能反映骨髓脂肪组织空间分布的不均质性[5]。T2*校正对CSE-MRI准确定量分析脂肪含量相当重要,尤其是骨髓腔内因骨小梁的存在可导致局部磁场不均匀,缩短水和脂肪的T2值[9,10]。多数CSE-MRI研究中,假定水及脂肪具有相同T2*值,以此对T2*进行校正,提供对脂肪定量的准确性[11]。它适于肝脏脂肪的定量分析,因为在肝脏中脂肪含量相对来说比较低。实际上水及脂肪具有各自特定的T2*值,尤其是在脂肪丰富区域,如骨髓腔[6,12]。Karampinos等[13]利用先前测定的骨髓水及脂肪T2值,利用T2*校正方法消除由于H2O及脂质子T2*差异所导致的测量腰椎骨髓PDFF时的误差。本研究中,基于T2*校正方法采用6回波采集方式,较好的平衡了T2*衰减效应及采集时间,获得真正含义上的质子密度脂肪分数(PDFF)。
本研究发现,OVX术后给予ICA干预12周,可提高OVX大鼠血清PINP水平,并降低CTX水平,与以往研究结果相一致,即ICA可促进骨形成、抑制破骨细胞活性作用而降低骨吸收[14]。
近期的一些研究中也提出,ICA可以调控干细胞的成脂分化[1,3]。谢小伟等[3]证实了ICA可以在一定程度上减少超生理剂量糖皮质激素对Wnt信号通路的抑制作用,进而促进间充质干细胞的成骨分化、抑制其成脂分化。然而,目前的绝大多数研究数据仍然是停留在离体细胞水平,其组织细胞的生存环境在很大程度上有异于体内,离体研究所得结果尚需要得到活体研究结果的支持。正因为此,本研究将利用CSE-MRI技术从活体水平论证ICA对OVX骨髓脂肪的作用。
本研究中在给予OVX大鼠ICA治疗后,基于CSE-MRI技术测量骨髓FF值的动态变化,结果显示ICA组骨髓脂肪含量在实验过程中与SHAM组比较无明显差异。而且,骨髓组织病理切片的结果进一步表明应用了ICA后,不论是骨髓脂肪细胞面积百分比还是脂肪细胞周长、密度及直径均减小,提示脂肪细胞的生成得到抑制。总之,上述结果表明,ICA能够很好的逆转由于OVX引起的骨髓脂肪增多。
来源于老龄鼠的原代骨髓基质细胞中的成骨性标志基因的表达下降同时伴随PPAR-2的表达上升。相反,抑制间充质干细胞成脂则可增强骨的形成。例如,给予PPAR-2拮抗剂在抑制间充质干细胞成脂分化的同时,可促进其成骨分化,使得骨形成增多[15]。已经证实骨髓脂肪组织可分泌许多脂肪细胞因子或炎性因子如TNF-α、瘦素和脂联素等;其次,骨髓脂肪细胞也能产生脂肪酸,对成骨细胞表现出脂毒性作用[15,16]。临床研究也表明,骨髓脂肪含量与骨量、骨质量存在负性相关,骨髓脂肪增多被视为骨脆性的标志[17]。反之,降低骨髓脂肪容积可看成是骨质量增高的标志[16,18]。
骨骼与脂肪组织的关系非常复杂,虽然大量的数据包括细胞基因水平、组织病理学和临床研究都证实骨髓脂肪与骨质量存在“此消彼长”的关系,骨髓脂肪组织形成增多可负性调节骨的形成,降低骨髓脂肪含量则可促进骨的形成。然而,骨及骨髓脂肪可能存在着各自独立的调节机制,即在某些情况下,骨的代谢与骨髓脂肪的有无和多少无明显相关性。例如,虽然很多动物物种如限制热卡的小鼠或大鼠表现出骨髓脂肪异常增多伴有骨质受损[19],但新西兰大白兔同样限制热卡也可出现骨质丢失,然而并不出现骨髓脂肪肥胖[20]。骨髓脂肪细胞基因敲除的雌性小鼠,出现骨髓脂肪缺失,但并不能阻止OVX导致的骨质衰退[21],这也提示“无脂”并不能维持或促进骨形成。
综上所述,雌激素缺乏状态下骨髓脂肪容积增多,早期给予ICA干预可逆转上述病理状态。这提示ICA抗骨质疏松的机制除了其双重作用(即促进成骨及抑制破骨)外,抑制雌激素缺乏所致的骨髓脂肪形成也是其抗骨质疏松的可能机制之一。多回波CSE-MRI对药物抗骨质疏松相关的骨髓脂肪的机制研究提供补充信息。