胡杨不同发育阶段叶片光合作用及其光响应特征
2019-12-24单凌飞丁颖慧王双蕾张默实韩航石莎冯金朝
单凌飞, 丁颖慧, 王双蕾, 张默实, 韩航, 石莎, 冯金朝
胡杨不同发育阶段叶片光合作用及其光响应特征
单凌飞, 丁颖慧, 王双蕾, 张默实, 韩航, 石莎, 冯金朝*
中央民族大学生命与环境科学学院, 北京 100081
胡杨()为第三纪孑遗植物, 在个体的不同发育阶段形成了独特的异形叶, 具有较强的抗旱性和耐盐性, 是额济纳绿洲生态系统的主要建群种, 具有重要的研究价值。以内蒙古额济纳旗胡杨林自然保护区胡杨为研究对象, 通过实地调查观测, 分析了胡杨幼苗期、幼树期和成熟期叶片的形态变化规律及其性状特征, 利用Li-6400XT便携式光合作用系统测定了胡杨幼苗期、幼树期和成熟期不同形态叶片的光合作用光响应过程, 并采用直角双曲线修正模型对其进行了拟合分析。结果表明: (1)在胡杨生长发育过程中, 其叶片形态性状表现出明显的变化规律。随着胡杨树龄的增长, 其叶片的长/宽比值、比叶面积和叶片厚度逐渐减小, 而叶干物质含量、叶面积和叶干重数据增大。(2)胡杨成熟期阔卵圆形叶具有较高光合活性, 通过提高Pmax以增强光能利用率, 使其在干旱荒漠区高温、强光环境下仍能保持较高的光能转化效率与光合速率; 幼树期条形叶具有较宽的光能利用区间, 能够在弱光环境下保持较高的光合速率; 幼苗期条形叶具有较低的与相对较高的LCP、LSP及Pmax, 主要归因于其较高的比叶面积, 高效光捕获面积使其具有较高的光合速率; 上述结果是胡杨在不同光环境下形成的适应性反应和生理生态机制。(3)直角双曲线修正模型适于胡杨不同形态叶片光合生理参数的定量研究。
胡杨; 叶片形态; 光合作用; 光响应; 直角双曲线修正模型
0 前言
光合作用是植物将光能转换为可用于生命过程的化学能并进行有机物合成的复杂生物物理化学过程[1], 而植物净光合速率与光合有效辐射之间的定量关系是揭示植物光合生理过程对环境响应的基础[2, 3]。光合作用光响应曲线的测量与模拟可获得植物光合作用相关的最大净光合速率(Pmax)、表观量子效率()、光补偿点()、光饱和点()和暗呼吸速率(R)等重要光合参数, 有助于阐明植物光合机构运转状况、不同生境的光合能力及适应规律[4]。Blackman于1905年提出了第一个光合作用对光响应模型, 之后许多学者建立了不同的光响应模型, 常用的有直角双曲线模型[5]、非直角双曲线模型[6]、指数模型[7, 8]和直角双曲线修正模型[4, 9]等。前3种模型拟合的光响应参数与实测值差异较大, 难以准确模拟发生光抑制时的响应过程[4, 7, 10-13], 仅适用于拟合正常水分下植物光响应过程和响应参数[12, 13], 且无法适应拟合各种生境的不同植物。同时, 人们对不同光响应适用条件、范围及拟合出的指标、参数均缺乏深刻的理解, 导致光响应模型选择时缺乏可信度[10-13]。叶子飘等[10]构建的直角双曲线修正模型克服了传统模型的局限性, 能够较准确地拟合各种生境植物光响应过程及其特征参数[4, 10-13]。目前, 直角双曲线修正模型应用于冬小麦和不同土壤水分下山杏、油松、酸枣、沙棘光合作用的光响应和CO2响应模拟[10-13], 取得较好的效果, 但对于极端干旱荒漠区植物的光合作用是否适用尚需深入研究。
胡杨()是杨柳科(Salicaceae)杨属()中古老和珍贵的荒漠树种, 具有防风固沙、保护绿洲、维持荒漠区脆弱环境生态平衡的功能, 被确定为我国首批388种珍稀濒危渐危种[14]。在自然条件下, 胡杨叶片在幼苗期全部为条形叶; 随着树龄增长, 在同一植株上会同时出现条形叶、卵圆形叶和阔卵圆形叶等不同形态的叶片(异形叶), 这是胡杨对干旱环境长期适应的结果[14, 15]。目前, 关于胡杨异形叶的光合特性、叶绿素荧光特性、水分生理特性等[14-19]方面已有广泛研究, 但有关胡杨不同发育阶段异形叶光合作用-光响应特性研究还较少, 其光合生理参数与光照强度的定量关系尚不清楚。本文以内蒙古额济纳旗胡杨林自然保护区的胡杨为研究对象, 实地观测胡杨不同发育阶段叶片的形态性状与变化规律, 研究胡杨叶片的光合作用-光响应过程, 探索直角双曲线修正模型在拟合胡杨光响应过程与特征参数的适用性, 旨在阐明胡杨生长发育过程中不同形态叶片适应强光、高温荒漠环境的光合生理机制及生存策略, 为天然胡杨林保护与绿洲退化环境的生态恢复提供理论依据。
1 材料与方法
1.1 研究区域
研究区位于内蒙古自治区额济纳旗胡杨林自然保护区, 其地理位置为101°14′14.385″E, 42°1′ 11.441″N, 海拔996 m。该地区气候极端干旱, 属典型温带大陆性干旱气候, 主要特点为干旱少雨, 蒸发量大, 温差较大, 风大沙多。年平均气温8.5 ℃, 平均最低气温-12 ℃, 平均最高气温36.3 ℃; 年平均降水量38.7 mm, 蒸发量高达3706 mm; 日照时数3426.4 h, 无霜期146 d, 盛行风向为西北风。土壤类型为沙壤土, 地下水埋深为0—3 m。
1.2 试验设计
试验于2018年8月上旬进行, 在晴朗天气条件下选择生长状况良好的胡杨幼苗(基径1—1.5 cm)、幼树(基径5—8 cm)、成树(胸径30—35 cm)各3株进行观测研究。其中胡杨幼苗叶片为条形叶(A1), 幼树叶片为条形叶(A2)和披针形叶(A3), 成树叶片分别为披针形叶(A4)卵圆形叶(A5)和阔叶(A6)。观测时, 选取向阳枝条上部的第3、4位功能叶作为测定对象, 将枝条剪下迅速插入水中, 再从下部开始用枝剪剪去10—20 cm, 进行叶片光合作用的离体测定。光合测定完成后, 将叶片剪下, 用湿润的滤纸包裹放入冰盒带回室内, 进行叶片形态性状测定分析。
1.3 叶片形态性状测定
将叶片放在平整的A4纸上, 用数码相机拍照, 使用Image J软件处理叶片照片, 进行叶片长度、宽度和叶面积计算。叶片厚度的测定采用游标卡尺测量法, 选用精度为0.005 mm的游标卡尺, 每个叶片均沿主脉方向, 在距离主脉两侧约1 mm处各均匀选取3个测量点进行测定, 取平均值。采用电子天平(精度为0.001 g)测量叶片鲜重。上述测定完成后, 将叶片至于烘箱内, 80 ℃下烘干至恒重, 测定叶片干重。叶片干物质含量和比叶面积计算如下:
干物质含量()=叶片干重()/叶片鲜重()(1)
比叶面积()= 叶片面积()/叶片干重() (2)
1.4 光响应曲线测定
实验观测在上午进行, 先在自然光下诱导1.0—1.5 h, 之后使用Li-6400XT便携式光合仪(Li-Cor, Inc, USA)进行测定。其中气体流速控制为500 μmol·s-1, 叶室CO2浓度控制为400 μmol·mol-1, 叶室温度控制为25℃; 利用6400-02B LED红/蓝光源提供不同光合有效辐射(PAR), 光照梯度设定为2000、1800、1500、1200、1000、750、500、300、150、100、50和0 μmol·m-2·s-1; 每种形态叶片处理设3次重复, 实地测定叶片光合作用对光合有效辐射的响应曲线, 由光合仪自动记录叶片光合速率(P)等光合生理参数。
根据实际观测数据, 绘制胡杨不同形态叶片的光合作用-光响应(n-)曲线, 确定叶片的最大净光合速率(Pmax)、光饱和点()和暗呼吸速率(R)等光合生理参数[11, 12]; 同时采用弱光(PAR ≤200 μmol·m-2·s-1)条件下与P的线性回归方法求得表观量子效率()[1, 4]。采用直角双曲线修正模型拟合所测定的光响应曲线, 得出最大净光合速率(Pmax)、初始量子效率()、暗呼吸速率(R)、光补偿点()和光饱和点()等参数指标, 并与实测值进行比较分析。
1.5 模拟分析
采用直角双曲线修正模型[4, 10, 20]进行胡杨叶片光合作用-光响应曲线的拟合, 其表达式为:


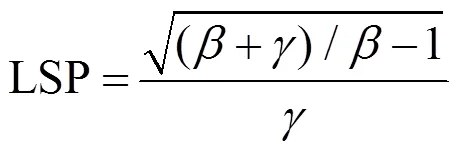
式中,P为净光合速率,Pmax为最大净光合速率,R为暗呼吸速率,为光合有效辐射, 本文中用表示,、、是独立于的系数[4]。
植物在光补偿点处的量子效率(φ), 内禀量子效率(φ)和光合作用光响应曲线上=0与=I两点连线斜率的绝对值(φ)的数学表达式为[12]:


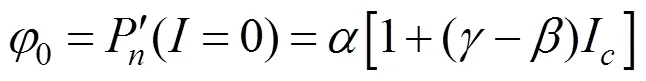

1.6 数据处理
采用Excel 2016软件进行实验数据处理, 使用SPSS 23.0软件进行叶片形态性状Pearson相关性分析。采用直角双曲线修正模型拟合叶片的光合作用光响应曲线并计算光合特征参数[21], 使用OriginPro 2016软件作图。
2 结果与分析
2.1 叶片形态性状
胡杨植株不同发育阶段的叶片形态表现出显著的差异性, 并呈现明显的形态性状特征和变化规律(表1)。
比较分析不同发育阶段胡杨叶片的形态指标(表1)可知, 胡杨叶片的叶干物质含量、叶面积和叶干重均表现出随胡杨树龄增长和个体生长发育而逐渐增大的趋势, 即A1< A2< A3< A4< A5< A6; 而比叶面积和叶片厚度则表现出逐渐减小的趋势, 其中比叶面积的变化趋势为A2> A1> A3> A5> A4> A6, 叶片厚度的变化趋势为A2> A1> A3> A4> A5> A6。
为了准确检验叶片各形态性状参数之间的相关性, 本文对胡杨不同叶片形态性状之间的Pearson相关系数进行了统计分析。表2结果表明, 叶片干物质含量与叶片长/宽比值和比叶面积呈显著负相关(< 0.05), 而与叶干重和叶面积呈极显著正相关(< 0.01), 即随着叶片面积、厚度、干重的增加, 叶片长/宽比值和比叶面积减小, 胡杨叶片干物质含量增大; 胡杨叶干重与比叶面积呈显著负相关(< 0.05), 而与叶面积呈显著正相关(< 0.05), 即比叶面积越小、叶面积越大, 其叶干重越大; 比叶面积和叶面积呈显著负相关(< 0.05), 即叶面积越大比叶面积越小。

表1 胡杨不同叶片的形态性状
注: A1幼苗条形叶; A2幼树条形叶; A3幼树披针形叶; A4成树披针形叶; A5成树卵圆形叶; A6成树阔卵圆形叶。

表2 胡杨叶片形态性状指标的相关分析
注:=6, **<0.01, *<0.05,为长/宽,为叶干物质含量,为叶面积,为比叶面积,为叶干重,为叶厚度。
2.2 叶片光合作用与光响应特征
胡杨不同形态叶片的P值随个体生长发育出现明显差异。由图1可知, 6种形态叶片A1、A2、A3、A4、A5、A6在接近光饱和点时的P分别为20.84、21.28、19.18、14.95、17.31、22.55 μmol·m-2·s-1。其中幼苗期和幼树期胡杨叶片的P相对较高, 成熟期胡杨阔卵圆形叶的P最高, 而生长在植株冠层下部的卵圆形叶和披针形叶的P明显降低。
植物光合作用-光响应曲线反映了在一定光照强度下植物的潜在光合能力及植物对生长环境的适应性。实地观测结果(图1)表明, 胡杨不同形态叶片的光合速率(P)对光合有效辐射()表现出不同的响应规律。在低光强(< 200 μmol·m-2·s-1)条件下, 胡杨不同形态叶片的P表现出相似的变化趋势, 近似呈线性增加。随着光照强度的增大, 胡杨叶片P随的变化呈曲线式上升; 至光饱和点()时,P曲线的变化渐趋平缓, 表现出一定的光饱和现象; 而不同形态叶片的P变化特征表现出较大的差异性。
胡杨幼苗期条形叶、幼树期条形叶以及成熟期披针形叶的P在为1800 μmolm-2·s-1左右达到饱和, 并维持在较高水平, 即未发生明显的光抑制。幼树期披针形叶、成熟期卵圆形叶和阔卵圆形叶的P在达1800—2000 μmolm-2·s-1时仍能够保持增长趋势, 而且光抑制现象也不明显。其中, 胡杨阔卵圆形叶P的上升趋势最为明显, 说明胡杨阔卵圆形叶具有适应极端干旱环境和强烈光照条件的能力, 对于胡杨适应干旱环境具有重要作用。

图1 胡杨不同发育阶段叶片光合作用的光响应曲线
Figure 1 The light response curve of leaves ofat different developmental stages.
成熟期胡杨卵圆形叶和披针形叶具有较低的P值, 这可能与其生长在植株冠层下部的空间分布有关。由于光照强度透过植物冠层时呈指数衰减变化, 因此, 位于空间分布的上部叶片(阔卵圆形叶)适应高光强条件, 而位于冠层下部的叶片(卵圆形叶和披针形叶)则适应相对较低的光照条件。这是胡杨成熟植株叶片光合作用从上至下依次降低的垂直空间变化的明显特征。胡杨幼苗期和幼树期的条形叶均具有与成熟期阔卵圆形叶几乎相同的P值, 这与胡杨叶片的比叶面积具有较大的关系, 通常比叶面积较高的植物其叶子的光捕获面积较高并由此导致较高的净光合速率[22], 这跟表1显示的结果相吻合。
2.3 叶片光合作用的光响应模拟
由于直角双曲线模型、非直角双曲线模型与指数模型均是一条没有极值的渐近线, 且无法估算最大净光合速率和饱和光强[1, 23, 24], 因此本文采用直角双曲线修正模型对胡杨不同形态叶片光合作用的光响应曲线进行拟合, 得到如图2所示的拟合结果。统计分析表明, 所有拟合方程系数(R2)均达到0.999以上(<0.01), 直角双曲线修正模型适于胡杨不同形态叶片的光合作用-光响应曲线。
由表3可知, 拟合的胡杨叶片的最大净光合速率(Pmax)与实测值较为接近, 其中不同形态叶片的Pmax变化依次为A6>A3>A1>A2>A5>A4, 表明成熟期胡杨阔卵圆形叶对干旱荒漠区高温和高光强环境的适应能力最强。胡杨个体生长发育进入成熟期后, 其阔卵圆形叶位于树冠上部, 长期生长在极端干旱的荒漠环境中, 逐渐形成了适应高温、强光的光合特征, 有利于其干物质积累和适应荒漠逆境, 为较高物质产量的形成奠定良好的生理基础; 而卵圆形叶和披针形叶由于长期处于遮阴状态, 表现出较低的量子效率()、光饱和点()、光补偿点()与呼吸速率(R), 导致其最大净光合速率(Pmax)最小, 光合效率最低。此外, 拟合的胡杨阔卵圆形叶最大净光合速率对应的光饱和点为2244.78 μmol·m-2·s-1, 而实测值只有2000 μmol·m-2·s-1, 说明胡杨阔卵圆形叶具有更高的光合潜力; 而卵圆形叶和披针形叶的拟合值均小于实测值, 说明这两种形态叶片的光合速率在光强为2000 μmol·m2·s-1时已经达到了饱和状态。
在低光强(≤200 μmol·m2·s-1)下, 叶片净光合速率(P)对光强()的响应曲线是评价植物光合特性的重要因素[25], 常采用表观量子效率来反映出植物对光能的利用效率[1, 24, 26]。但由于低光强条件下拟合植物叶片P与之间的关系时, 因拟合光合有效辐射的范围不同, 则据此计算出来的表观量子效率也不同[27]。因此, 表观量子效率并非描述植物利用光能的理想指标, 而采用植物在光补偿点处的量子效率()可以避免这个问题。因为植物的光补偿点()只有一个, 植物在光补偿点处的量子效率具有唯一性, 故可以用来表示植物叶片把光能转化为净能量的能力[1]。由表3可见, 胡杨不同形态叶片的量子效率大小排序为: A2> A6> A5> A4> A1> A3, 表明胡杨幼树期条形叶的光能利用率最高, 这与其所处位置及其有关。植物反映了植物对弱光的利用能力[28], 胡杨幼树期条形叶受上部叶片的遮光影响, 因而在一定程度上需要具有较强的弱光利用能力, 其实测的和R均较低, 这与表3中模型拟合的数据相一致。幼树期条形叶具有较低的及相对高的,使其具有较大的光能利用区间,这是其能在干旱荒漠环境中保持较高光合速率的原因; 而披针形叶也具有较高的Pmax, 可能归因于其具有较大的比叶面积(见表1), 同时由于该叶形分布于植株上部, 良好的光照使其具有较高的和R, 这是其适应较高光强的结果。
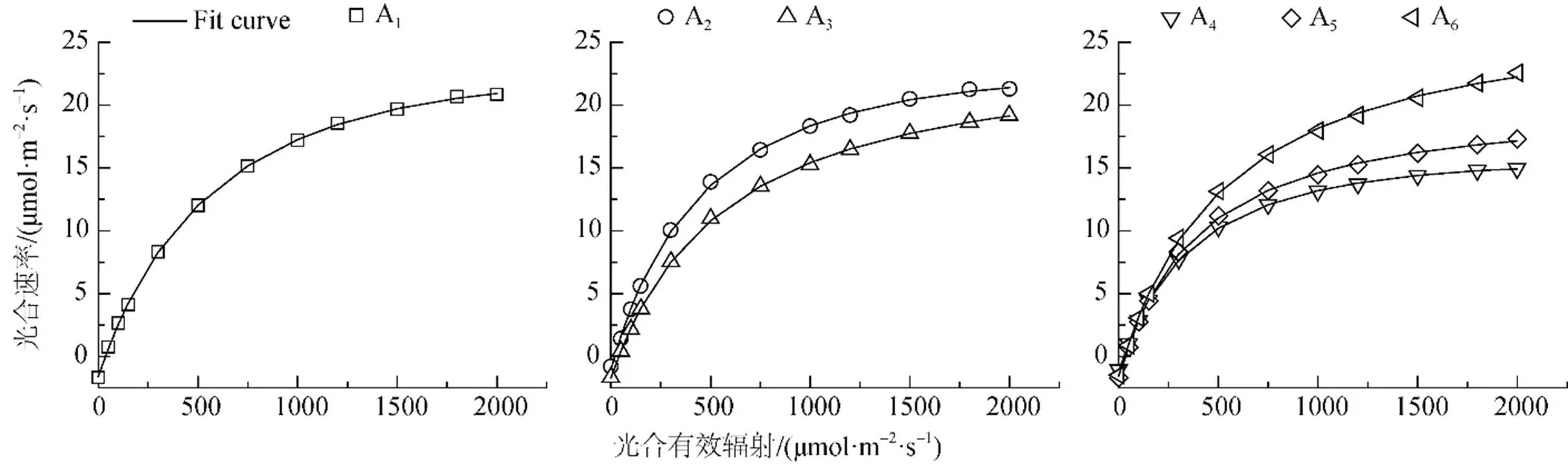
图2 胡杨不同发育阶段叶片光合作用-光响应的模拟
Figure 2 Simulation of photosynthetic-light response curves of leaves ofat different developmental stages.

表3 胡杨叶片光合作用-光响应特征参数实测值与模型拟合值比较
注: A1幼苗条形叶; A2幼树条形叶; A3幼树披针形叶; A4成树披针形叶; A5成树卵圆形叶; A6成树阔卵圆形叶; 实测值φc=AQYPAR≤50。
胡杨幼苗期条形叶具有较高的、、R和Pmax, 表明其具有耐高光强的能力[29], 这种叶形的光合能力与其比叶面积具有密切关系。比叶面积是植物碳收获策略的关键叶性状之一, 具有较高比叶面积的叶片光捕获面积较高, 具有较高的净光合速率[22]。在胡杨的幼苗生长期, 条形叶通过维持较高的光合速率积累光合产物, 使其在干旱荒漠环境中具有较高的生长量。这可能是胡杨不同形态叶片着生在树冠不同空间高度以及胡杨叶片从幼苗到成年叶形发生变化的原因, 这与王海珍等[27]的研究相一致。
3 讨论
植物光合作用受诸多环境因素的影响, 如光照强度、温度、CO2浓度和土壤水分等[30]。本研究中, 胡杨植株生长在同一生境中, 具有相同的空气湿度, 实际观测时的光强和CO2浓度保持一致, 因此本试验的结果具有可比性。光响应参数能较好的反映逆境条件下植物的光合潜能、光能利用率等[31], 应用直角双曲线修正模型对胡杨不同发育阶段6种不同形态叶片光合作用-光响应曲线的拟合结果表明, 胡杨叶片的P随的增强而增大; 当超过一定数值后,P将不再随着的增强而增加, 出现光饱和现象。3种不同树龄的胡杨各种形态叶片对强光环境的反应存在较大差异, 在较强的下, 成熟期阔卵圆形叶的P明显高于卵圆形叶和披针形叶, 表明阔卵圆形叶具有较高的光和效率, 该结果与相关胡杨叶片光合特性研究结果相似。
在植物叶片光合作用-光响应研究中,、、Pmax和是反映植物光响应特征的重要指标[26],其中与反映了植物对光照条件的要求与适应性强弱[18],、Pmax高低则是植物光能利用效率和光合能力强弱的表征[32]。胡杨成熟期阔卵圆形叶具有明显高于其他叶形的, 且和Pmax均较高, 表明胡杨阔卵圆形叶具有较高光合活性, 通过提高Pmax以增强光能利用率, 使其在干旱荒漠区高温、强光环境下仍能保持较高的光能转化效率与光合速率以及较宽的光能利用区间, 这为其干物质的积累、抗逆能力提高提供了良好的生理生态机制, 有益于胡杨在荒漠环境的生存和生长。
胡杨幼树期条形叶具有较低的、R和较高的、Pmax, 表明其能够迅速在弱光环境中达到较高的光合速率, 具有较宽的光能利用区间, 充足的物质积累有助于其适应恶劣的环境[33]; 这是其对不同光强做出的适应性反应和采取的生理适应机制, 这与胡杨从具有条形叶的幼苗成熟植物不同形态叶片发生变化具有密切的联系。
通过胡杨幼苗期条形叶光合特性和形态性状的分析可知, 其较高的光合速率归因于叶片具有较大的比叶面积。条形叶具有较低的与相对较高的、及Pmax, 很大程度上也归因于其较高的比叶面积, 高效的光捕获面积使其具有较高的净光合速率[34], 通过积累光合产物, 使胡杨在极端逆境下得以生存并能达到较高的生长量[14]。
通过采用直角双曲线修正模型对胡杨叶片光合作用-光响应曲线进行拟合, 结果显示, 其中胡杨叶片的Pmax、与实测结果基本上一致;明显低于实测结果; 胡杨不同形态叶片光合作用-光响应曲线的拟合方程系数(2)均达到0.9995以上(<0.01), 说明直角双曲线修正模型适于胡杨不同形态叶片光合生理参数的定量研究。
[1] 叶子飘. 光合作用对光和CO2响应模型的研究进展 [J]. 植物生态学报, 2010, 34(6): 727–40.
[2] ELFADL M A, LUUKKANEN O. Field studies on the ecological strategies ofin a dryland ecosystem: 1. A leaf gas exchange approach [J]. Journal of Arid Environments, 2006, 66(1): 1–15.
[3] SHARP R E, MATTHEWS M A, BOYER J S. Kok effect and the quantum yield of photosynthesis. Plant Physiology, 75, 95-101 [J]. 1984, 75(1): 95–101.
[4] 叶子飘, 于强. 光合作用光响应模型的比较 [J]. 植物生态学报, 2008, 32(6): 1356–61.
[5] SOCIETY T R. The Kinetics of Photosynthesis [J]. Proceedings of the Royal Society of London, 1935, 149(868): 596–596.
[6] THORNLEY J H M. Mathematical models in plant physiology [J]. Mathematical Models in Plant Physiology, 1976,10(2):112–112
[7] BASSMAN J H, ZWIER J C. Gas exchange characteristics of,and[J]. Tree Physiology, 1991, 8(2): 145.
[8] PRADO C H, MORAES J A P V D. Photosynthetic capacity and specific leaf mass in twenty woody species of Cerrado vegetation under field conditions [J]. Photosynthetica, 1997, 33(1): 103–12.
[9] 叶子飘, 于强. 一个光合作用光响应新模型与传统模型的比较 [J]. 沈阳农业大学学报, 2007, 38(6): 771–5.
[10] TUZET A, PERRIER A, LEUNING R. A coupled model of stomatal conductance, photosynthesis and transpiration [J]. Plant Cell & Environment, 2003, 26(7): 1097–116.
[11] XIA J B, ZHANG G C, WANG R R, et al. Effect of soil water availability on photosynthesis in Ziziphus jujuba var. spinosus in a sand habitat formed from seashells: Comparison of four models [J]. Photosynthetica, 2014, 52(2): 253–61.
[12] LANG Y, WANG M, ZHANG G C, et al. Experimental and simulated light responses of photosynthesis in leaves of three tree species under different soil water conditions [J]. Photosynthetica, 2013, 51(3): 370–8.
[13] 吴芹, 张光灿, 裴斌, 等. 不同土壤水分下山杏光合作用CO2响应过程及其模拟 [J]. 应用生态学报, 2013, 31(6): 4499–508.
[14] 苏培玺, 张立新, 杜明武, 等. 胡杨不同叶形光合特性、水分利用效率及其对加富CO2的响应 [J]. 植物生态学报, 2003, 27(1): 34–40.
[15] 白雪, 张淑静, 郑彩霞, 等. 胡杨多态叶光合和水分生理的比较 [J]. 北京林业大学学报, 2011, 33(6): 47–52.
[16] MA H C, FUNG L, WANG S S, et al. Photosynthetic response of Populus euphratica to salt stress. Forest Ecol Manag [J]. Forest Ecology & Management, 1997, 93(1): 55–61.
[17] WANG H L, YANG S D, ZHANG C L. The photosynthetic characteristics of differently shaped leaves in Populus euphratica Olivier [J]. Photosynthetica, 1998, 34(4): 545–53.
[18] XIONG R, LI X, ZHANG X, et al. The studies about the photosynthetic response of the four desert plants [J]. Acta Ecologica Sinica, 2003, 23(3): 598–605.
[19] 王海珍, 韩路, 徐雅丽, 等. 胡杨异形叶叶绿素荧光特性对高温的响应 [J]. 生态学报, 2011, 31(9): 2444– 53.
[20] 叶子飘. 光合作用对光响应新模型及其应用 [J]. 生物数学学报, 2008, 23(4): 710–6.
[21] LOBO F D A, BARROS M P D, DALMAGRO H J, et al. Fitting net photosynthetic light-response curves with Microsoft Excel — a critical look at the models [J]. Photosynthetica, 2014, 52(3): 479–80.
[22] ZHANG L, LUO T. Advances in ecological studies on leaf lifespan and associated leaf traits [J]. Acta Phytoecol Sinica, 2004, 28(6): 844–52.
[23] YE Z P, YU Q, KANG H J. Evaluation of photosynthetic electron flow using simultaneous measurements of gas exchange and chlorophyll fluorescence under photorespiratory conditions [J]. Photosynthetica, 2012, 50(3): 472–6.
[24] 王荣荣, 夏江宝, 杨吉华, 等. 贝壳砂生境干旱胁迫下杠柳叶片光合光响应模型比较 [J]. 植物生态学报, 2013, 37(2): 111–21.
[25] OLSSON T, LEVERENZ J W. Non‐uniform stomatal closure and the apparent convexity of the photosynthetic photon flux density response curve [J]. Plant Cell & Environment, 1994, 17(6): 701–10.
[26] XIA J B. Critical responses of photosynthetic efficiency in Campsis radicans (L.) Seem to soil water and light intensities [J]. African Journal of Biotechnology, 2011, 10(77): 17748–54.
[27] 王海珍, 韩路, 徐雅丽, 等. 胡杨异形叶光合作用对光强与CO2浓度的响应 [J]. 植物生态学报, 2014, 38(10): 1099–109.
[28] SUN C X, QI H, HAO J J, et al. Single leaves photosynthetic characteristics of two insect-resistant transgenic cotton () varieties in response to light [J]. Photosynthetica, 2009, 47(3): 399–408.
[29] TARTACHNYK I I, BLANKE M M. Effect of delayed fruit harvest on photosynthesis, transpiration and nutrient remobilization of apple leaves [J]. New Phytologist, 2004, 164 (3): 441–50.
[30] SOFO A, DICHIO B, MONTANARO G, et al. Photosy
nthetic performance and light response of two olive cultivars under different water and light regimes [J]. Photosynthetica, 2009, 47(4): 602–8.
[31] 张彦敏, 周广胜. 植物叶片最大羧化速率及其对环境因子响应的研究进展[J]. 生态学报, 2012, 32(18): 5907–17.
[32] KRAUSE G H. Photoinhibition of photosynthesis. An evaluation of damaging and protective mechanisms [J]. Physiologia Plantarum, 1988, 74(3): 566–74.
[33] BRODRIBB T, HILL R S. Light Response Characteristics of a Morphologically Diverse Group of Southern Hemisphere Conifers as Measured by Chlorophyll Fluorescence [J]. Oecologia, 1997, 110(1): 10–7.
[34] 姜卫兵, 庄猛, 韩浩章, 等. 彩叶植物呈色机理及光合特性研究进展 [J]. 园艺学报, 2005, 32(2): 352–8.
Leaf photosynthesis and light response characteristics ofin different developmental stages
SHAN Lingfei, DING Yinghui, WANG Shuanglei, ZHANG Moshi, HAN Hang, SHI Sha, FENG Jinchao*
College of Life and Environmental Sciences, Minzu University of China, Beijing 100081, China
is the tertiary relic plant with various forms of leaves at different stages of individual development. It is very important to study on the drought resistance and salt tolerance of, which is the major dominant species of oasis ecosystem in Ejina area, Inner Mongolia. It was analyzed for the leaf morphological characteristics, photosynthesis and light response process ofat different developmental stages. The results showed that the ratio of length to width, specific leaf area and leaf thickness ofdecreased from seedling stage, young tree stage to mature tree stage, while the leaf dry matter content, leaf area and leaf dry weight increased. The higher photosynthetic efficiency and photosynthetic activity of broad oval leaves ofat mature stage were maintained to increase photosynthetic rate under desert environment of high temperature and strong light. The higher photosynthetic rate of strip leaves at young tree stage was related to wider range of light energy utilization under weak light environment. The higher photosynthetic rate of strip leaves at young seedling stage was maintained due to higher specific leaf area and light capture, while light compensation point (LCP) and light saturation point (LSP) were also higher. The above results provided the base of adaptive responses and eco-physiological mechanisms ofunder different light environments. It was proved that the modified model of rectangular hyperbola was suitable for quantitative study of photosynthetic physiological parameters of different leaves of.
; leaf morphology; photosynthesis; light response; modified model of rectangular hyperbola.
10.14108/j.cnki.1008-8873.2019.06.004
Q14
A
1008-8873(2019)06-022-08
2018-10-30;
2019-03-03
国家自然科学基金项目(31570407); 中央民族大学协同创新中心项目(MUC2011-3)
单凌飞(1991—), 男, 河南郑州人, 中央民族大学生命与环境科学学院硕士研究生, 研究方向为植物生态学, E-mail: shanlingfei@muc.edu.cn
冯金朝(1964—), 男, 博士, 教授, 主要从事植物生态生理学研究, E-mail:fengjinchao@muc.edu.cn
单凌飞, 丁颖慧, 王双蕾, 等. 胡杨不同发育阶段叶片光合作用及其光响应特征[J]. 生态科学, 2019, 38(6): 22-29.
SHAN Lingfei, DING Yinghui, WANG Shuanglei, et al. Leaf photosynthesis and light response characteristics ofin different developmental stages[J]. Ecological Science, 2019, 38(6): 22-29.
