宣威火腿中抗菌肽的分离、纯化及鉴定
2019-12-23邢路娟曹松敏郑锦晓周光宏张万刚
邢路娟,曹松敏,郑锦晓,周光宏,张万刚
(南京农业大学 食品科技学院/肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
抗菌肽是一类对抗外源性病原体的小分子肽类物质,结构一般由10~50个氨基酸组成。天然抗菌肽具有安全性高、耐药性强、来源广泛等优点[1],因而逐步成为开发新型抗菌剂的研究方向。截至2019年,已有8 000多种抗菌肽被鉴定发现,其中约有2 000多种抗菌肽从天然产物中提取得到[2]。目前,已发现的抗菌肽来源以鱼类、昆虫类抗菌肽居多,而抗菌肽在肉制品中的研究涉及较少。Stadnik等[3]通过体外抑菌实验,证实了猪肉和牛肉蛋白中分离得到的功能性肽具有一定的抑菌作用。Castellano等[4]对西班牙干腌火腿粗多肽进行分离并测定其抑制李斯特菌生长的能力,得到了具有较好抑菌能力的肽段RHGYM。
宣威火腿作为中国三大传统干腌火腿之一,具有丰富的营养价值。在长时间的成熟过程中,宣威火腿中的蛋白质发生内源酶降解反应,进而产生丰富的肽类、氨基酸及含硫化物等成分[5]。研究表明,干腌火腿中存在的多肽具有抗氧化、降血压、抑菌等活性。Zhu等[6]研究发现金华火腿多肽中的GKFNV起主要抗氧化作用。Xing等[7]在宣威火腿中发现粗多肽具有较高的抗氧化活性,并鉴定出具有较高抗氧化活性的序列DLEE。为了从抑菌活性方面评价干腌火腿中多肽的功能特性,本实验选取O157型大肠杆菌和单增李斯特菌两种常见的食品类研究检测菌种为研究对象,重点探究宣威火腿粗多肽的抑菌能力,并对部分具有较高抑菌活性的多肽进行序列的验证和鉴定,从而为阐释火腿多肽在抑菌方面的功能奠定基础。
1 材料与方法
1.1 材料与试剂
宣威火腿,云南省宣威市浦记火腿食品有限公司;O157型大肠杆菌(No.21530)、单增李斯特菌(ATCC19115)(No.21635),中国微生物菌种保藏管理中心。PI及SYTO-9荧光染料,Sigma公司;邻苯二甲醛、β-巯基乙醇、硼砂、乙醇、氢氧化钠、盐酸、磷酸二氢钠和磷酸氢二钠,国药集团化学试剂公司;平板计数培养基及结晶紫中性红胆盐琼脂(VRBA)等培养基,北京陆桥技术有限公司。
1.2 仪器与设备
Bioscreen C FP1100- C型全自动细菌生长记录仪,芬兰Bioscreen公司;Scan1200型自动影像分析菌落计数器,法国Interscience公司;AKTA Purifier UOC10型蛋白纯化系统,瑞典 GE Healthcare公司;ES2030型冷冻干燥机,日本 Hitachi公司;Spectral Max M2e型多功能酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1粗多肽粉的提取
参照王娟等[8]的方法并稍作修改。取成熟火腿股二头肌25 g,绞碎后放入离心瓶,加入100 mL磷酸盐缓冲溶液(pH值7.2),匀浆(2 2000 r/min)3次,每次10 s。在4 ℃条件下静置2 h后离心(4 ℃、8 000 r/min)20 min,吸取上清液,加入3倍体积的乙醇(体积分数 40%),静置12 h。再次离心(4 ℃、8 000 r/min)20 min。冷冻干燥并于-20 ℃冰箱中冷藏备用。
1.3.2抑菌率测定
参考张顺亮等[9]的研究方法,测定粗多肽对O157型大肠杆菌和单增李斯特菌的抑菌活性,以抑菌率表示。将大肠杆菌和李斯特菌培养至对数生长期并用无菌生理盐水进行稀释,调整浓度分别为1.0×106、1.0×105CFU/mL。按照体积比1∶4,吸取细菌培养液500 μL与2 mL多肽溶液(0.22 μm滤膜过滤)混合后加入实验管中,以无菌磷酸盐缓冲溶液为对照,同时振荡培养1 h(37 ℃,150 r/min)后对菌液进行梯度稀释,取100 μL涂布于计数平板上,37 ℃培养24 h,记录菌落总数。抑菌率计算见式(1)。
抑菌率=(N0-N1)/N0×100%。
(1)
式(1)中:N0为对照管细菌菌落总数,N1为实验管细菌菌落总数。
1.3.3阴离子交换色谱分离宣威火腿抗菌肽
采用20 mmol/L磷酸盐缓冲溶液(pH值8.0)平衡HiPrep Q FF 16/10强离子交换柱(1.6 cm×10 cm),流速2.0 mL/min。将宣威火腿粗多肽溶解在磷酸盐缓冲溶液(pH值 8.0)中,配制成5.0 mg/mL的溶液,并经过滤膜(0.45 μm)过滤后上样(2.0 mL)。洗脱液A为磷酸盐缓冲溶液(20 mmol/L,pH值8.0);洗脱液B为含1 mol/L NaCl 的磷酸盐缓冲溶液(20 mmol/L,pH值 8.0),按浓度梯度洗脱;洗脱流程为0~60 min,0~100%A,100~0%B,流速2.0 mL/min,检测波长280 nm。分别收集每个洗脱分离出来的峰组分,冷冻干燥后进行抑菌能力测定。
1.3.4尺寸排阻色谱纯化宣威火腿抗菌肽
对经阴离子色谱洗脱后获得的具有较强抑菌活性的组分进行尺寸排阻色谱纯化。首先用去离子水平衡凝胶色谱柱(5 cm×60 cm),柱料填充采用葡聚糖凝胶Sephadex G-25,流速为2.0 mL/min。将待纯化组分溶解于去离子水中,配置成5.0 mg/mL的溶液,用0.45 μm的滤膜过滤后进样,上样量为2.0 mL。采用超纯水作为洗脱液,流速设置为2.0 mL/min,检测波长为280 nm。多次洗脱,分别收集洗脱后的各个组分,冷冻干燥后进行质谱鉴定。
1.3.5Nano-LC-ESI-MS/MS鉴定肽序列
参考Pinkse等[10]方法,用Nano-LC-ESI-MS/MS液质联用设备分离并鉴定多肽组成。HPLC条件:Aligent C18色谱柱(75 μm×8 cm,3 μm,300);流动相A组成为97.5%超纯水、2%乙腈、0.5%甲酸;流动相B组成为9.5%超纯水、90%乙腈、0.5%甲酸;梯度洗脱条件为0~60 min,98%~10% A,2%~90% B;流速800 nL/min,上样量3 μL。
ESI-MS/MS质谱条件:HPLC在线与电喷雾质谱(ESI)串联,即样品经HPLC洗脱后通过电喷雾离子化方法电离,并直接进入质谱仪。电离电压范围1.2~1.8 kV,每次使用需经优化确认;毛细管温度设定为110 ℃;质谱仪模式选用动态数据依赖模式(data-dependent mode),通过低能碰撞诱导解离(collision induced dissociation,CID)获取二级质谱数据。显微扫描质量范围为550~1 800 amu;默认碰撞能力为33%;动态排除功能设置为0.3 min内重复计数,排除时间为0.4 min,排除宽度为4 Da。
1.3.6合成抗菌肽的抑菌能力测定
已知氨基酸序列的多肽由苏州强耀生物科技有限公司合成,随后进行合成肽抑制大肠杆菌和李斯特菌能力的验证,实验方法同1.3.2节。
1.4 数据处理
实验结果用平均值±标准差表示。方差分析采用SAS 8.0中one-way ANOVA分析,通过Duncan’s multiple-range test比较单个均值之间的差异性(P<0.05),实验重复6次。
2 结果与讨论
2.1 宣威火腿粗多肽的抑菌活性分析
使用宣威火腿粗多肽进行O157型大肠杆菌和单增李斯特菌的生长抑制实验,结果如图1。宣威火腿多肽对O157型大肠杆菌和单增李斯特菌的抑制能力随着多肽质量浓度的增加而增强。在4.0 mg/mL的质量浓度下,宣威火腿多肽对O157型大肠杆菌的抑制作用达到96%;对单增李斯特菌的抑菌实验中,当质量浓度为4.0 mg/mL时,抑制效果仅为53%。单增李斯特菌是典型的革兰氏阳性菌,其细胞壁较大肠杆菌厚,抗菌肽很难破坏;而O157型大肠杆菌的肽聚糖层较薄,抗菌肽较易改变其通透性,从而赋予火腿粗多肽抑制细菌生长的能力。
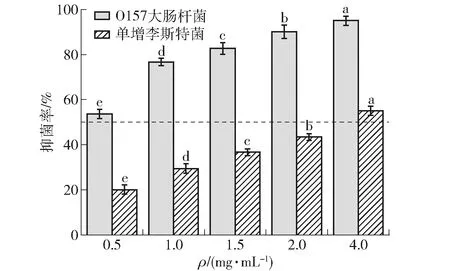
不同小写字母表示同一菌种的抑菌率在不同质量浓度时差异显著(P<0.05)。图1 宣威火腿粗多肽对O157型大肠杆菌和单增李斯特菌的抑制作用Fig.1 Effect of Xuanwei ham peptides on inhibition of E.Coli O157 and L.monocytogenes
2.2 宣威火腿粗多肽提取物离子交换色谱分离分析
根据带电荷种类、数量及分布的不同,离子交换色谱可以将混合组分进行逐级分离,其主要特点是填料中的带电荷树脂可以与样品中的带电离子进行可逆交换,从而实现不同电荷样品的逐级分离[11]。本研究采用了HiPrep Q FF 16/10强阴离子交换色谱,当流动相按离子强度由弱到强洗脱时,由于不能与固定相结合,因此净电荷为负或中性的组分最先被洗脱出来,随后各组分按所带正电荷由弱到强的顺序依次被洗脱出来。宣威火腿粗多肽提取物经离子交换色谱分离得到7个组分(见图2)。收集各组分并分别使用0.5、1.0 mg/mL的质量浓度测定其对大肠杆菌及单增李斯特菌的抑制能力(见图3)。经离子交换色谱分离得到的7个组分中的组分1和组分2未检测出对两菌种的抑制活性,而组分3~7对O157型大肠杆菌和单增李斯特菌的抑制活性呈现一定差异,其中组分7具有较高的抑菌活性,对大肠杆菌和李斯特菌的抑菌率分别为98%和56%,显著高于其他组分(P<0.05)。组分3~5对大肠杆菌的抑制活性没有显著差异(P>0.05),且抑制率均在70%以上;而对于单增李斯特菌的抑制活性差异显著,其中组分4和6的活性均在40%左右,显著高于组分3和5(P<0.05)。由于各组分是通过电荷差异分离的,可知宣威火腿中的抗菌肽活性与其所带的电荷种类及强弱存在一定的关系[12],最后洗脱得到的组分带正电荷、极性最强,是典型的阳离子肽,且抑菌活性最强。其他组分抑菌率较低,可知净电荷为负且电荷强度较弱的组分抑菌能力也较弱。由于组分7抑菌活性最强,因而进行重复收集,从而进行下一步凝胶层析纯化。
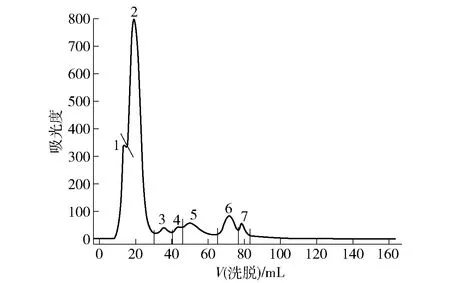
1~7为分离得到的多肽组分。图2 宣威火腿粗多肽提取物的离子交换色谱Fig.2 Ion exchange chromatography of peptides extracted from Xuanwei ham

ρ(大肠杆菌)=0.5 mg/mL,ρ(李斯特菌)=1.0 mg/mL;不同小写字母表示同一菌种的抑菌率在不同质量浓度时差异显著(P<0.05)。图3 离子交换色谱分离得到各组分对O157型大肠杆菌和单增李斯特菌的抑菌能力Fig.3 Effect of fractions isolated by ion exchange chromatography on inhibition of E.coli O157 and L.monocytogenes
2.3 宣威火腿粗多肽提取物尺寸排阻色谱纯化分析
尺寸排阻色谱又称分子筛凝胶层析,洗脱原理是根据样品中各组分的分子质量大小进行逐级分离[13]。在流动相选择方面,凝胶层析通常使用超纯水作为流动相来进行洗脱,避免混入新的盐物质。本实验使用的是G-25的葡聚糖凝胶柱,可分离小分子蛋白质及多肽类物质[14]。将离子交换色谱收集得到的组分7进行G-25凝胶色谱分析,见图4。由图4可知,组分7经过尺寸排阻色谱洗脱后只得到一个主要峰,说明该成分中的多肽具有相近的分子质量。从电导率曲线变化可知,组分7中的多肽与盐分完全分离,从而起到纯化多肽及脱盐的效果。
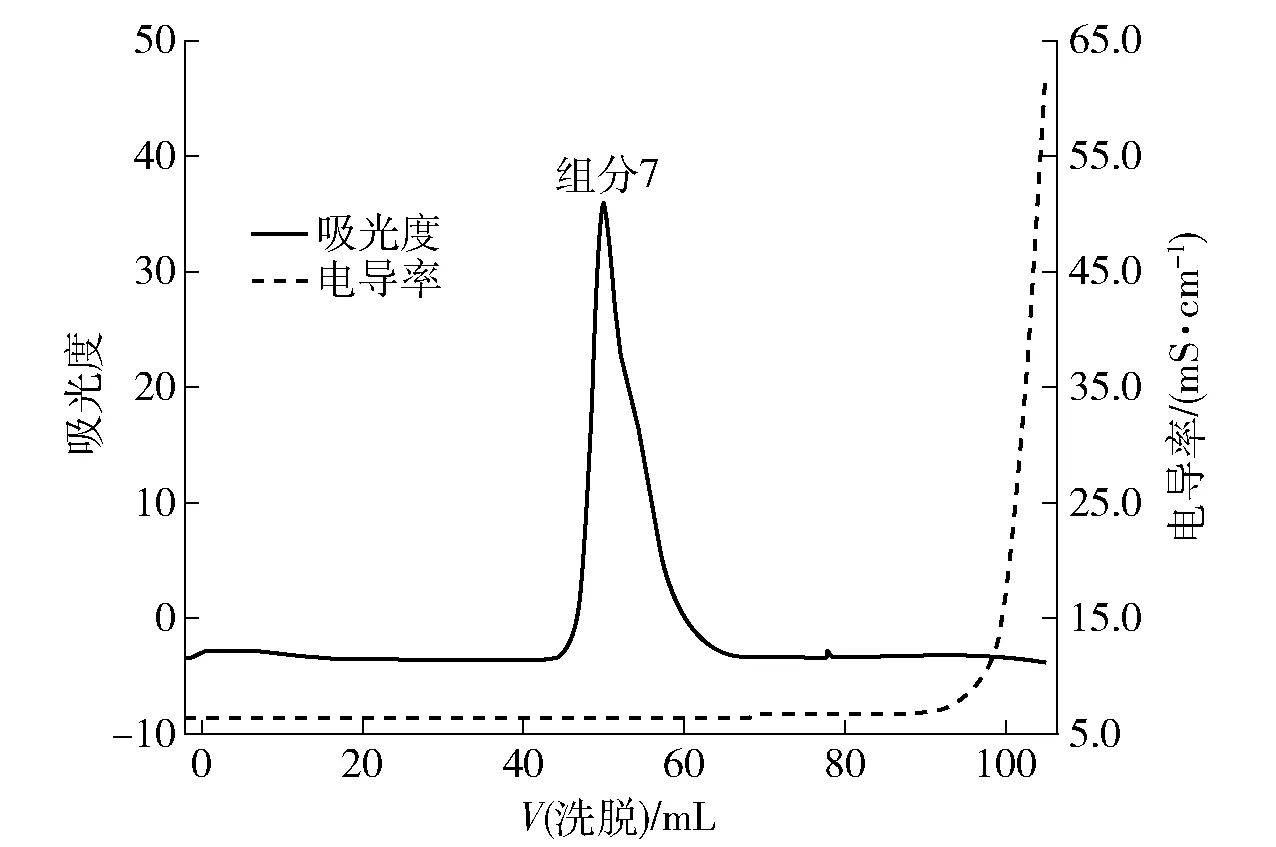
图4 宣威火腿粗多肽提取物组分7的尺寸排阻色谱Fig.4 Size exclusion chromatography of 7th fraction extracted from Xuanwei ham
2.4 Nano-LC-ESI-MS/MS肽序列鉴定分析
抗菌肽的分子结构与分子质量大小是影响其自身抑菌活性的最重要因素。抗菌肽的分子质量大多分布于1 000~4 000 Da之间,其较长的肽链可形成特定的二级结构,从而有助于抑菌功能的发挥[15]。Wang 等[16]对525种抗菌肽分析发现,97%的抗菌肽由少于50个的氨基酸残基组成,平均长度为18个氨基酸残基,部分抗菌活性较高的多肽序列少于3个氨基酸。从林蛙中分离提纯的抗菌肽(BLPs)由25~27个氨基酸组成,具有较强的疏水性[17]。Ponti等[18]研究蛙属中的抗菌肽,并从中鉴定出由24~34个氨基酸组成的活性成分。周义文等[19]研究发现纯化后的家蝇抗菌肽对大肠埃希氏菌和金黄色葡萄球菌具有较好的抑制作用,用Nano-ESI-Q-TOF2-MS/MS测定氨基酸序列,得到2条抗菌肽的氨基酸序列为YDLLNVDEEVRFR和YDNVNLDELLNSDR。为了进一步确定宣威火腿中抗菌肽的组成,本实验选取质谱鉴定手段,将纯化得到的多肽进行氨基酸测序分析(见表1)。组分7经过质谱鉴定后得到了QYYNGEEHVRFDSDVGEYR、LRNLPNLEVLDLGTNFI、FASFEAQGALANIAVDK多肽序列。肽段的分子质量均在2 500 Da以下,二级质谱见图5至图7。
图5 肽段QYYNGEEHVRFDSDVGEYR的二级质谱Fig.5 MS/MS spectrum of peptide fraction QKKNGEEHVRFDSDVGEYR
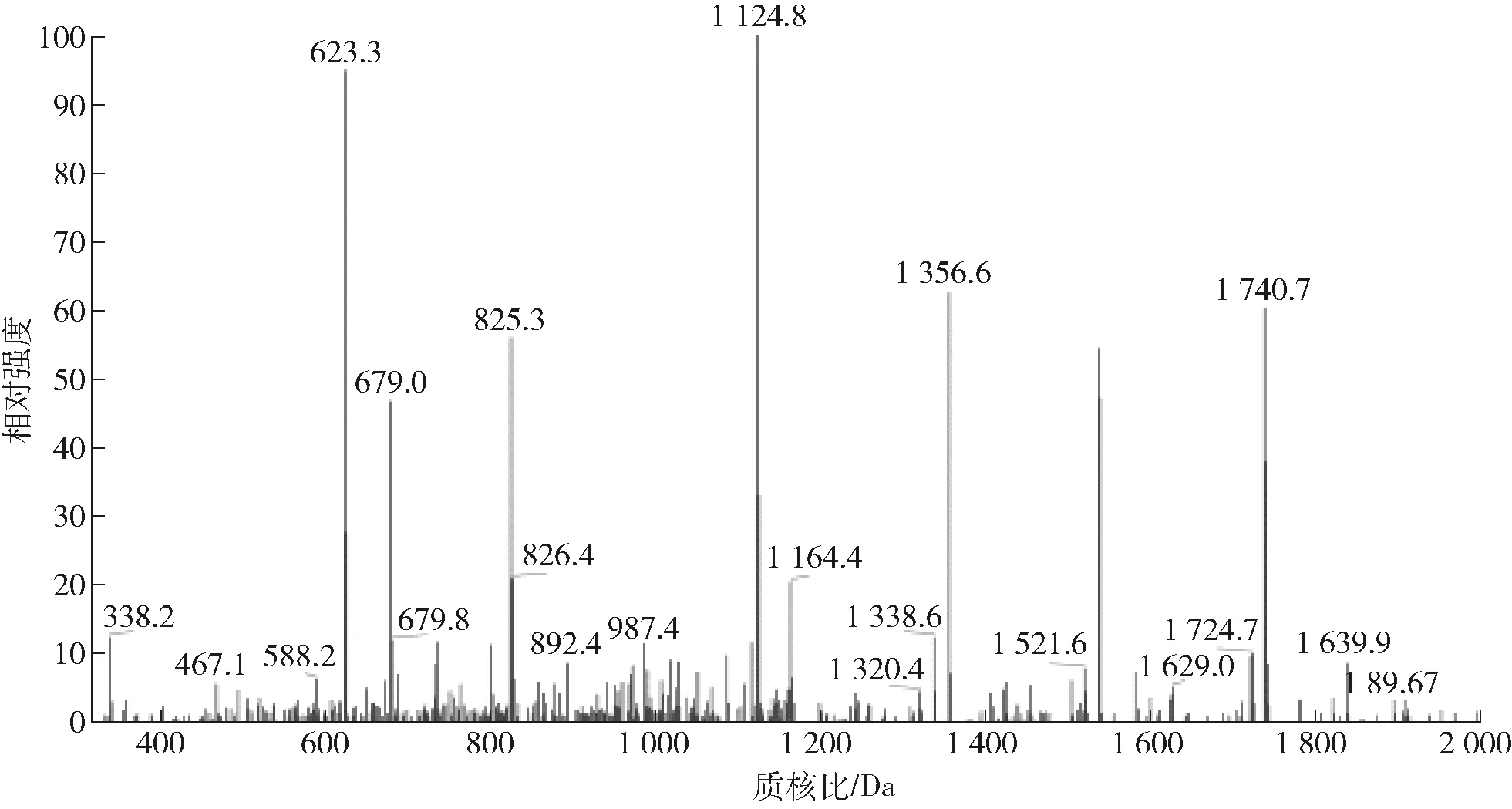
图6 肽段LRNLPNLEVLDLGTNFI的二级质谱Fig.6 MS/MS spectrum of peptide fraction LRNLPNLEVLDLGTNFI

图7 肽段FASFEAQGALANIAVDK的二级质谱Fig.7 MS/MS spectrum of peptide fraction FASFEAQGALANIAVDK

表1 组分7的肽序列液相色谱- 质谱联用鉴定结果Tab.1 Peptide sequences identification of 7th fraction by LC-MS/MS
2.5 合成肽的抗菌活性验证
表2列出了3条合成抗菌肽抑制大肠杆菌和李斯特菌的情况。3条合成抗菌肽均具有较好的抑菌能力,对O157型大肠杆菌的抑菌率达90%以上,且没有显著差异(P>0.05)。在抑制单增李斯特菌的能力上,3条合成抗菌肽中QYYNGEEHVRFDSDVGEYR的抑菌率超过50%,显著高于其他2条肽段(P<0.05)。根据抗菌肽的构效关系可知,在一级结构的基础上,抗菌肽一般富含Lys、Arg、Trp和Gly等特定氨基酸,疏水性氨基酸同样对抑菌活性有影响[20]。对比本实验得到的3条肽段可知,QYYNGEEHVRFDSDVGEYR比其他2条肽段含有更多的Lys、Arg、Trp和Gly,这也可能是引起抑制李斯特菌能力显著高于其他2条肽段的原因。

表2 合成肽的抗菌活性测定结果Tab.2 Antibacterial activity of synthetic peptides
不同小写字母表示同列数据之间差异显著(P<0.05)。
3 结 论
研究通过离子交换色谱、尺寸排阻色谱对宣威火腿粗多肽提取物按照所带电荷特征不同、分子质量大小不同进行分离,分离得到的各个组分又具有不同的抑菌活性,其中组分7活性最强,对大肠杆菌和李斯特菌的抑菌率分别为98%和56%。经过Nano-LC-ESI-MS/MS肽序列鉴定,得到活性最强的3条阳离子肽。通过合成并验证其活性,可知QYYNGEEHVRFDSDVGEYR、LRNLPNLEVLDLGTNFI、FASFEAQGALANIAVDK均具有较强的抑制O157型大肠杆菌和单增李斯特菌的能力,且抑制O157型大肠杆菌的能力优于单增李斯特菌。以上研究说明在宣威火腿中存在具有抗菌活性的多肽,且经过逐步分离得到了具有已知序列的多肽成分,进一步证实了干腌火腿多肽的功能性,从而为开发抗菌肽及其相关研究奠定了基础。
