一种半导体聚合物纳米粒的制备及其光声成像效果分析
2019-12-23胡敏霞赵汉学
刘 娟 胡敏霞 任 伟 马 腾 朱 强 赵汉学
(首都医科大学附属北京同仁医院超声诊断科,北京 100730)
光声成像是一种新型成像技术,它将光学成像和超声成像的优点有机结合,使得此种成像模式既具有较高的空间分辨率,又具有探查深部组织的能力[1]。还可通过发展光声纳米探针,在活体组织层面对疾病的病理过程实现分子水平定性、定量研究,从而为目标疾病的早期诊断提供技术支撑[2-3]。光声成像需借助内源性分子(血红蛋白、黑色素)或外源性(有机染料、荧光蛋白、无机纳米粒、碳纳米管、卟啉等)生色团实现其成像。有机染料、荧光蛋白、金属纳米粒子存在耐光性不佳等缺点[4],而卟啉类则有光毒性缺点[5]。半导体聚合物纳米粒因其优异的光学特性,兼有较好的生物相容性,是一种较为理想的光声成像材料[6]。因此,本研究欲制备一种半导体聚合物纳米粒,对其表征及安全性进行评价,并初步评价其光声成像效果。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验材料
二棕榈酸磷脂酰胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine, DPPC)购自美国Sigma-Aldrich公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000{1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000], DSPE-PEG2000}, 购自美国Avanti Lipids公司;2,6-[4,4-双-(2-乙基己基)-4H-环戊(2,1-b;3,4-b’)双噻吩]-交替-4,7-(2,1,3-苯并噻二唑) [poly(cyclopentadithiophene-alt-benzothiadiazole),PCPDTBT]购自美国Sigma-Aldrich公司;4,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole dihydrochloride, DAPI)购自美国Sigma-Aldrich公司;BALB/c雌性裸鼠,体质量为18~22 g,购自天津医科大学实验动物中心;人宫颈癌HeLa细胞、小鼠乳腺癌4T1细胞购自中国科学院上海细胞生物学研究所;Celltiter 96©Aqueous 单溶液细胞增生检测试剂盒购自美国Promega公司;DMEM培养基购自美国Gibco公司。
1.1.2 实验仪器
W-150声振仪购自美国Branson公司;LSM710激光扫描共聚焦显微镜(confocal laser scanning microscopy, CLSM)购自德国CarlZeiss公司;高速冷冻离心机购自德国Eppendorf公司;Nano-ZS90粒度分析仪购自英国Malven公司;IVIS活体成像仪购自美国CRI公司;酶标仪购自瑞士Tecan公司;光声成像仪2100高分辨率成像系统购自加拿大Visualsonics公司)。
1.2 实验方法
1.2.1 纳米粒子制备
①将0.3 mg的PCPDTBT聚合物溶解在1 mL的四氢呋喃(tetrahydrofuran,THF)中,将此溶液快速加入9 mL的去离子水中,使用输出功率为6 W的声振仪连续振动30 s。②将1 mg的DPPC、20 mg的DSPE-PEG2000加入4 mL THF和去离子水的溶液中(1.6 mL THF和2.4 mL去离子水)。③将步骤①制备的溶液与步骤②制备的溶液快速混合,声振仪振动1 min,溶液中THF置于45 ℃氮气环境下蒸发,使用0.22 μm过滤膜过滤,PBS洗3次,4 000 r/min冷冻离心机离心,最终制备浓度为0.1 mg/mL的SPNs混悬液,置于4 ℃贮存间保存待用。
1.2.2 SPNs的表征
室温下取适量的SPNs混悬液,用去离子水将其质量浓度稀释至10 μg/mL,使用粒径分析仪分析样品的平均粒径及其分布。使用透射电镜观察其形貌。将SPNs重悬于0.9%(质量分数)氯化钠注射液中,在4 ℃条件下搅拌孵育,分别于第1、2、3、4、5、6 d取样测量SPNs粒径大小,观察其稳定性。
1.2.3 体外细胞毒性实验
接种HeLa细胞在含有DMEM细胞培养基的96孔板中,依次加入质量浓度为5、10、20、30 μg/mL SPNs混悬液孵育24 h,随后加入20 μL的MTS,再孵育3 h,吸出培养基,加入150 μL二甲基亚砜溶解已形成的沉淀,利用酶标仪测定各孔在550nm处的吸光度,并计算细胞相对活力。
1.2.4 体外细胞吞噬实验
将Hela细胞接种于培养皿中,待肿瘤细胞生长良好时,加入适量的SPNs继续培养24 h,使用4%(质量分数)的多聚甲醛固定15 min,随后用PBS洗涤细胞3次,用10 μg/mL的DAPI染色10 min,使用CLSM观察HeLa细胞吞噬SNPs情况。
1.2.5 体外IVIS近红外荧光成像
将所制备的SPNs配制成2.5、5、10、20、30、60 μg/mL浓度梯度的混悬液,各取100 μL置于96孔板中,以PBS作为对照组,将其置于小动物活体成像仪IVIS中,使用激发波长680 nm、发射波长840 nm成像,获得光谱图。
1.2.6 荷瘤裸鼠光声成像
6只4T1荷瘤裸鼠采用数字表法随机分为两组,成像前使用2%(体积分数)的异氟醚麻醉,一组(n=3)经尾静脉注入120 μL的0.9%(质量分数)氯化钠注射液[7],另一组(n=3)注入120 μL含30 μg SPNs混悬液,裸鼠被置于光声成像平台,肿瘤处涂布耦合剂,超声探头置于肿瘤表面,启动扫描装置,用680 nm激光辐照,获取裸鼠4T1肿瘤光声图和数据。
1.3 统计学方法
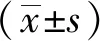
2 结果
2.1 SPNs的表征及稳定性观察
所制备的SPNs为浅蓝色混悬液,透射电镜下SPNs呈球形(图1),大小均一、分散性好。粒度分析仪测得其平均粒径为(61±3)nm,平均电位为(-38±2)mV。通过6 d时间的观察,SNPs粒径大小没有显著变化,说明所制备的SPNs性能稳定(图2)。

图1 SPNs的透射电镜图Fig.1 Transmission electron microscope image of SPNs
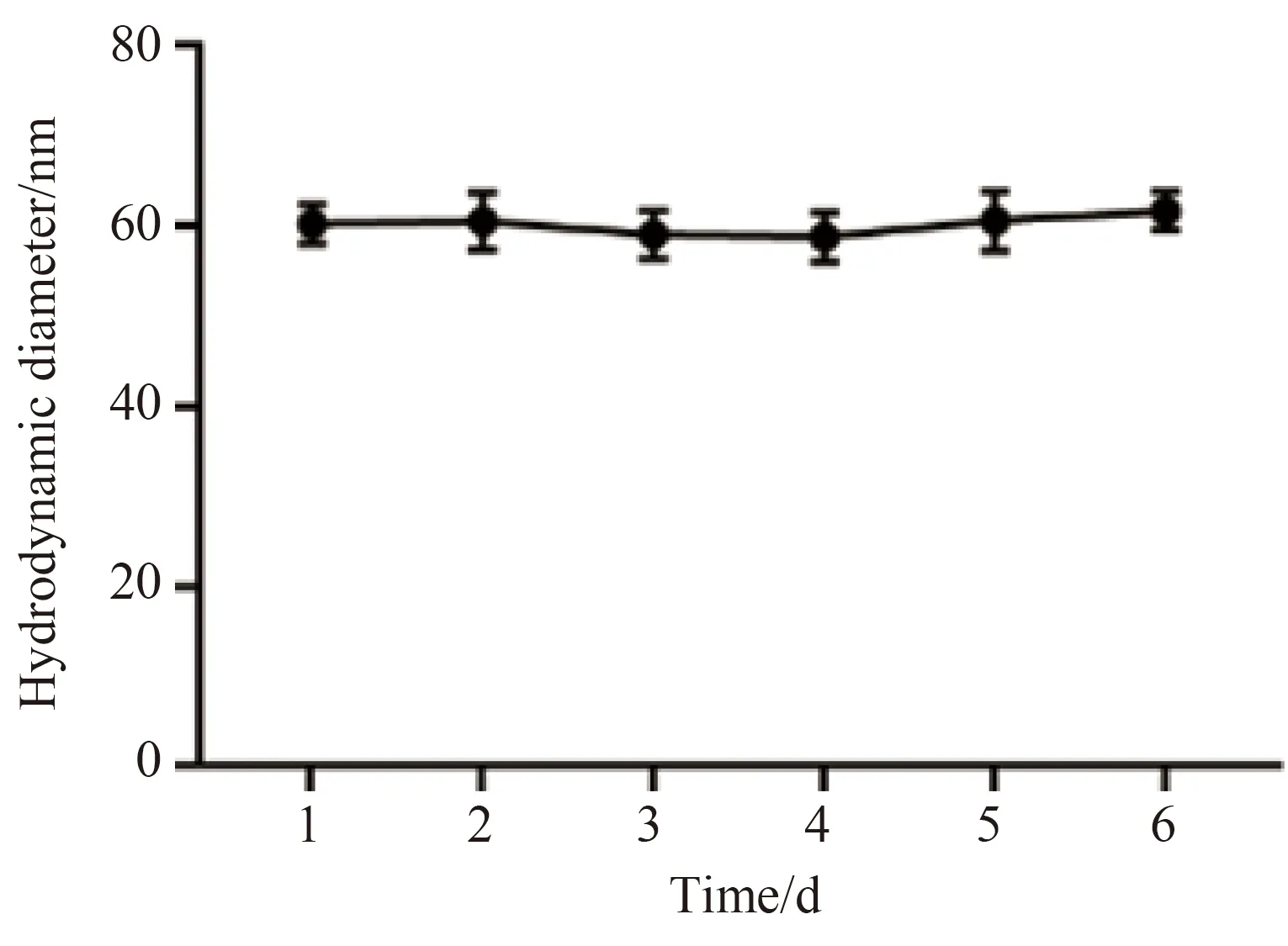
图2 在PBS中SPNs的稳定性Fig.2 Stability of SPNs in PBS over 6 days
2.2 体外细胞毒性实验
5、10、20、30 μg/mL 的SPNs混悬液与HeLa细胞孵育24 h后,各浓度下HeLa细胞的相对活力与对照组比较,差异均无统计学意义(P>0.05),表明细胞相对活力没有受到明显影响(表1,图3)。

表1 不同浓度的SPNs孵育HeLa细胞体外观察细胞活性Tab.1 In vitro viability of HeLa cell treated with SPNs solutions at different concentrations
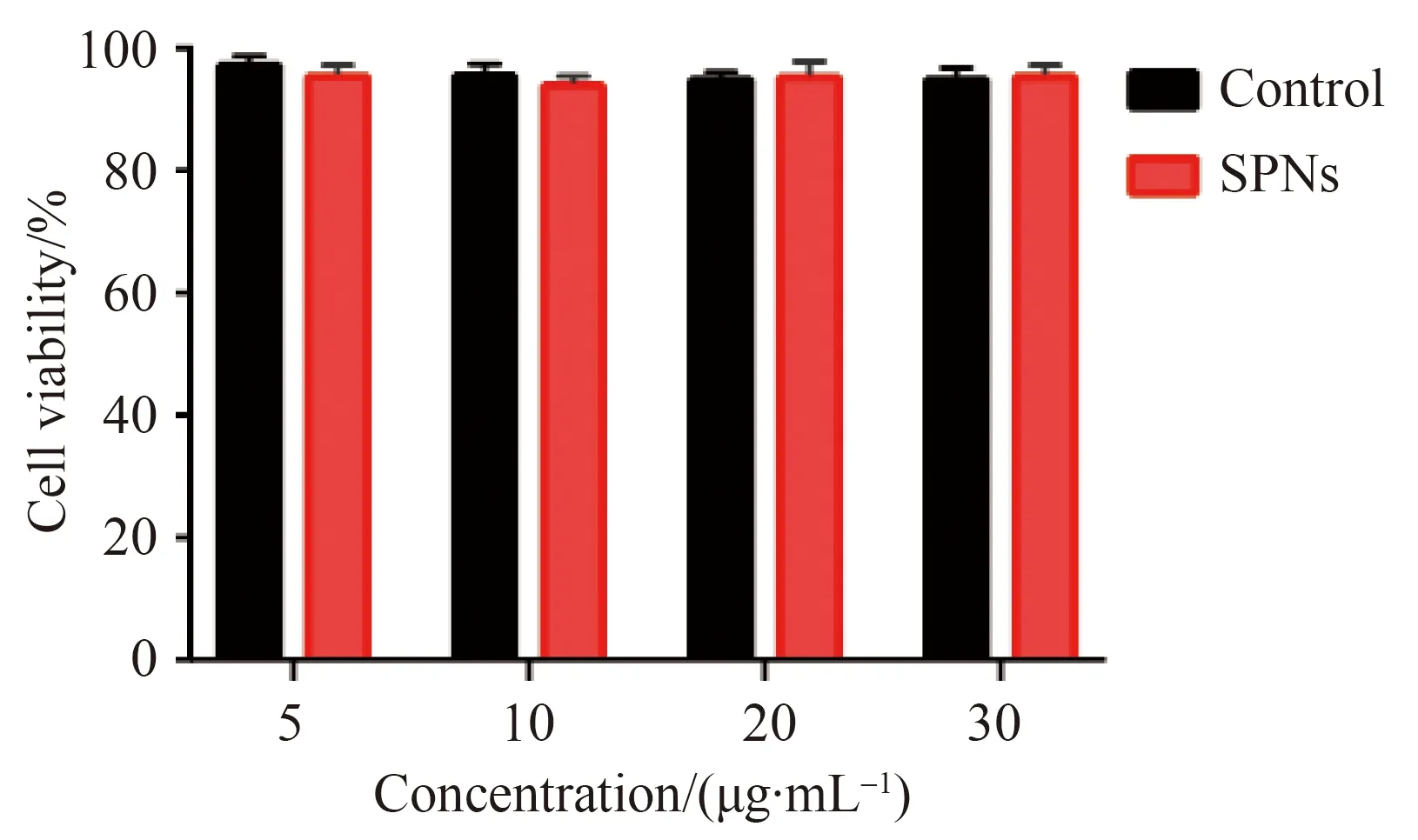
图3 不同浓度的SPNs与HeLa细胞共同孵育24 h,MTS测定细胞活力Fig.3 MTS evaluation of HeLa cell viability after cells were incubated with SPNs at different concentrations for 24 hours
2.3 体外细胞吞噬实验
SPNs混悬液与HeLa细胞共同孵育24 h,用DAPI染色细胞核,荧光扫描共聚焦显微镜显示SPNs主要分布于HeLa细胞质内(图4)。

图4 激光扫描共聚焦显微镜显示HeLa细胞吞噬SPNsFig.4 Internalization of SPNs by HeLa cell on confocal laser scanning microscopy
2.4 体外近红外荧光成像
SPNs混悬液(pH=7.4),在激发波长680 nm、发射波长840 nm成像,获得SPNs近红外荧光图像(图5),与0.9%(质量浓度)氯化钠注射液对照组对比,随着SPNs混悬液质量浓度的升高,近红外荧光强度明显增强。

图5 不同浓度的SPNs近红外荧光图Fig.5 Intensity of near infrared imaging at different SPNs concentrations
2.5 荷瘤裸鼠的光声成像
SPNs组在680 nm激光辐照下,4T1肿瘤显示增强的光声信号(表2),而对照组[0.9%(质量浓度)氯化钠注射液]仅显示微弱增强的光声信号详见图6,两组比较,差异有统计学意义(P<0.001)。
图6 实验组与对照组裸鼠移植瘤4T1光声信号强度比较Fig.6 Comparison of photoacoustic signals in 4T1 murine tumor between experimental group and control group
3 讨论
与有机染料、荧光蛋白、金属纳米粒子存在耐光性不佳,卟啉具有光毒性缺点,半导体聚合物因其优异的光学、电子学特性,被广泛应用于光电器件制造、生物传感、组织工程等领域。使用半导体聚合物制备的纳米粒子具有高光吸收性、高光稳定性等特点,而且还具备光学性质可调节、尺寸可控、无重金属的毒性、生物相容性好等优点[8],近年受到国内外一些研究者的关注,并在光声成像方面进行了相关研究。
本研究依照纳米沉淀技术制备的SPNs具有粒径较小(61±3)nm、分布均一、分散性好等特征。既往研究[9]显示肿瘤微血管孔径约为100~780 nm,而正常组织微血管内皮细胞间的紧密连接空隙小于2 nm,这可能意味着本研究所制备的较小粒径的纳米粒更易于通过增强渗透滞留效应(enhanced permeability and retention, EPR),穿过肿瘤微血管孔隙到达4T1肿瘤细胞内,在肿瘤区富集,从而发挥肿瘤显像的作用。
本研究所制备的SPNs具有稳定、细胞毒性低,对细胞生存率影响较小等特征,适合经鼠尾静脉途径注入。体外近红外荧光成像显示,在激发波长680 nm、发射波长为840 nm处成像,随着SPNs质量浓度的提高,荧光信号明显增强,这与SPNs具有较强的吸光性特性有关。
本文中,使用所制备的SPNs评价荷瘤裸鼠光声成像效果,结果显示肿瘤内出现较强的光声信号[(3.13±0.26)auvs(0.21±0.04)au,P<0.05],既往少量文献[10]也佐证本文之所见。较强的光声信号获得可能与SPNs在近红外Ⅰ区强吸光性有关,在激光辐照下,光热转化效能提高,组织受热膨胀,从而产生较强的光声信号。
由于本文仅是SPNs在光声成像中的初步探讨,所制备的SPNs也未连接特异性配体,未能实现肿瘤的主动靶向成像,未来的研究中将赋予SPNs特异性配体以实现其靶向性成像以及药物递送等多种功能。
综上所述,本试验所制备的SPNs粒径较小、安全、稳定,在鼠肿瘤模型使用获得较强的光声信号,具备一定的临床转化潜能。
