基于AMPK/mTOR通路的天然产物抗大肠癌研究进展
2019-12-23魏青闻晓东
魏青,闻晓东
(中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009)
大肠癌又称为结直肠癌,是全球第三大致死恶性肿瘤。2018年相关研究显示,未来10年内全球将有220万新增病例和110万死亡病例[1]。流行病学研究显示,诱发大肠癌的因素主要是年龄、性别、家族病史、炎症性肠病、吸烟史、饮酒史、食用加工肉类、肥胖和糖尿病,这些因素共同发生或相互作用最终可导致大肠癌的发生[2]。大肠癌的传统治疗主要采用手术结合放化疗的方式,其中大肠癌的一线化疗药物是5-氟尿嘧啶、伊利替康、卡培他滨和奥沙利铂等,这些药物虽然有效抑制了大肠癌的恶性进展,但也不可避免地造成严重的不良反应[3]。近年来除了传统的治疗方式之外,靶向治疗和免疫疗法也逐渐成为大肠癌的治疗手段之一。在大肠癌靶向治疗中,抗血管生成抑制剂和表皮生长因子受体抑制剂是2类主要靶向药物,临床上往往将其与传统化疗药物联合使用,从而提高大肠癌患者的总体生存率和生活质量[4]。此外,免疫检查点抑制剂如程序性死亡受体1(programmed cell death protein 1,PD-1)及其配体PD-L1等也在临床试验中显著提高了错配修复基因缺失和高度微卫星不稳定导致的大肠癌患者的生存率[5]。随着对大肠癌研究的不断深入,发现越来越多的化合物均有良好的抑癌效果。而天然产物凭借其来源丰富、结构新颖等特点成为大肠癌治疗的热门候选药物,将其作为先导化合物进一步开发利用,可以为大肠癌治疗提供更多样的方案。
AMP依赖的蛋白激酶(AMP-dependent protein kinase,AMPK)存在于生物体内,是由α催化亚基和β、γ调节亚基共同组成的复合三聚体[6],其中α亚基的苏氨酸172位点磷酸化介导AMPK的激活[7]。许多应激反应如葡萄糖剥夺、缺血缺氧和氧化应激等引起细胞内AMP/ATP比例上升时,可以激活能量感受器AMPK[8]。此外,AMPK的上游激酶如肝脏激酶B1(liver kinase B1,LKB1)、钙调蛋白依赖性蛋白激酶激酶β(calmodulin-dependent protein kinase kinase,CaMKKβ)和转化生长因子激酶 1(transforming growth factor-β-activated protein kinase-1,TAK1)也可以促进AMPK的活化[9]。近年来,越来越多的研究表明,在大肠癌的发病过程中AMPK作为细胞内能量感受器起重要作用,其激活剂如二甲双胍、小檗碱等可以抑制结直肠肿瘤的生长[10-11]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)作为AMPK信号通路的下游靶标之一,参与调控细胞生长、细胞增殖、极性形成、蛋白质合成和转录等,同样也是大肠癌治疗的靶点之一[12]。因此,本文总结了基于AMPK/mTOR信号通路的抗大肠癌天然产物的研究进展,以期为大肠癌治疗提供新的思路。
1 AMPK/mTOR信号传导通路
AMPK是细胞内的能量感受器,激活的AMPK通过调控下游的mTOR、胆固醇调节元件结合蛋白(sterol-regulatory element binding protein,SREBP)等一系列靶标而参与蛋白质代谢、脂质代谢、糖代谢、细胞生长和凋亡等多种生理活动[13]。mTOR是AMPK的下游靶标之一,它是一种进化上保守的丝氨酸/苏氨酸蛋白激酶,可参与调节细胞生长、细胞周期和细胞自噬等多种细胞过程(见图1)[14]。一方面,mTOR可与Raptor(regulatory associated protein of mTOR)、Deptor(domain-containing mTOR-interacting protein)、mLST8(mTOR associated protein,LST8 homolog)和 PRAS40(proline-rich Akt substrate of 40 000)形成哺乳动物雷帕霉素靶蛋白复合 物 1(mammalian target of rapamycin complex 1,mTORC1),直接调控细胞内能量和营养水平;另一方面,mTOR还可与Rictor(rapamycin-insensitive companion of mTOR)、mSin1(mammalian stressactivated protein kinase interacting protein 1)、Protor(protein observed with Rictor)和mLST8形成mTORC2,通过磷酸化AGC蛋白激酶家族成员而调节细胞增殖和活力[15]。
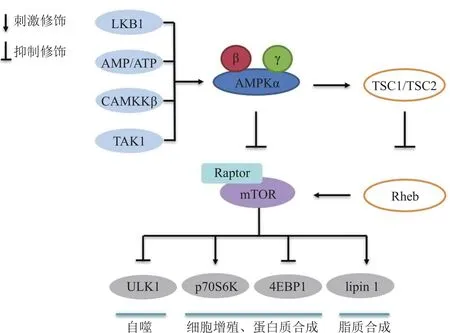
图 1 AMPK/mTOR信号传导通路Figure 1 The AMPK/mTOR signalling pathway
AMPK作为mTOR的上游激酶,不仅可以通过磷酸化结节性硬化症复合物2而激活TSC复合物间接影响mTORC1的活性,还能通过直接磷酸化Raptor而影响mTORC1的活性[16]。激活的mTORC1通过磷酸化其下游2个关键效应蛋白核糖体S6蛋白激酶1(ribosomal S6 kinase,S6K1)和真核细胞始动因子4E结合蛋白1(4E binding protein,4EBP1),在蛋白质合成和核苷酸合成中发挥关键作用。磷酸化的S6K1可以进一步调节40S核糖体亚基的组分S6核糖体蛋白,从而调控细胞生长。磷酸化的4EBP1则能与真核翻译起始因子4E结合,促进帽状结构依赖的蛋白质翻译,调控细胞周期进程[17]。同时,活化的mTORC1还可以调控SREBP和脂素1(lipin-1),促进脂质从头合成即以乙酰辅酶A为原料的脂肪酸合成,并通过激活缺氧诱导因子-1α(HIF-1α)来调节细胞代谢和三磷酸腺苷生成,此外还能通过磷酸化UNC-51样激酶1(unc-51 like autophagy activating kinase 1,ULK1)和自噬相关基因13(autophagy-related gene 13,Atg13)抑制细胞自噬[18]。
2 AMPK/mTOR信号传导通路与大肠癌的关系
大肠癌的发生与炎症和代谢紊乱密切相关,这表明AMPK作为细胞内的能量代谢枢纽可能参与调控了大肠癌的进展[8]。此外,mTOR 在多种肿瘤中均表现出过度活化,可促进肿瘤细胞增殖、血管新生和抑制肿瘤细胞凋亡等,与肿瘤的发生发展有着重要关系[19]。因此,靶向调节AMPK/mTOR信号通路有望成为大肠癌的治疗手段之一。
相比于正常分化的细胞,异常增殖的肿瘤细胞表现出不同的代谢方式,需要平衡生物合成过程和足够的三磷酸腺苷以支持肿瘤细胞的生长、存活。AMPK在能量代谢方面发挥着关键作用,可以通过调节包括大肠癌在内的恶性肿瘤的能量代谢而影响其发生发展[20-22]。mTOR作为AMPK的下游靶标参与调节细胞生长、增殖和活力。在大肠癌患者的临床样本中观察到mTOR的mRNA水平和蛋白表达均显著升高,与大肠癌的恶性程度和不良预后具有相关性[23]。与AMPK类似,mTOR也是细胞内能量代谢的关键分子之一。mTOR不仅可以促进细胞膜对葡萄糖的转运,还能靶向调控HIF-1α介导的糖酵解过程,从而调节肿瘤细胞的能量代谢[24]。此外,mTOR还能通过调控其下游的p70S6K和4EBP1参与蛋白质合成,影响大肠癌细胞的生长和增殖能力[25]。mTOR的另一下游靶标ULK1是自噬的关键调节蛋白,临床上ULK1的过度表达与胃癌、大肠癌等多种肿瘤类型的不良预后有关[26-27]。在AMPK/mTOR信号通路中,AMPK可以直接激活ULK1,从而促进肿瘤细胞发生自噬,而mTORC1可以通过磷酸化ULK1 Ser757位点来抑制其活性并阻断ULK1与AMPK的相互作用,抑制肿瘤细胞发生自噬[8]。有研究表明,mTOR亦可参与调控大肠癌细胞的自噬过程,抑制大肠癌的发生和发展[28]。
3 基于AMPK/mTOR信号通路的抗大肠癌天然产物
3.1 AMPK激动剂
越来越多的研究显示,AMPK参与了肿瘤的发生、发展,一些AMPK激动剂被用作癌症治疗药物并进行了临床前或临床研究,而目前研究最为透彻的AMPK激动剂是用于治疗2型糖尿病的二甲双胍。在大肠癌的研究中证实,二甲双胍可以通过激活AMPK而影响大肠癌发生、发展[29]。此外,其他AMPK激动剂如5-氨基-1-核糖基咪唑-4-甲酰胺磷酸盐(5-aminoimidazole-4-carboxamide1-β-D-ribofuranoside,AICAR)[30]、水杨酸盐[31]等也在体外实验中显示出抑制肿瘤细胞增殖的活性。另外,天然产物一直以来都是抗肿瘤研究的热点之一,许多天然产物都可以激活AMPK信号并表现出良好的抗大肠癌活性。
研究发现,白藜芦醇可以通过激活AMPK来抑制多药耐药蛋白和环磷酸腺苷反应元件结合蛋白的表达,从而逆转人结直肠癌HCT116细胞对奥沙利铂的耐药性,有望成为抗大肠癌的候选药物[32]。膳食类黄酮槲皮素通过激活AMPK,诱导人结直肠癌HT29细胞发生p53依赖性的细胞凋亡,在体内移植瘤模型中表现出抗大肠癌活性[33]。小檗碱是一种异喹啉生物碱,研究表明,在氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sulfate sodium,DSS)小鼠模型中小檗碱可以激活AMPK,从而抑制mTOR和p53磷酸化,进而抑制结肠上皮细胞增殖和肿瘤发生[34]。Park等[35]还发现,小檗碱可以通过激活AMPK,降低整合素β1的表达,抑制人结直肠癌SW480和HCT116细胞迁移。
此外,近年来发现越来越多新的天然产物可以直接或间接激活AMPK信号,从而抑制大肠癌的发生、发展。Tong等[36]发现,在人结直肠癌SW480和LoVo细胞中,姜黄素通过激活AMPK来抑制肿瘤的侵袭转移。另有研究显示,在体内模型中可见姜黄素有抗大肠癌活性[37]。另外,厚朴酚[38]、虫草素[39]、咖啡酸[40]、甘草西定[41]、韦德醇[42]、染料木黄酮[43]和蛇葡萄素[44]等天然产物也被报道能够激活AMPK信号而发挥其抗大肠癌活性(见表1、图2)。

表 1 在结直肠癌中激活AMPK的天然化合物Table 1 List of natural compounds regulating AMPK activation in colorectal cancer
3.2 mTOR抑制剂
作为AMPK的下游靶标之一,mTOR在细胞生长、增殖和自噬等方面也发挥着一定的调节作用。同时由于mTOR在多种恶性肿瘤中常过度活化,因此mTOR也一直是肿瘤研究中的热门靶标。在大肠癌中已有靶向mTOR的抑制剂应用于临床研究,而许多天然产物也表现出对mTOR信号的抑制作用。
Mao等[45]发现,小檗碱可以通过抑制mTOR活性来降低HIF-1α的表达,从而抑制结直肠癌细胞的葡萄糖代谢,阐明了小檗碱抗大肠癌的新机制。姜黄素可以降低mTOR、Raptor和Rictor的蛋白及mRNA水平,抑制大肠癌细胞增殖[46]。而姜黄素和5-氟尿嘧啶联用后可以通过下调Akt和mTOR蛋白的磷酸化水平,从而影响AMPK/ULK1信号通路,增强其对结直肠癌细胞的毒性[47]。欧前胡素是来源于白芷的呋喃香豆素成分,Mi等[48]发现欧前胡素通过下调mTOR/p70S6K/4EBP1和MAPK信号通路来抑制HIF-1α的表达,从而抑制大肠癌细胞增殖,并在体内、体外均显示出抗大肠癌活性。
丹酚酸B是一种从中药丹参中提取的活性化合物,研究发现其可以通过抑制Akt/mTOR信号通路,从而诱导大肠癌细胞发生自噬死亡[49]。杨梅素是一种天然的膳食黄酮类化合物,其在多发性肠腺瘤小鼠模型(APC Min/+小鼠)中的抗肿瘤活性与MAPK/Akt/mTOR信号通路有关[50]。此外,紫苏醇[51]、山麦冬皂苷A[52]、白头翁皂苷D[53]、白杨素[54]、贝母乙素[55]和大黄酸[56]等天然产物也可通过直接或间接抑制mTOR活性而在体内、体外影响大肠癌的发生发展(见表2、图2)。

表 2 在结直肠癌中抑制mTOR的天然化合物Table 2 List of natural compounds regulating mTOR inactivation in colorectal cancer
4 结语
自AMPK作为能量稳态中枢调节剂的发现及AMPK/mTOR信号通路在肿瘤生物学中调控机制的深入揭示,为基于该信号通路的新药研发提供了可能,越来越多的天然产物也表现出对AMPK-mTOR信号通路的调控作用和抗大肠癌活性,如白藜芦醇、小檗碱等天然产物具有激活AMPK活性机制而受到极大关注,但在新药成药性研究方面,还将面临着很多挑战,如天然产物抗肿瘤精确分子机制有待进一步阐明;如何针对关键药效基团开发更高效、更好口服生物利用度及安全性的衍生物;靶向特定组织(如肿瘤、肝脏及巨噬细胞等)AMPK及mTOR调控剂的开发。但最终确定长期安全性和有效性的最佳方法是进行更为广泛的临床实验。

图 2 基于AMPK/mTOR信号通路天然产物抗大肠癌机制概述Figure 2 Action mechanism of natural compounds against colorectal cancer based on AMPK/mTOR signalling pathway
