多靶点肽类镇痛药物的研究进展
2019-12-23方泉李宁许彪王锐
方泉,李宁,许彪,王锐
(兰州大学基础医学院生理学研究所 甘肃省新药临床前研究重点实验室,甘肃 兰州 730000)
疼痛是临床患者最常见的症状之一,药物治疗能有效缓解病人的痛苦。吗啡、芬太尼和羟考酮等传统阿片类镇痛药物已广泛用于中度和重度疼痛的临床治疗,但长期使用该类药物会引起耐受和成瘾等副作用,并伴随着眩晕、恶心、呕吐、便秘、瘙痒、呼吸抑制等不良反应,从而限制了其临床应用[1]。近年来,美国因芬太尼等阿片类药物滥用而致死的人数不断攀升,阿片类药物滥用已成为严重的公共卫生问题,即“阿片危机”[2-3]。
已有研究表明,mu阿片受体(MOR)在介导阿片镇痛中起着重要作用,MOR敲除动物的研究进一步验证了该受体能同时引起阿片镇痛和阿片样副作用。近年来,为了有效降低传统阿片类镇痛药物的副作用,研究人员发展了以下2种新策略[4]:1)利用阿片受体的药理学功能选择性,开发不激活β-arrestin信号通路的阿片类偏向性激动剂以降低便秘、呼吸抑制和耐受等副作用;2)开发“一药多靶”的阿片镇痛分子,即同时激活MOR及其相关的其他G蛋白偶联受体(G-protein-coupled receptor,GPCR)的多靶点阿片类镇痛分子,以平衡与痛觉相关且具有内在联系的多个药物作用靶点,从而实现增加其疗效,且降低其阿片样副作用的目标。
近年来,阿片类偏向性激动剂的研究取得了重要进展。美国Trevena公司开发的阿片类偏向性激动剂TRV130,已进入Ⅲ期临床研究阶段。与吗啡相比,TRV130的呼吸抑制、便秘、恶心呕吐等副作用有所降低,但其阿片样副作用未完全消除,且最近的啮齿类动物实验结果显示TRV130仍具有一定的成瘾性[5-10]。诺贝尔奖得主Brian Kobilka教授团队报道的PZM21,其偏向选择性虽高于TRV130,在动物实验中也未出现便秘、成瘾等副作用,但其镇痛效果却不到吗啡的1/4,且产生镇痛耐受[11-12]。Schmid等[13]发现的阿片类偏向性激动剂SR-17018,其镇痛作用与吗啡相当,且无呼吸抑制副作用,但目前仍缺乏临床研究数据的支持。因此,阿片类偏向性激动剂的临床镇痛和副作用研究仍需进一步验证。
多靶点药物能平衡与疾病相关且具有内在联系的多个药物作用靶点,从而产生更好的疗效,且有望降低副作用;近年来,“一药多靶”的阿片类多靶点镇痛药物的研究也引起广泛关注,特别是在复杂性疼痛治疗药物的研发中具有潜在的应用前景[14-17]。恒河猴的实验结果表明,MOR/孤啡肽受体(NOR)的多靶点镇痛分子BU08028、AT121和BU10038的成瘾、瘙痒、耐受、呼吸抑制、低血压等阿片样副作用均大幅降低[18-20]。MOR/NOR的多靶点镇痛分子西博帕多(cebranopadol,GRT-6005)也已进行Ⅲ期临床研究,在关节炎和神经痛治疗等方面具有较好的应用前景[21]。此外,从化学结构分类上看,无论是小分子类多靶点阿片镇痛分子,还是肽类多靶点阿片镇痛分子都取得了重要进展。其中,肽类药物具有疗效好、安全性高等优势,且笔者课题组长期从事多肽新药创制的研究工作,因此,本综述将着重介绍肽类多靶点阿片镇痛分子的最新研究进展,表1总结了各多靶点肽类镇痛配体的序列结构和药理学作用。
1 阿片类多靶点肽类镇痛药物
1.1 Mu/Delta阿片受体多靶点肽类镇痛药物
早期研究表明,联合使用delta阿片受体(DOR)激动剂和MOR激动剂,不影响MOR激动剂所介导的镇痛作用,却显著降低耐受、成瘾和自发运动加强等副作用[22]。Lowery 等[23]发现低剂量的DOR激动剂能显著增强MOR激动剂的亲和性和镇痛作用。上述结果表明DOR激动剂和MOR激动剂的联合使用,能有效降低MOR激动剂的给药剂量,并减轻其阿片样副作用,有效提高药物的治疗指数。然而,有趣的是Zielinska等[24]发现DOR拮抗剂也能降低MOR激动剂海洛因的成瘾性。不过,对于不同效能的DOR配体均降低MOR所引起的阿片样副作用的作用机制迄今仍不清楚。基于MOR与DOR之间的功能性联系,从理论上推测,同时作用于MOR和DOR的多靶点分子在发挥镇痛活性的同时,有望降低其阿片样副作用(见表1)。基于亮氨酸脑啡肽通过糖基化修饰而获得的MMP-2200,在体内和体外实验中均表现为MOR/DOR的多靶点激动剂。外周注射MMP-2200在小鼠温浴甩尾实验中可产生剂量依赖性镇痛作用。与吗啡相比,连续注射MMP-2200所引起的耐受和成瘾副作用均大幅度降低,其自发运动加强和便秘等副作用也显著减弱[23]。此外,恒河猴全身注射MMP-2200在辣椒素诱导的痛敏模型中产生显著的镇痛作用,未出现明显的成瘾性[25]。
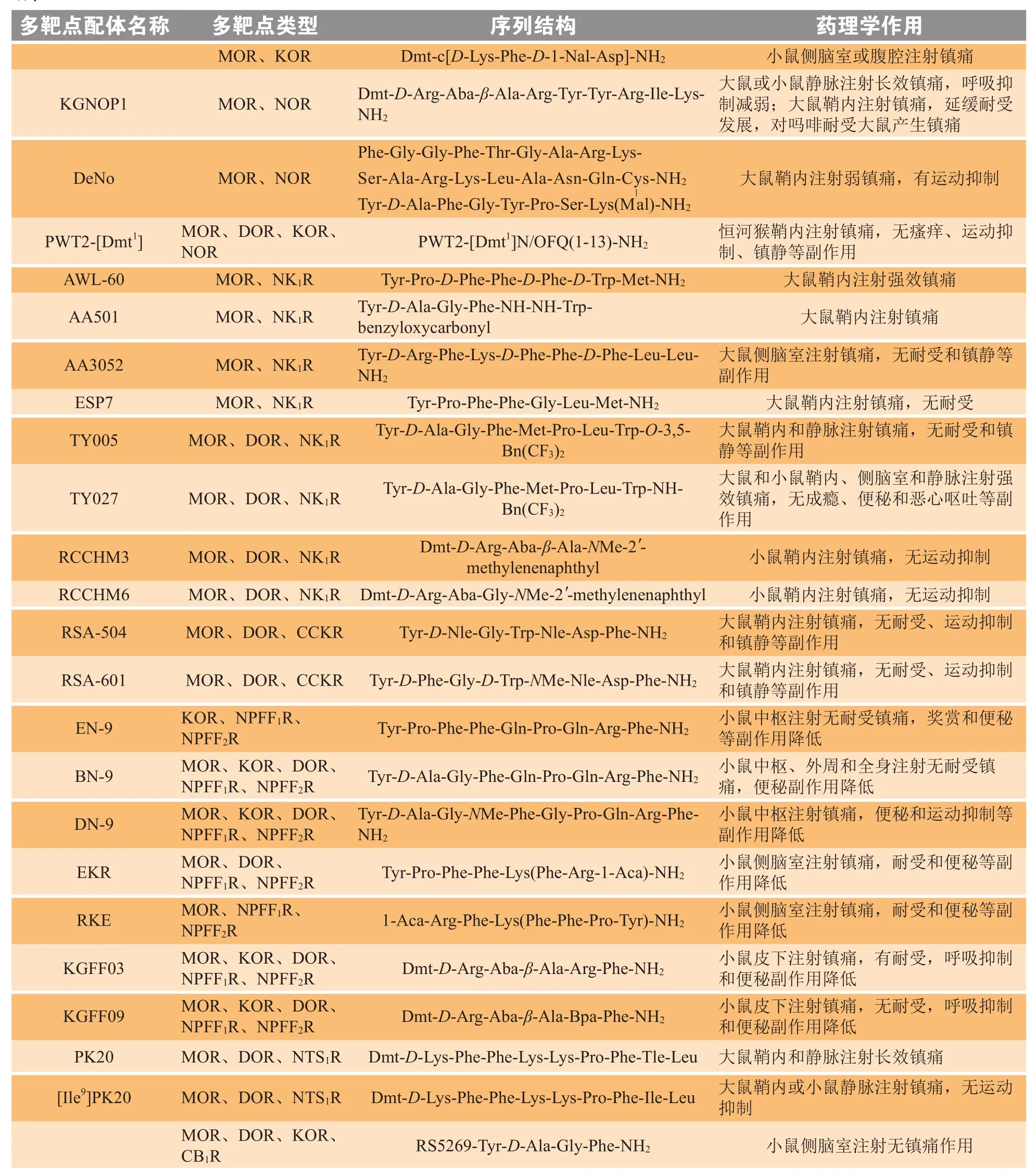
续表1
基于芬太尼和脑啡肽的化学结构而构建的MOR/DOR多靶点分子RV-Jim-C3,在体内和体外实验中均表现为MOR/DOR的多靶点激动剂。大鼠鞘内注射RV-Jim-C3能产生强效的镇痛作用,有效减缓急性痛、炎症痛和神经痛等病理性疼痛,且未出现运动抑制现象[26],因此具有较好的临床应用前景。最近,以芬太尼和脑啡肽为模板分子而构建的MOR/DOR的多靶点激动剂carboxyfentanyl-NH-NH-Phe-Gly-D-Ala-Tyr,经鞘内注射时,在急性痛、炎症痛和神经痛等不同模型中均产生镇痛作用,未出现镇静和运动抑制的副作用[27]。
UFP-505是表现为MOR激动活性和DOR拮抗活性的多靶点分子,大鼠鞘内注射UFP-505在急性痛中可产生剂量依赖性镇痛作用,仅在高剂量时出现显著的运动抑制现象。然而,与吗啡一样,连续鞘内注射UFP-505仍产生镇痛耐受现象[28]。
多靶点分子VRP26在体外功能性实验中表现出MOR激动活性和DOR拮抗活性[29],并具有血脑屏障通透性。腹腔注射VRP26在小鼠温浴甩尾模型中可产生剂量依赖性镇痛作用。此外,VRP26不引起急性耐受现象,连续注射时未出现镇痛耐受现象,与芬太尼相比,VRP26的成瘾性也显著降低。
综上所述,已有的研究结果表明MOR/DOR的多靶点分子能产生高效的镇痛活性,并且其运动抑制、耐受和成瘾等副作用均不同程度地减弱。然而,值得注意的是,MOR/DOR的多靶点分子无论表现出DOR激动活性还是DOR拮抗活性,其阿片样副作用均有所降低,但其具体的作用机制仍需进一步的实验来探讨。
1.2 Mu/Kappa阿片受体多靶点肽类镇痛药物
Kappa阿片受体(KOR)广泛分布于中枢神经系统和外周组织[30]。与奖赏、情绪和认知等功能密切相关的脑区核团,如腹侧被盖区(VTA)、海马和纹状体,均有KOR的mRNA高水平表达。同时,KOR也广泛表达于与痛觉相关神经组织中,如背根神经节、脊髓、中脑导水管周围灰质和丘脑。已有的药理学结果表明,KOR的激动剂在发挥镇痛作用的同时,无显著的成瘾性出现。此外,研究表明KOR激动剂可降低可卡因诱导的行为敏化、耐受和成瘾等副作用[31]。KOR激动剂对成瘾性的调节,可能与其抑制了多巴胺能神经元释放多巴胺的性质有关。基于这些理论,MOR激动剂/KOR激动剂的多靶点分子,与MOR或KOR的单靶点激动剂相比,在高效、低副作用的镇痛新药研发中具有更好的应用前景。
基于内吗啡肽2通过2个分子间环化而构建的二聚体结构(Tyr-[D-Lys-Phe-Phe-Asp]-NH2)2[32],在体外亲和实验和钙流实验中能同时表现出MOR和KOR的亲和性和激动活性。药理学实验表明该多靶点分子不能穿透血脑屏障,侧脑室注射(Tyr-[D-Lys-Phe-Phe-Asp]-NH2)2在小鼠热板实验中可剂量依赖性地产生镇痛活性;此外,腹腔注射(Tyr-[D-Lys-Phe-Phe-Asp]-NH2)2也在小鼠扭体实验中发挥显著的镇痛作用。
多靶点分子Dmt-c(D-Lys-Phe-D-1-Nal-Asp)-NH2也是基于内吗啡肽2结构环化修饰而来[33]。体外功能实验结果表明其表现出MOR激动活性和KOR激动活性,且对于2种受体的激动活性的效价基本相当。侧脑室和腹腔注射Dmt-c(D-Lys-Phe-D-1-Nal-Asp)-NH2在小鼠热板实验中均产生剂量依赖性镇痛作用。
上述研究结果表明,MOR/KOR的多靶点激动剂可产生有效的镇痛作用,然而,这些多靶点分子的阿片样副作用仍待进一步评价。
1.3 Mu阿片受体/孤啡肽受体多靶点肽类镇痛药物
已有研究表明NOR与MOR、DOR和KOR等传统的阿片受体之间存在高度的氨基酸序列同源性,被认为是阿片受体家族的新成员,但NOR的药理学功能与经典阿片受体存在一定的差异性,MOR、DOR和KOR的配体对NOR的亲和性不高。已有的研究表明,在啮齿类和灵长类动物实验中,鞘内联合使用MOR激动剂吗啡和NOR激动剂孤啡肽可产生协同的镇痛作用,并且NOR激动剂能有效降低MOR激动剂的呼吸抑制、瘙痒、耐受和成瘾等副作用[34]。免疫共沉淀结果表明,NOR和MOR在与痛觉相关的脑区存在共分布[35]。因此,开发同时作用于MOR和NOR的多靶点分子是发展高效、低副作用的新型镇痛药物的有效策略。该策略已被临床使用小分子结构的镇痛药物所验证,如丁丙诺啡,对MOR、DOR、KOR和NOR受体同时表现出激动活性,因其在呼吸抑制和成瘾性等副作用中具有天花板效应,而在镇痛作用中无此效应,因此是一种安全指数较高的镇痛药物,而且还可用于治疗阿片类药物的成瘾[16]。
基于MOR激动剂皮啡肽(dermorphin)和NOR激动剂孤啡肽的化学结构而构建的多靶点分子DeNo,对MOR和NOR都表现出较高的亲和性和激动活性,然而,与母体皮啡肽相比,大鼠鞘内注射DeNo的镇痛作用有所降低,且在转棒实验中表现出运动抑制[36]。
[Dmt1]N/OFQ(1-13)-NH2是作用于阿片受体/NOR的多靶点激动剂,以其为化学模板分子,通过肽装订技术(peptide welding technology,PWT)构建了树枝状的多靶点分子PWT2-[Dmt1]N/OFQ(1-13)-NH2(PWT2-[Dmt1])[37]。在体外实验中,PWT2-[Dmt1]对MOR、DOR、KOR和NOR都表现出较好的亲和性和激动活性。在恒河猴的体内实验中,鞘内注射PWT2-[Dmt1]在温水浴甩尾实验中对急性痛产生剂量依赖性镇痛作用,其作用强度和持续时间均高于母体[Dmt1]N/OFQ(1-13)-NH2,且药理学实验表明该镇痛作用由NOR受体介导,而与阿片受体无关。此外,PWT2-[Dmt1]不产生瘙痒、运动抑制和镇静的副作用。
基于MOR激动剂活性片段Dmt-D-Arg-Abaβ-Ala-NH2和NOR拮抗剂活性乙酰基六肽Ac-Arg-Tyr-Tyr-Arg-Ile-Lys-NH2的化学结构而构建的MOR/NOR的多靶点配体KGNOP1,对MOR和NOR都具有较高的亲和性,且同时表现出MOR激动活性和NOR拮抗活性[38]。在大鼠或小鼠体内,静脉注射KGNOP1在急性痛或慢性缩窄性神经损伤(CCI)诱导的神经痛等模型中均产生剂量依赖性镇痛作用,且镇痛效果显著强于吗啡,作用时间更长,同时其呼吸抑制的风险明显降低。此外,大鼠鞘内注射KGNOP1在急性痛和神经痛模型中产生镇痛作用,与吗啡相比,延缓了其镇痛耐受现象的出现,同时在吗啡耐受大鼠中仍有效地缓解疼痛。
MOR/NOR多靶点肽类分子具有高效镇痛作用,且能有效降低耐受、呼吸抑制、瘙痒、运动抑制、镇静等阿片样副作用。值得注意的是,现有研究表明,MOR激动剂无论与NOR激动剂或拮抗剂的多靶点组合均可以降低阿片样副作用,因此NOR的激动活性或拮抗活性在MOR/NOR多靶点分子中的作用仍待进一步的实验进行阐明。
2 阿片/非阿片受体的多靶点肽类镇痛药物
2.1 阿片/神经激肽1受体的多靶点肽类镇痛药物
P物质(substance P,SP)作为神经递质和神经调质,在痛觉信号传导中具有重要的调节作用,也被认为是一种阿片调节肽,其作用靶点为痛觉相关的神经激肽1(NK1)受体[39]。在动物实验中,联合使用NK1受体拮抗剂和阿片类物质,能加强阿片的镇痛作用,并且,NK1受体拮抗剂能减缓阿片所介导的镇痛耐受和恶心呕吐副作用。因此,药物化学家们基于阿片肽/神经激肽来设计阿片/NK1受体的多靶点分子。
2000年,Foran等[40]基于内吗啡肽2和SP的C末端五肽SP(7-11)的化学结构构建了多靶点分子ESP7。体外功能性实验表明ESP7能同时激活MOR和NK1受体。大鼠脊髓注射ESP7可产生阿片受体介导的镇痛作用,且连续注射5 d未出现耐受现象,进一步的药理学研究表明NK1受体参与了ESP7的无耐受镇痛作用。在吗啡耐受的动物体内注射ESP7仍可产生高效的镇痛作用,未出现交叉耐受现象。此外,ESP7经氨基酸替换的类似物ESP6(Tyr-Pro-Phe-Phe-Pro-Leu-Met-NH2)保留了ESP7的NK1受体激动活性,但其MOR受体激动活性大幅降低,因此单独注射时只产生轻微的镇痛作用,但能有效加强并延长吗啡的镇痛作用,减缓其镇痛耐受现象的出现[40]。
AWL-60是将阿片与神经激肽的药效团进行化学连接的首个多靶点分子。在体外和体内实验中,AWL-60可显著拮抗SP(6-11)的作用,表现出NK1受体的拮抗活性。脊髓注射AWL-60可产生强效、长时程的镇痛作用[41]。随后,Bonney等[42]基于脑啡肽和NK1拮抗剂的药效团进一步构建了AA501,大鼠鞘内注射AA501在急性痛、炎症痛和神经痛等模型痛中均产生显著的镇痛作用。此外,该课题组以阿片肽DALDA (Tyr-D-Arg-Phe-Lys-NH2)和SP类似物为化学模板分子,构建了多靶点分子AA3052,大鼠侧脑室注射AA3052能产生无耐受镇痛作用,且未出现镇静副作用[43]。
美国Hruby研究组基于阿片受体和NK1受体药效团构建了一系列阿片/NK1受体的多靶点分子,以期筛选出高效、低副作用的镇痛新药。基于阿片激动剂和NK1受体拮抗剂构建出多靶点分子TY005,大鼠鞘内和静脉注射TY005均能产生无耐受镇痛作用,且无镇静副作用出现[44]。此外,多靶点分子TY027同样表现出MOR、DOR激动活性及NK1受体拮抗活性,其血浆酶解半衰期可保持4 h以上。鞘内、侧脑室和静脉注射TY027在急性痛和神经痛等模型痛中产生强效镇痛作用,且未出现明显的成瘾、便秘和恶心呕吐等阿片样副作用[45]。
2017年,Starnowska等[46]构建了一系列阿片激动剂/NK1拮抗剂的多靶点分子RCCHM1 ~RCCHM8。在大鼠急性痛模型中,鞘内注射先导化合物RCCHM3和RCCHM6所产生的镇痛活性低于模板分子 KGOP1(Dmt-D-Arg-Aba-β-Ala-NH2)。然而,在神经病理性痛模型中,这2种先导化合物的镇痛活性均显著强于模板分子KGOP1。
阿片/NK1受体的多靶点肽类分子可产生无耐受镇痛作用,并有效降低部分阿片样副作用。同样,NK1受体的激动活性或拮抗活性在阿片/NK1受体的多靶点分子中的作用需进一步阐述。
2.2 阿片/胆囊收缩素2受体的多靶点肽类镇痛药物
胆囊收缩素(cholecystokinin, CCK)能减弱阿片类物质所介导的镇痛作用,被认为是一种阿片调节肽。CCK可作用于CCK2受体,促进吗啡镇痛耐受现象的出现;反之,CCK2受体的拮抗剂可有效地逆转吗啡耐受现象,且减轻吗啡所引起的生理性成瘾等副作用。因此,开发具有阿片激动活性和CCK2受体拮抗活性的多靶点分子有望降低阿片样副作用[47]。
美国Hruby研究组基于阿片药效团和CCK的类似物SNF9007的化学结构构建了多靶点分子RSA-504和RSA-601。两者均具有MOR、DOR激动活性及CCK2受体拮抗活性,大鼠鞘内注射RSA-504和RSA-601可产生无耐受镇痛作用,且不出现运动抑制和镇静等阿片样副作用[48]。
2.3 阿片/神经肽FF受体的多靶点肽类镇痛药物
神经肽FF(NPFF)是一类重要的内源性阿片调节肽,对阿片类物质所引起的镇痛、耐受和成瘾均具有一定的调节作用。已有的研究表明NPFF及其相关肽主要通过NPFF1和NPFF2这2种不同的受体来介导其生物活性。笔者课题组在NPFF活性鉴定过程中发现NPFF能加强内吗啡肽2的镇痛作用,并能减弱阿片奖赏和成瘾作用[49-50]。在此基础上,率先提出将NPFF和阿片受体作为新型阿片类多靶点分子的组合靶点。
前期的阿片肽和NPFF构效关系研究表明,NPFF的C末端以酰胺结尾的四肽结构是其激活NPFF受体的关键药效团,而内吗啡肽激活MOR受体的关键药效团是N末端三肽结构。基于阿片肽和NPFF的结构和功能研究,笔者课题组利用多肽“分子嵌合”策略,以内吗啡肽2和NPFF为化学模板分子,成功构建了多靶点分子EN-9[51]。体外功能性鉴定发现,EN-9能同时激活KOR和NPFF受体,但不能激活MOR。体内活性检测发现,中枢注射EN-9能产生无耐受镇痛作用。与模板分子内吗啡肽2相比,EN-9的奖赏和便秘等副作用均有所降低[51]。进一步以EN-9为化学模板,对阿片肽和NPFF的药效团进行替换,通过活性筛选发现了阿片/NPFF受体的多靶点分子BN-9[52],体外功能性实验表明BN-9能同时激活MOR、KOR、DOR、NPFF1和NPFF2受体。侧脑室注射BN-9能产生MOR和KOR受体介导的镇痛作用,且未出现镇痛耐受现象,其便秘副作用也有所降低,但保留与吗啡相当的奖赏作用。进一步的药理学鉴定发现BN-9不能穿透血脑屏障[53-54],脚掌或腹腔注射BN-9在内脏痛、手术后痛和炎症痛等不同的病理痛模型中均能产生外周阿片受体介导的镇痛活性,并且无镇痛耐受现象,其便秘副作用也有所降低。在先导化合物BN-9的基础上,利用氨基酸替换修饰的方法进行结构优化,成功筛选出高效镇痛的多靶点分子DN-9[55],其能同时激活阿片和NPFF受体,且侧脑室注射时能通过MOR和KOR介导高效的镇痛活性,并在炎症痛模型中具有镇痛作用,无镇痛耐受现象,其便秘和运动协调性副作用也明显降低。
此外,笔者课题组以内吗啡肽2和NPFF受体拮抗剂RF9为化学模板分子,设计并合成了树枝状多靶点分子EKR和RKE[56],体外功能性实验表明EKR和RKE表现为阿片受体激动剂、NPFF1受体拮抗剂和NPFF2受体半激动剂,脊髓以上水平注射EKR和RKE在光热甩尾急性痛模型中产生MOR受体介导的镇痛作用,而在炎症痛模型中,它们的脊髓水平镇痛作用与阿片和NPFF受体的激活有关。进一步的研究发现,EKR和RKE能有效减缓镇痛耐受的形成,且其便秘副作用也有所降低。
最近,Smionin和Ballet课题组合作研究发现了一系列阿片/NPFF受体的多靶点肽类分子,其中,KGFF03在体外功能性实验中表现为MOR激动剂、DOR激动剂、KOR半激动剂、NPFF1和NPFF2受体的激动剂,而KGFF09表现为MOR激动剂、DOR激动剂、KOR拮抗剂、NPFF1和NPFF2受体的拮抗剂;且KGFF03和KGFF09均表现为不激活β-arrestin信号通路的MOR的阿片类偏向性激动剂,具有NOR受体的弱拮抗活性,并对GPR10、GPR54和GPR103等其他RF-NH2相关肽的受体基本无亲和性[57]。体内活性鉴定发现皮下注射KGFF03和KGFF09都能产生长效的镇痛作用,且两者的呼吸抑制和便秘等副作用明显降低[57]。然而,KGFF03和KGFF09在镇痛耐受方面存在一定的差异性,即具有MOR、DOR激动活性和NPFF受体激动活性的KGFF03产生镇痛耐受现象,而具有MOR、DOR激动活性和NPFF受体拮抗活性的KGFF09未出现镇痛耐受现象[57]。因此,KGFF03和KGFF09的体内活性的作用机制仍需进一步的验证,例如考察KGFF03和KGFF09所产生的镇痛作用具体由哪些阿片受体亚型参与。
综上所述,已有的研究结果表明阿片/NPFF受体的多靶点分子可产生镇痛活性,但仍有一些现象需进一步的研究来阐明。例如:阿片/NPFF受体的多靶点激动剂BN-9和KGFF03存在不同的镇痛耐受现象,引起这种差异现象的原因需从以下几个方面来探求:其一,体外功能性实验表明BN-9和KGFF03在KOR上存在不同药理学特性,则需考虑参与镇痛的阿片受体亚型是否存在差异性;其二,BN-9和KGFF03分别为九肽和六肽结构,则需考虑阿片和NPFF药效团是否需要维持一定的空间距离以使多靶点分子不出现镇痛耐受现象,笔者课题组未发表的研究结果也发现BN-9的六肽和七肽类似物的确存在镇痛耐受现象,进一步说明阿片和NPFF药效团的空间距离对于所构建的多靶点分子是否产生镇痛耐受极其重要。此外,树枝肽EKR、RKE与六肽KGFF03的体外药理学活性相近,但其镇痛耐受却不同,这种差异性进一步验证了空间结构和距离对于多靶点分子的重要性。值得一提的是,虽然绝大部分研究都表明NPFF受体拮抗剂能有效降低阿片镇痛耐受,但也有报道发现NPFF2受体的选择性激动剂AC-263093能减缓吗啡耐受的现象[58]。
2.4 阿片/其他受体的多靶点肽类镇痛药物
内源性神经肽神经降压素(neurotensin,NT)主要通过神经降压素受体亚型1(NTS1)和亚型2(NTS2)来介导其生物活性,可产生不依赖于阿片系统的镇痛活性。其构效关系研究表明,NT的C末端六肽NT(8-13)是保持其受体亲和性和激动活性的关键药效团。在大鼠热板实验中,皮下注射NTS激动剂NT69L与吗啡具有协同的镇痛作用[59]。基于MOR激动剂内吗啡肽2和NT关键药效团而构建的多靶点分子PK20,对MOR、DOR和NTS1受体均具有较好的亲和性和激动活性。大鼠鞘内或小鼠静脉注射PK20在温浴甩尾实验中具有长效的镇痛活性,其镇痛效价比吗啡强150倍以上[60]。大鼠鞘内或小鼠静脉注射PK20的类似物[Ile9]PK20,在光热甩尾实验中同样能够产生镇痛作用,虽其镇痛效果弱于PK20,但未出现运动抑制的副作用[61]。
大麻(cannabinoid)受体(CB1和CB2受体)激动剂具有镇痛作用,四氢大麻酚(Δ9-THC)等部分激动剂已应用于临床[62]。因此,大麻受体被认为是构建非阿片类多靶点分子的候选组合靶标之一。阿片受体和大麻受体的激动剂共注射时能产生协同增强的镇痛作用。此外,CB1受体拮抗剂能逆转吗啡的镇痛耐受和依赖性。基于阿片肽活性片段Tyr-D-Ala-Gly-Phe-NH2和CB1受体拮抗剂利莫那班(rimonabant)类似物构建的多靶点配体,对MOR、DOR、KOR、CB1R表现出亲和性和反向激动活性,然而在小鼠热板和甩尾实验中侧脑室注射后丧失镇痛作用[63]。
美国Hruby研究组构建了一些阿片/其他受体的多靶点分子。基于MOR药效团Tyr-D-Ala-Gly-Phe与黑皮质素受体拮抗剂SHU9119构建的VVK052和VVK054,对MOR和MC4R具有极好的亲和性[64]。基于DOR激动剂脑啡肽的类似物Tyr-D-Ala-Phe、Tyr-D-Ala-Gly-Phe、Tyr-Pro-Phe 和缓激肽B2受体拮抗剂Hoe140构建了一系列多靶点分子,部分分子表现出较高的MOR和DOR受体亲和性,但对B2受体的亲和性较弱[65]。基于脑啡肽药效团和5-羟色胺再摄取抑制剂(selective serotonin re-uptake inhibitors,SSRIs)药效团构建的多靶点分子,同时具有阿片受体激动活性以及5-羟色胺或去甲肾上腺素再摄取抑制活性[66]。然而,基于黑皮质素受体、缓激肽受体或5-羟色胺再摄取抑制剂系统构建的阿片类多靶点配体,其是否保持了镇痛活性,且其阿片样副作用是否有所降低,目前这些化合物的体内药理学活性鉴定结果仍未见报道。
3 结语
近年来,阿片类多靶点分子的研究在新型高效、低副作用镇痛新药研发方面具有潜在的应用前景,特别是在降低耐受、成瘾、呼吸抑制、便秘和运动抑制等阿片样副作用方面取得重要进展,例如MOR/NOR多靶点镇痛分子的药理学活性在非人灵长类动物和临床研究中得以验证。虽然多靶点镇痛药物的治疗优势已被广泛接受,但是真正意义上的多靶点药物(单药多靶)的发现和药理学鉴定仍需进一步的研究来深入阐述,迄今还未建立完善的多靶点肽类分子系统设计、优化的策略和理论。多靶点药物设计过程中通常会存在以下3个技术难点:1)可能组合靶点的发现;2)活性筛选技术的复杂性;3)多靶点分子中各药效团之间的配比和协同效应。针对上述技术难点,结合已有的研究,初步总结出多靶点肽类分子的研究策略:1)2个受体之间存在内在的功能性联系,并有助于提高镇痛药效、降低阿片样副作用,对可以作为候选的组合靶点予以验证;2)体外和体内筛选方法相结合,体外活性筛选方法用于评价多靶点分子对单靶点的亲和和激动/拮抗活性,而体内活性评价用于检测多个受体系统之间的协同效应,是否达到预期的镇痛药效提高或阿片样副作用降低等目标;3)结合传统单靶点肽类分子的构效关系研究数据,对多靶点分子中的关键药效团进行替换修饰,并在化学修饰过程中一定要统筹考虑单位点或多位点对各个药效团的效能和效价的影响,多靶点分子中一般存在2个以上药效团,结构的细微改变都会直接影响不同药效团对其受体的亲和性和药理学特性。由于已有的多靶点肽类镇痛分子的研究仍十分有限,上述研究策略尚需进一步的实践和研究来不断地完善和提升。
多靶点肽类镇痛药物的设计和研发需要考虑多方面的因素:1)多个受体系统之间的内在联系和相互协同效应;2)每个药效团具有不同的内在活性和药理学特性,如完全激动剂、半激动剂、反向激动剂、中性拮抗剂、构象调节剂等;3)靶向的多受体之间是否存在受体异源性聚合现象;4)多靶点肽类分子是否具有血脑屏障通透性和细胞穿透性。虽然阿片类多靶点分子的设计和化学构建目前受到广泛关注,但不同给药途径时多靶点肽类分子的镇痛活性和功能存在一定的差异性,其具体的药理学功能鉴定仍需系统的研究来深入阐明,以期全面地评价多靶点镇痛分子在高效、低副作用的镇痛新药研发中的成药性。此外,由于单个受体可介导多种生物学功能,并且单个受体能激活不同的下游信号转导通路具有药理学功能的选择性,如MOR对下游的不同信号转导通路具有偏好选择性,因此,仍需进一步的研究来阐明高效、低副作用的多靶点镇痛分子的具体神经生物学机制。
