低温胁迫对不同早熟禾品种糖酵解代谢及其相关基因表达的影响
2019-12-20董文科张玉娟张兆恒马晖玲
董文科, 马 祥, 张玉娟, 郭 睿, 张兆恒, 张 岩, 马晖玲*
(1. 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2. 青藏高原优良牧草种质资源利用重点实验室, 青海省畜牧兽医科学院, 青海 西宁 810016)
低温胁迫是一种常见的环境胁迫因子,是影响植物生长发育和地理分布最主要的因素之一[1]。植物在受到低温胁迫时,其细胞膜系统遭到损伤,矿质营养吸收受到影响,生物合成速率降低,光能吸收减少,许多生理代谢功能受阻,严重时可导致植株死亡[2-3]。草地早熟禾(Poapratensis)是优良的禾本科牧草,也是城市草坪建植中主要使用的冷季型草坪草,广泛用于草坪建设以及生态环境治理[4]。但低温是影响草地早熟禾绿期和越冬的主要环境因素,若冬季温度较低或春秋季受寒流侵袭,会出现无法越冬、春季返青慢和秋季早衰等现象,严重影响草坪的美观[5]。青海扁茎早熟禾(Poapratensisvar.ancepscv. Qinghai)是草地早熟禾的一个变种,是青藏高原分布最广的优质牧草之一,其抗寒、耐旱,抗逆性强,在零下35℃的低温下能安全越冬,适合在海拔3 000 m以上、年降雨量400 mm的高寒牧区种植[6]。青海扁茎早熟禾叶量多、草质柔嫩、营养丰富、适口性好,是家畜的优良饲草;其根系强壮发达、易形成草皮、固土能力强,在青藏高原高寒地区生态环境治理、水土保持中也发挥着重要作用[7]。目前,对于青海扁茎早熟禾低温应答机制的研究大多集中在生理生化方面,而植物对低温等逆境胁迫的调节和适应是一个综合的反应,涉及基因调节、转录后调节、翻译后修饰和代谢物反馈等多个生物学水平的系统调节。因此,更为深入的探究青海扁茎早熟禾对低温胁迫的响应机制,可以为后续的抗寒基因挖掘和草坪草分子育种工作提供有力支持。
糖是植物光合作用的主要产物,也是呼吸作用的底物,它为植物细胞的构建和耗能提供碳骨架和能源,同时具有调控代谢、抵抗环境胁迫和影响生长发育等重要作用[8]。糖类的代谢是生物体代谢的中心,它连通了核酸代谢、蛋白质代谢、脂类代谢及次生代谢等多个代谢途径[9]。其中,糖酵解途径是糖类代谢的一个重要过程,在高等植物中的主要作用是氧化蔗糖产生ATP、NADH和丙酮酸[10]。该途径与植物响应温度、干旱和盐碱等非生物胁迫相关[11]。在非生物胁迫下,植物体内的果糖通过糖酵解途径分解为丙酮酸时需要多种酶催化,这些酶不仅起到催化反应和能量调节器的作用,而且还能作为信号传导装置响应环境变化[12]。本实验室前期将抗寒性强的青海扁茎早熟禾和对低温敏感的商用草地早熟禾‘巴润’(Poapratensis′Baron′)进行低温处理后用转录组学的方法分析了这两种早熟禾品种对低温胁迫的分子响应机制,并对这两个品种特有的差异表达基因进行富集分析发现,青海扁茎早熟禾在糖酵解/糖异生途径富集较多,而草地早熟禾‘巴润’在此途径无差异表达基因富集。因此,本研究继续以草地早熟禾‘巴润’作为对照,对青海扁茎早熟禾糖酵解途径相关物质及调控基因与其抗寒性的关系进行初步研究,旨在揭示青海扁茎早熟禾抗寒性与糖酵解途径的关系。
1 材料和方法
1.1 试验材料
供试材料青海扁茎早熟禾(PQ)由青海省畜牧兽医科学院提供;商用品种草地早熟禾‘巴润’(PB)由北京克劳沃草业技术开发中心提供。
1.2 材料培养与处理
本试验于2018年9-11月在甘肃农业大学草业学院培养室中进行,选取颗粒饱满、健康的早熟禾种子,经20% NaClO消毒后,均匀播种在直径25 cm、高20 cm的育苗钵中,基质为营养土和蛭石的混合物(2:1)。在人工培养箱内培养,昼夜温度为(25±1)℃;时长为白天16 h,夜晚8 h;光照强度为500 μmol·(m2·s)-1;相对湿度60%~70%。待幼苗长至10 cm左右时进行间苗,每盆留下长势一致的30株幼苗进行下一步试验。
待幼苗长出4~5片真叶时进行低温处理。将每个材料长势一致的幼苗放置在0℃的低温光照培养箱中进行低温处理(除温度外其他培养条件同处理前),采集低温胁迫处理0 h,1 h,3 h,6 h,12 h,24 h,48 h,72 h和 120 h后的叶片样品,用于生理指标和基因相对表达量的测定。试验设置3次生物学重复,同时设常温对照(25±1)℃。
1.3 测定指标及方法
细胞膜伤害率=[(ET-ECK)/(100-ECK)]×100%
式中,ET为低温处理下样品的相对电导率,ECK为常温对照样品的相对电导率。
1.3.2糖含量测定 可溶性糖含量采用蒽酮比色法[13]测定;蔗糖和果糖含量参照刘丽杰[15]的方法测定。
1.3.3丙酮酸含量测定 丙酮酸(Pyruvic acid,Pyr)的提取和测定参照孟德义[12]的方法。
1.3.4己糖激酶活性测定 己糖激酶(Hexokinase,HxK)粗酶液的提取和测定参照Schaffer等[16]的方法。
1.3.5磷酸果糖激酶活性测定 磷酸果糖激酶(Phosphofructokinase,PFK)粗酶液的提取和测定参照Mustroph[17]的方法。
1.3.6丙酮酸激酶活性测定 丙酮酸激酶(Pyruvatekinase,PK)粗酶液的提取和测定参照孟德义[12]的方法。
1.3.7总RNA的提取及糖酵解关键酶调控基因表达分析 采用TIANGEN公司的RNAprep Pure植物总RNA提取试剂盒提取叶片总RNA,采用Solarbio公司的PrimeScriptTMII 1st Strand cDNA Synthesis Kit试剂盒反转录成cDNA。以反转录的cDNA为模板,肌动蛋白基因Actin为内参[18],用LightCycler 96实时荧光定量PCR仪进行实时荧光定量分析,试验设置3个重复。肌动蛋白基因(PpActin)、己糖激酶基因(PpHxK)、磷酸果糖激酶基因(PpPFK)和丙酮酸激酶基因(PpPK)的引物序列根据NCBI的同源序列进行比对,用Premier 6.0设计基因特异性引物(表1)。实时荧光定量PCR反应体系为20 μL,采用两步法扩增,反应条件为94℃预变性5 min,然后95℃变性15 s,60℃退火30 s,40个循环。用2-ΔΔCt法[19]计算各基因的相对表达量。
当选取合适的反应级数n时,对lnk*与1/T进行线性拟合,由直线的斜率和截距即可得到样品动力学参数E和A,实现动力学求解。

表1 qRT-PCR引物序列信息Table 1 Primer sequence information of qRT-PCR
1.4 数据分析
SPSS 20.0软件进行统计分析,采用单因素ANOVA进行分析处理,Duncan’s新复极差法进行显著性方差分析;采用Microsoft Excel 2010进行绘图与数据处理。
2 结果与分析
2.1 低温胁迫对相对电导率和细胞膜伤害率的影响
如图1A所示,随着低温胁迫的持续,PQ和PB的相对电导率不断上升,其中PB的相对电导率呈直线上升趋势,在胁迫120 h时较常温对照提高了3.53倍;PQ的相对电导率在整个低温胁迫时期均显著低于PB (P<0.05),且呈先上升后趋于平缓最后再上升的趋势,在120 h时与常温对照相比,仅提高了1.39倍。低温胁迫下,PQ和PB细胞膜伤害率的变化趋势和相对电导率相似(图1B),在120 h时PQ的细胞膜伤害率最大为28.02%,而PB最大为73.95%,是PQ的2.64倍。
2.2 低温胁迫对糖及丙酮酸含量的影响
2.2.1对可溶性糖含量的影响 如图2A所示,随着低温胁迫的持续,PQ和PB的可溶性糖含量均呈先上升后下降的趋势。PB在胁迫12 h时可溶性糖含量达到最大,较PB常温对照处理提高了0.44倍,12 h后逐渐降低;而PQ的可溶性糖含量在48 h时达到最大,较PQ常温对照处理提高了1.86倍,此后呈降低趋势,但整体维持在一个较高水平。总体来看,在整个低温处理过程中,PQ的可溶性糖含量均显著高于PB (P<0.05)。
2.2.2对蔗糖含量的影响 如图2B所示,低温胁迫下,PQ的蔗糖含量呈持续上升趋势,在72 h时达到最大,较PQ常温对照处理提高了2.29倍,随后呈下降趋势,但下降幅度较小;PB的蔗糖含量在低温胁迫下0~6 h时虽有提高,但提高幅度较小;6 h后PB的蔗糖含量显著提高(P<0.05),在24 h时达到最大值,较PB常温对照处理提高了51.68%,随后虽在72 h时有小幅度上升,但整体呈下降趋势。同时,PB的蔗糖含量在整个低温胁迫时期均显著低于PQ (P<0.05)。

图1 低温胁迫对两种早熟禾叶片相对电导率和细胞膜伤害率的影响Fig. 1 Effects of low temperature stress on relative conductivity and cell membrane injury rate of two bluegrass leaves注:同一胁迫时间下不同小写字母表示在0.05水平上差异显著。下同Note:Different lowercase letters in same stress time indicate significant difference at 0.05 level. The same as below
2.2.3对果糖含量的影响 如图2C所示,低温胁迫下0 ~ 6 h时,PQ的果糖含量虽有上升,但上升幅度较小;6 h后PQ的果糖含量显著提高(P<0.05),并随着低温胁迫的持续呈上升趋势,在72 h时达到最大值,较PQ常温对照处理提高了68.61%,随后呈下降趋势;PB的果糖含量随着低温胁迫的持续虽有所上升,但整体变化趋于平缓,在48 h时达到最大值,但仅较PB常温对照处理提高了8.38%。在整个低温处理过程中,PQ的果糖含量均显著高于PB (P<0.05)。
2.2.4对蔗糖和果糖总和占可溶性糖比例的影响 对PQ和PB在低温胁迫下蔗糖和果糖总和占可溶性糖比例进行分析发现(图2D),低温胁迫下0 ~ 3 h,PQ的蔗糖和果糖总和占可溶性糖比例呈下降趋势,3 h后呈上升趋势,并在12 h时达到第一个峰值,随后呈先降后升再降的趋势,在72 h时达到最大比例,为57.49%,较PQ常温对照的比例提高了25.83%;低温胁迫下,PB的蔗糖和果糖总和占可溶性糖比例在0 ~ 6 h时呈下降趋势,在6 h时达到最低,并显著低于PB常温对照(P<0.05);在6 ~ 24 h时呈上升趋势,24~48 h又下降,48 h后又呈上升趋势。总体来看,PB的蔗糖和果糖总和占可溶性糖的平均比例低于常温对照,也低于PQ。

图2 低温胁迫对两种早熟禾叶片糖含量的影响Fig.2 Effects of low temperature stress on sugar content of two bluegrass leaves
2.2.5对丙酮酸含量的影响 如图3所示,低温胁迫下0 ~ 6 h时,PQ的丙酮酸含量虽有上升但幅度较小,6 h后迅速上升,并在72 h时达到最大值,较PQ常温对照处理提高了46.43%,而在120 h时丙酮酸含量呈迅速下降趋势;与PQ相似,PB的丙酮酸含量在低温胁迫下0 ~ 6 h时虽有上升但幅度较小,随后上升幅度较大,在24 h时达到峰值,但仅较PB常温对照处理提高了9.99%,此后呈下降趋势。在整个低温处理过程中,除0 ~ 1 h时PB的丙酮酸含量略高于PQ外,其余时间下均显著低于PQ (P<0.05)。

图3 低温胁迫对两种早熟禾叶片丙酮酸含量的影响Fig. 3 Effects of low temperature stress on pyruvic acid content of two bluegrass leaves
2.3 低温胁迫对糖酵解途径关键酶活性的影响
2.3.1对己糖激酶活性的影响 由图4A可知,低温胁迫下0 ~ 1 h时,PQ的己糖激酶活性迅速升高,并在3 h时达到第一个峰值,在3 ~ 6 h时又呈下降趋势,6 h后又迅速升高,并在48 h时达最大值,较PQ常温对照处理提高了48.98%,此后呈下降趋势,但整体维持在一个较高水平;PB的己糖激酶活性随胁迫时间的延长呈先升后降的趋势,也在48 h时达最大值,较PB常温对照处理提高了13.26%。总体来看,PQ的己糖激酶活性在整个胁迫过程中均显著高于PB (P<0.05)。
2.3.2对磷酸果糖激酶活性的影响 由图4B可知,PQ的磷酸果糖激酶活性在低温胁迫下1 h内迅速上升,并随胁迫时间的延长持续上升,在120 h时达到最大值,此时较PQ常温对照处理提高了58.74%;PB的磷酸果糖激酶活性在0 ~ 12 h时呈上升趋势,并在12 h时达到最大,较PB常温对照处理提高了15.22%,此后随在72 h时有小幅上升,但整体呈下降趋势。在整个低温处理过程中,除0 h时PB的磷酸果糖激酶活性显著高于PQ (P<0.05)外,其余均显著低于PQ (P<0.05)。
2.3.3对丙酮酸激酶活性的影响 由图4C可知,PQ的丙酮酸激酶活性在低温胁迫下0 ~ 3 h时虽有上升,但上升幅度较小,3 h后显著升高,并在48 h时达最大值,较PQ常温对照处理提高了1.63倍,随后呈逐渐下降趋势;PB的丙酮酸激酶活性在低温胁迫下0 ~ 1 h时呈下降趋势,随后呈先升后降的趋势,在24 h时达到最大值,此时较PB常温对照处理提高了56.52 %,此后在72 h时迅速下降,并且其活性显著低于PQ常温对照(P<0.05)。同时,PB的丙酮酸激酶活性在整个低温胁迫时期均显著低于PQ (P<0.05)。
2.4 低温胁迫对糖酵解途径关键酶调控基因表达的影响
2.4.1对PpHxK表达变化的影响 由图5A可知,PQ的PpHxK相对表达量在低温胁迫处理0 ~ 1 h时迅速上调,到达第一个峰值,1 ~ 3 h时呈下降趋势,3 h时后又呈上调趋势,在6 ~ 12 h时迅速上调,至48 h时达到第二个峰值,此时PQ的PpHxK相对表达量较常温对照上调了2.53倍,此后呈逐渐下降趋势,72 ~ 120 h时降幅较大;PB的PpHxK相对表达量在低温胁迫下0 ~ 3 h时呈上升趋势,3 ~ 6 h小幅下降,6 h后总体呈上升趋势,在72 h时表达量最高,此时PB的PpHxK相对表达量仅较PB常温对照提高了0.17倍。总体来看,PQ的PpHxK相对表达量在整个胁迫过程中均显著高于PB (P<0.05)。
2.4.2对PpPFK表达变化的影响 由图5B可知,PQ的PpPFK相对表达量在低温胁迫开始时迅速上升,在3 h时到达第一个峰值,此时PpPFK相对表达量较常温对照上调了1.85倍;3 ~ 6 h时有小幅度下降,6 h后又呈上升趋势,在24 h时达到第二个峰值,此时PpPFK相对表达量较常温对照上调了2.47倍;72 h时达到第三个峰值,PpPFK相对表达量较常温对照上调了2.43倍,此后呈下降趋势;PQ的PpPFK相对表达量随胁迫的持续,呈先上升后下降的趋势,在6 h时达最大值,仅较PB常温对照上调了0.81倍,在120 h时达到最低,并显著低于PB常温对照(P<0.05)。而PQ的PpPFK相对表达量在整个胁迫过程中均显著高于PB (P<0.05)。
2.4.3对PpPK表达变化的影响 由图5C可知,随着低温胁迫的持续,PQ的PpPK相对表达量呈先上升后下降的趋势,在24 h时达到最大,此时PpPK相对表达量较PQ常温对照上调了2.06倍;PB的PpPK相对表达量随胁迫的持续呈先上升后下降再上升的趋势,在48 h时达最大,其相对表达量较PB常温对照仅上调了0.58倍。与PpHxK和PpPFK的相对表达量相似,PQ的PpPK相对表达量在整个胁迫过程中均显著高于PB (P<0.05)。
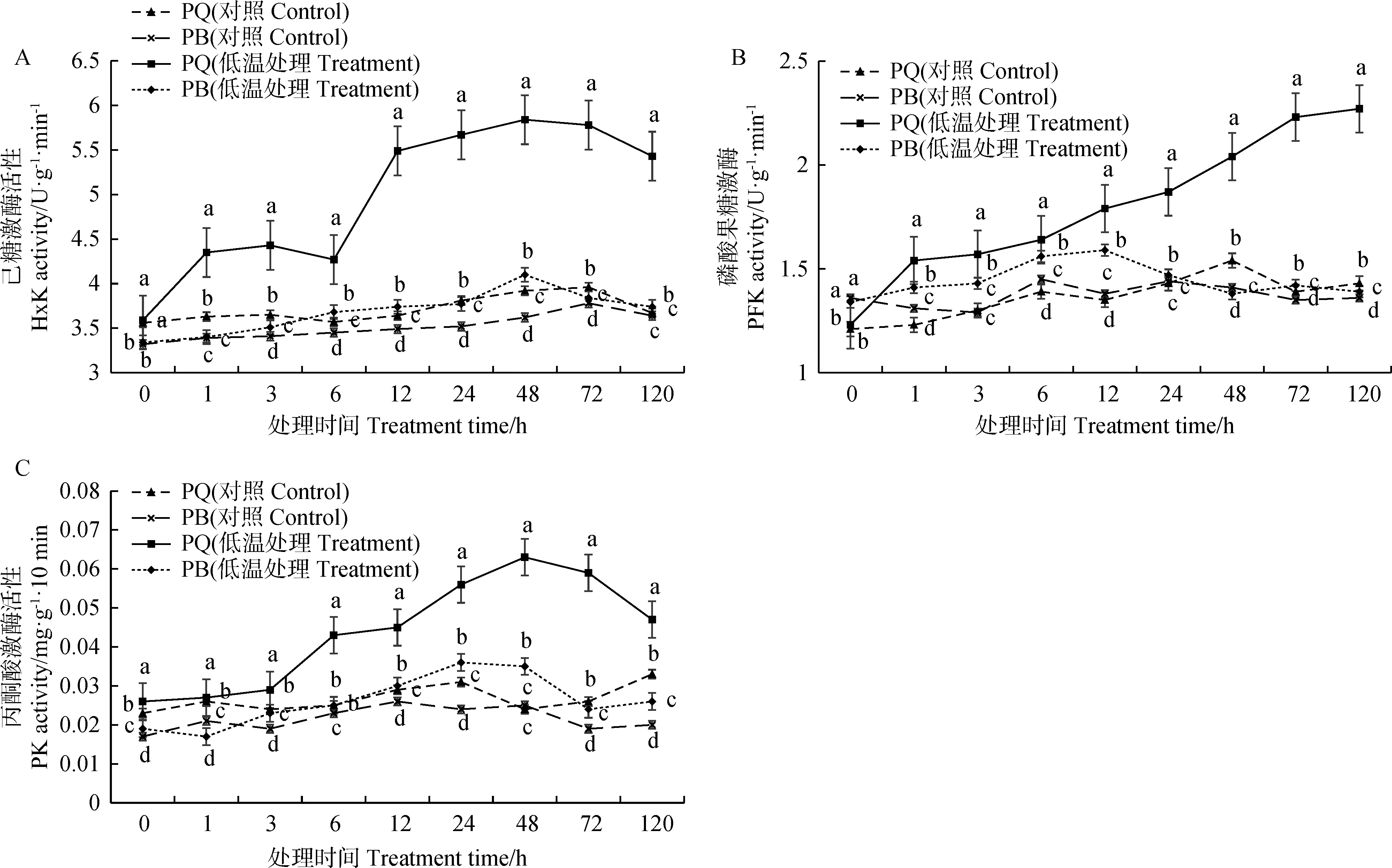
图4 低温胁迫对两种早熟禾叶片糖酵解途径关键酶活性的影响Fig.4 Effects of low temperature stress on the activities of key enzymes in glycolysis pathway of two bluegrass leaves
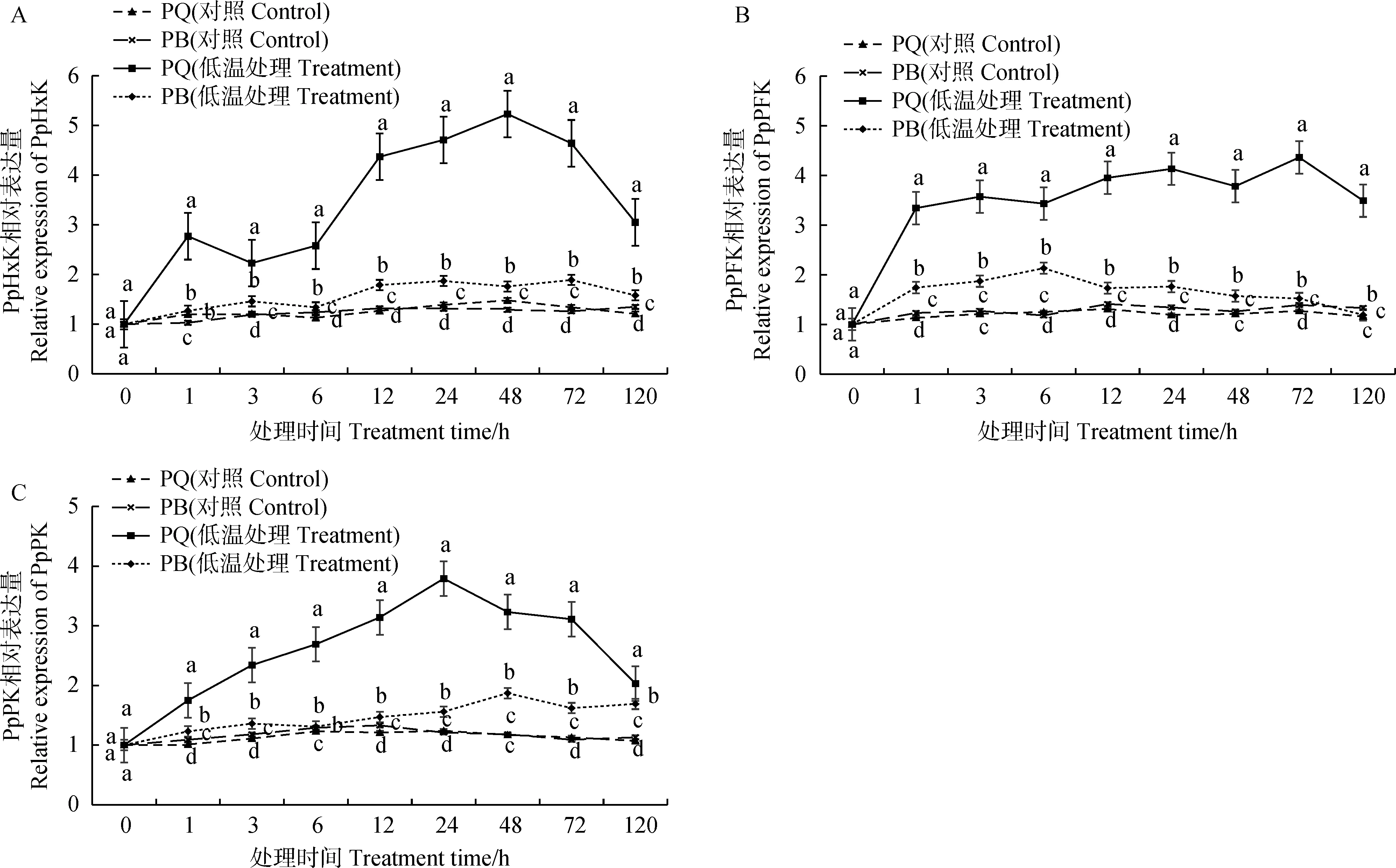
图5 低温胁迫对两种早熟禾叶片糖酵解途径关键酶编码基因表达的影响Fig.5 Effects of low temperature stress on the gene expression of key enzymes in glycolysis pathway of two bluegrass leaves
3 讨论
低温胁迫下,植物体内可溶性碳水化合物的含量增加,在一定程度上可以缓解低温对植物细胞的损伤。可溶性碳水化合物积累提高植物抗寒性的三个主要原因:一是通过糖类物质的代谢与积累提高植物渗透调节能力,保持低温胁迫下体内良好的水分状况;二是糖类物质能够有效保护生物膜及生物大分子物质的结构和活性;三是糖类物质的代谢与积累可以产生能源并为其他保护性物质提供合成基础[20]。在这些碳水化合物中可溶性糖含量与植物抗寒性关系最为密切,通常可溶性糖的积累可以提高植物的抗寒性[21]。本研究中,低温胁迫均会引起PQ(青海扁茎早熟禾)和PB(草地早熟禾‘巴润’)可溶性糖含量的升高,但PQ在整个胁迫过程中的含量以及较常温对照的上升幅度均高于PB,这也与PQ表现较强的抗寒性有直接关系。王淑杰等[22]对不同抗寒性的葡萄(Vitisvinifera)品种进行分析发现,抗寒性强的葡萄品种其可溶性糖含量均高于抗寒性弱的品种,但不同品种的可溶性糖含量随温度的降低均有上升,只是上升幅度存在差异,这与本研究结果相似。植物体内可溶性糖种类较多,不同种类的可溶性糖都可以参与调节生物膜系统的稳定性,但不同品种的植物在低温胁迫下积累的可溶性糖种类也存在较大差异,如拟南芥(Arabidopsisthaliana)在低温胁迫下积累较多的为棉子糖[23];小麦(Triticumaestivum)和黑麦(Secalecereale)幼苗中的蔗糖和果糖含量在低温胁迫下会迅速升高[24-25];而水稻(Oryzasativa)中阿拉伯糖、蔗糖和果糖含量会得到显著积累[26]。在本研究中,PQ和PB在低温胁迫开始时蔗糖含量就有显著升高,并且PQ的上升幅度显著高于PB,说明在整个胁迫过程中蔗糖的积累主要影响这两种早熟禾的抗寒性;而对于果糖,在低温胁迫初期,PQ中的含量上升幅度较小,直至后期才显著升高;在PB中的含量虽随低温胁迫的持续有所上升,但整体变化趋于平缓,说明果糖积累对PQ抗寒性的影响主要体现在后期,但对于PB的影响小于蔗糖。
糖酵解途径是呼吸代谢和糖分分解的一个重要过程,植物在逆境条件下需要消耗大量的能量来提高抗性,而能量主要在糖酵解途径产生,糖酵解途径中己糖激酶、磷酸果糖激酶和丙酮酸激酶是三种最关键的不可逆酶[27]。己糖激酶催化葡萄糖转化为6-磷酸葡萄糖,6-磷酸葡萄糖在己糖异构酶的作用下生成6-磷酸果糖,随后在磷酸果糖激酶作用下生成1,6-二磷酸果糖,最后在丙酮酸激酶作用下使磷酸烯醇式丙酮酸生成丙酮酸和ATP[28]。研究表明,低温胁迫下糖酵解途径中的这三种酶活性变化趋势在不同植物中并不相同[29]。曹玉芳等[30]研究发现,青檀(Pteroceltistatarinowii)中磷酸果糖激酶和丙酮酸激酶对低温较为敏感,经冷驯化后这两种酶活性的提高可以增强青檀对低温胁迫的适应性。但李霞等[31]研究发现,随温度的降低,甜樱桃(Prunusavium)糖酵解途径速率呈减低趋势。此外,Dioxon等[32]对马铃薯(Solanumtuberosum)块茎中糖酵解途径进行研究发现,马铃薯块茎中丙酮酸激酶和磷酸果糖激酶在低温贮藏条件下活性均显著降低,其中磷酸果糖激酶有较高的低温敏感性。而本研究发现,在低温初期,PQ的己糖激酶和磷酸果糖激酶活性均显著升高,而丙酮酸激酶活性在胁迫后期显著升高,三种酶总体呈先上升后下降的趋势;与PQ相同,PB的己糖激酶和磷酸果糖激酶活性虽也呈先升后降趋势,但上升幅度均小于PQ;同时,PB的丙酮酸激酶活性在低温胁迫初期较为敏感,呈下降趋势,而后期随低温胁迫时间的延长又呈先升后降的趋势,但其活性总体任低于PQ。糖酵解关键酶基因对低温胁迫的响应存在时间上的特异性,这种响应变化可能是植物对渗透胁迫期和渗透平衡恢复期分段适应的表现。本研究对调控这三种关键酶的基因表达情况分析发现,在低温胁迫下两种早熟禾的糖酵解关键酶基因的相对表达量均有提高,但不同时期表达量不同,而其中PQ中的相对表达量均显著高于PB,也说明PQ的糖酵解代谢能力强于PB。
4 结论
本研究表明,低温胁迫可以导致青海扁茎早熟禾和草地早熟禾‘巴润’叶片相对电导率和细胞膜伤害率的增加,但青海扁茎早熟禾的细胞膜损伤程度显著低于草地早熟禾‘巴润’。同时,低温胁迫均可引起两种早熟禾体内糖类代谢的变化,但整体来看,青海扁茎早熟禾中糖类及丙酮酸含量、糖酵解途径关键酶活性以及糖酵解途径关键酶基因的相对表达量均显著高于草地早熟禾‘巴润’。综上所述,低温环境下青海扁茎早熟禾能够有效调控糖酵解代谢途径来促进糖类及其相关物质的积累与分解,以调节植物因环境因素而引起的渗透势变化,并为植物体提供能量和次级代谢产物的合成前体。因此,青海扁茎早熟禾体内糖酵解代谢途径与其耐寒性存在一定关系。
