阿尔茨海默病早期网络功能障碍
2019-12-19编译凌寒
编译 凌寒
大脑中负责记忆和认知的区域中的β-淀粉样肽聚合体(Aβ)被认为会引发阿尔茨海默病(AD)。尽管有大量关于肽的神经生物学效应的研究,但是仍然有两个核心问题悬而未决:各种形态的Aβ都是人体主要的生物活性神经毒素吗?以及这些形态的Aβ是如何破坏神经功能的呢?迄今为止,尝试在临床上降低或消除人体内Aβ的尝试都未能明显减缓AD症状,若想开发成功的治疗方法可能需要这两个问题的答案。最近发表于《科学》杂志的一篇论文中,佐特(Zott)等人提供了令人信服的证据,该证据表明第一个问题的答案是可溶性Aβ二聚体,第二个问题的答案是当二聚体干扰细胞外谷氨酸的再摄取时,通过谷氨酸能神经元的超兴奋性破坏神经功能。
近期,在众多复杂的AD发病机制中,科学家发现选择性神经元过度活跃而产生毒性的过程,也就是这个微观精细电路调控过程影响认知损伤。实验室和临床研究越来越支持异常神经元激活在致病方面的重要影响力,包括部分AD患者发生癫痫。前驱(早期症状)AD人群的功能性磁共振成像(fMRI)展示了海马体和大脑皮层神经元的过度活动,这两处均为Aβ大量积累的地方。有关AD样Aβ沉积转基因小鼠模型的超兴奋性的分子基础研究表明了Aβ可溶性形态的关键作用,而Aβ可溶性形态与不溶性Aβ纤维沉积(淀粉样斑块)处在一个复杂的平衡中。
佐特等人利用双光子成像技术来量化钙和谷氨酸的瞬时变化,以此来衡量小鼠大脑中单个海马神经元的活动。小鼠包括野生型小鼠和转基因AD小鼠模型。这些简明的体内实验与体外小鼠海马体切片神经元过度活跃的验证性分析结果相一致。这两种方法均证明了,当可溶性人类Aβ二聚体(及其低聚物)注入海马体时,对基线谷氨酸能神经元的绝对需求即会触发后续的神经元过度活动。通过注入谷氨酸再摄取阻滞剂(TBOA),也能实现类似的过度活化。论文作者提出了大脑中Aβ介导的过度活化“恶性循环”这一概念:基线触发的谷氨酸能突触活动允许低毫微摩尔级浓度的可溶性Aβ二聚体(这些可溶性Aβ二聚体是他们从死于AD的患者的新皮质中分离出来的)阻止突触释放的谷氨酸通过星形胶质细胞和神经元的再摄取,导致突触周围谷氨酸积累和去极化增加,从而进一步建立过度活化(见“神经元过度活跃的恶性循环”)。
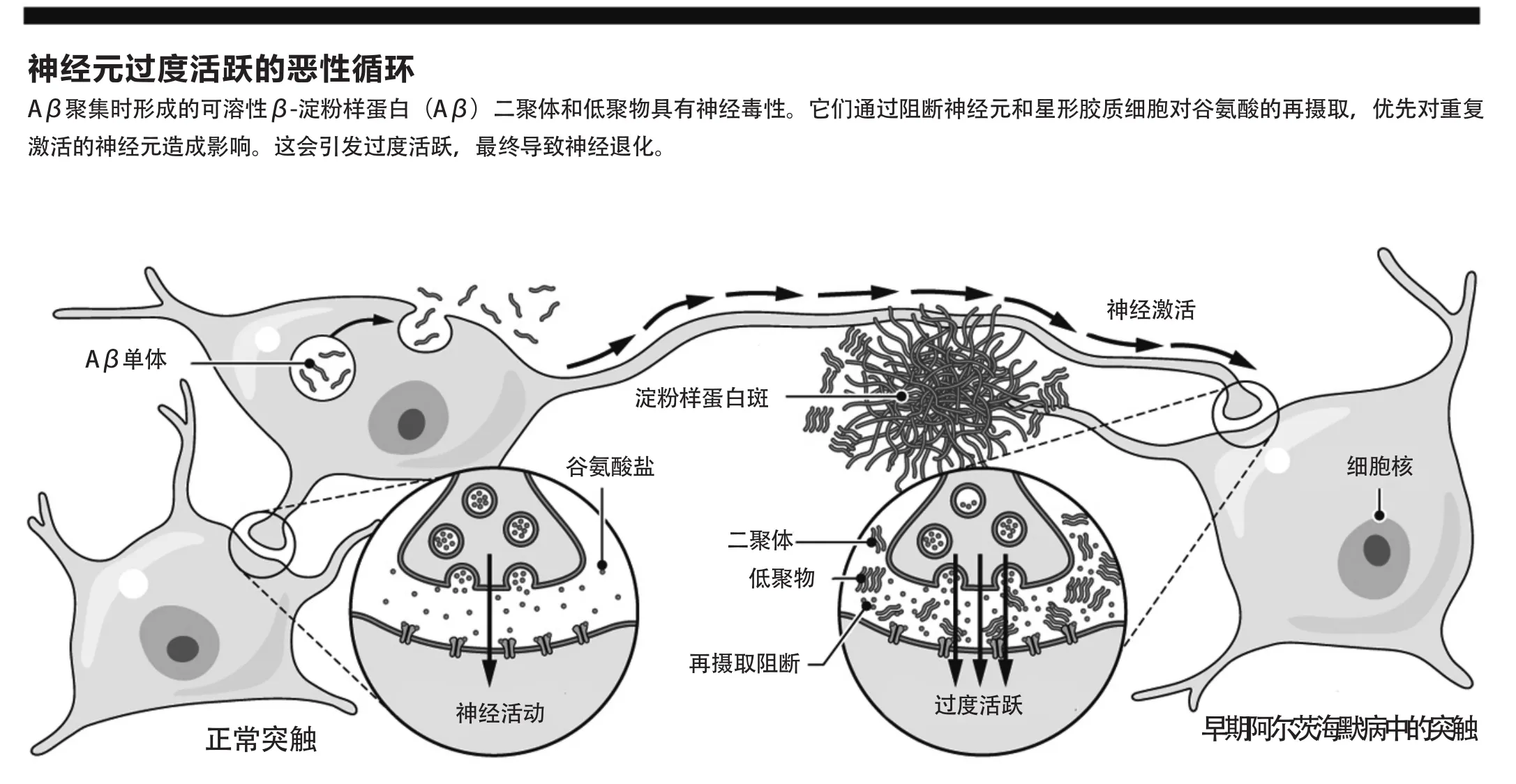
这种由可溶性Aβ寡聚物(可在AD中通过神经分泌Aβ单体形成额外神经元)造成的谷氨酸再吸收干扰,遵循野生型小鼠海马体切片于体外暴露在Aβ寡聚物时这一早期证据。佐特等人现在在活体大脑中对这一假设进行了验证,并证明了当局部的Aβ二聚体干扰谷氨酸再摄取时,在允许连续的超激活周期中,单个识别神经元的基线电活动程度的重要性。他们的发现与转基因小鼠淀粉样蛋白斑周围谷氨酸清除率迅速降低的成像结果一致,与早期在富含淀粉样蛋白斑的人类病患大脑皮层中发现的谷氨酸转运体缺陷的证据也一致。球状淀粉样蛋白斑已知被一团突触变更型可溶性Aβ寡聚物包裹。下一步的关键在于:在生化水平上准确地破译低聚体如何阻止谷氨酸进入局部星形胶质细胞和神经元,是通过疏水性、易聚集二聚体与质膜上的转运体直接结合,还是更有可能通过间接干扰谷氨酸的再摄取机制?
对AD进展中的人类遗传和生物标志物研究表明,Aβ稳态失衡——一种Aβ产生和清除之间的失衡,尤其是极易发生低聚反应的42-残基和43-残基——发生在突触修剪异常、神经营养不良增加、星形胶质细胞异常活化、正常可溶性τ蛋白聚集成神经元纤维缠结,以及由此导致的边缘皮质和新皮质的低代谢和结构萎缩之前。这一临床前过程的长期潜伏性可能解释了为什么在病理生物学级联反应后期(例如,在出现轻度认知症状时)给出抗淀粉样蛋白治疗,可能会减少不溶性淀粉样蛋白斑块的数量,但不会显著减缓临床进展的现象。佐特等人描述的过度活跃可能在致病性级联反应的早期就开始了,远远早于出现第一个明显的临床症状。
人们是否可以对AD中这种过量的谷氨酸能神经元放电进行特别的干预?谷氨酸拮抗剂美金刚(memantine)有时会被用于中度晚期AD患者,希望能够减少伴随晚期病程的异常行为,但这种药物的作用有限,可能是因为它的受体亲和力较低。在早期症状期使用更有效的谷氨酸拮抗剂可能会显示出更好的临床效果。同样的,头孢曲松钠等药剂能增加某些谷氨酸转运体的数量和功能活性,从而减轻症状。事实上,研究人员需加速研究找到更好的对症疗法,降低Aβ低聚物浓度或减少他们的继发性神经元后果(τ缠结)或炎症反应(小胶质细胞增生,星形细胞增生,以及外周单核细胞进入大脑)。
通过佐特等人的工作,对AD发病早期阶段的机制有了更进一步的了解,强调了我们要积极努力去识别和检测抗Aβ药剂,注意力要适当地转向以非淀粉样蛋白为基础的AD干预。对AD的转化研究不应局限于一个焦点:增加对这场巨大的个人和社会悲剧的公共和私人资助,使得几个关于AD发病机制假说的研究能够同时进行。人们在AD药物开发方面经历过深深的失望,但也得到了一些鼓励(例如,临床试验NCT03887455)。联合治疗策略在其他慢性多因素疾病如高血压、心血管疾病和癌症中已经存在了几十年,也将是AD研究的一个中心课题。
链 接
特殊病患出现,或启发阿尔茨海默病研究新思路

近期发表在《自然·医学》(Nature Medicine)上的一项研究称,在一位阿尔茨海默病女患者(大脑区域已发展出了阿尔茨海默症的主要神经学特征)体内发生了另一种基因突变,这一突变竟然保护了她的大脑,使其免受痴呆症的侵害。
研究人员发现,她大脑中淀粉样蛋白的含量是我们见过的患者中最高的,tau蛋白的含量很少。经研究发现该女士在一个称为APOE(载脂蛋白E,apolipoprotein E)的常见基因上具有极为罕见的突变,携带的两份APOE3都发生了名为基督城(Christchurch)的突变。这提示研究人员,APOE的突变可以发挥强大保护作用,或是解开谜题的一把钥匙。
