亚临界水提法提高甘薯皮可溶性膳食纤维得率
2019-12-19孟祥河戴建波陈剑兵夏其乐吴卫成
孟祥河,戴建波,曹 艳,陈剑兵,夏其乐,吴卫成
亚临界水提法提高甘薯皮可溶性膳食纤维得率
孟祥河1,戴建波1,曹 艳2,陈剑兵2,夏其乐2,吴卫成2※
(1. 浙江工业大学海洋学院,杭州 310014;2. 浙江省农业科学院食品科学研究所,杭州 310021)
为了提高甘薯加工副产物的利用率,以浙薯13品种甘薯皮为原料,采用亚临界水提取甘薯皮可溶性膳食纤维。在单因素试验的基础上选取料液比、提取温度、提取时间3个因素,应用正交试验对甘薯皮可溶性膳食纤维提取工艺条件进行优化,考察可溶性膳食纤维的物化性质,并以葡萄糖吸附能力、羟基自由基清除能力、DPPH自由基清除能力为指标,评价甘薯皮可溶性膳食纤维功能特性。结果表明,亚临界水提取甘薯皮可溶性膳食纤维得率为10.43%,比无辅助热水、超声和微波辅助提取法分别提高769.17%、27.04%和34.75%。亚临界水提取法中可溶性膳食纤维占总膳食纤维的比例最高(42.26%),比无辅助热水、超声和微波提取条件下分别提高665.58%、14.43%和19.24%。亚临界水法提取所得可溶性膳食纤维的葡萄糖吸附能力(4.79 mmol/g)、羟基自由基清除能力(54.28%)和DPPH自由基清除能力(69.28%)均高于无辅助热水、超声和微波辅助提取法所得可溶性膳食纤维,总膳食纤维的吸水膨胀性(7.89 mL/g)、持油性(4.74 g/g)和峰值黏度(27.18 mPa/s)显著高于其他方法所提取的总膳食纤维。
纤维;废弃物;提取;甘薯皮;亚临界水提取;物化特性;功能特性
0 引 言
甘薯是浙江省山区重要的旱粮作物,对保障农业增效,提高山区农民收入,有着重要的作用。近年来,甘薯除被加工成传统的粉丝和甘薯淀粉产品外,经油炸或蒸煮晒干制成的休闲食品甘薯干越来越受欢迎[1]。薯干加工过程中产生大量的甘薯皮,占总加工原料的20%~30%,虽然可作为动物饲料,但由于蛋白含量低、易酸败等缺点,利用率较低,仍有大部分被废弃[2]。因此,甘薯皮难以有效利用制约了甘薯全产业链的可持续发展[3]。
膳食纤维(dietary fiber,DF)是指具有抵抗人体小肠消化吸收,在人体大肠中能部分或全部发酵的可食植物性成分、碳水化合物及其类似物总和,包括多糖、低聚糖、木质素和相关的植物物质(蜡质、木栓脂等)[4]。膳食纤维具有可发酵性、持水持油性、促进肠胃蠕动、降低血液胆固醇等特点,被称为第七大营养素[5]。甘薯皮中含有丰富的纤维素、黄酮类化合物和多酚类化合物等成分[6],因此,可被用作提取膳食纤维的优质原料。膳食纤维的提取方法主要包括化学法、物理法和酶法。化学方法产生废水多、易有化学残留的安全隐患;酶法水解不完全、且成本高;随着工业化生产技术的发展,新型物理提取手段已经越来越多的投入到工业化生产中[7]。孙健等[3]利用超声辅助酶法提取甘薯渣膳食纤维,(SDF,soluble dietary fiber)/(TDF,total dietary fiber)值为34.44%。何国菊等[8]利用碱洗结合微波辅助提取马铃薯渣中的SDF,得率约为47.6%。超声和微波均是在常压下利用空化机械振动原理、水分局部迅速升温升压原理,加快细胞破碎,提高可溶物质溶出率,提高可溶性膳食纤维含量,且在甘薯膳食纤维提取中已有应用[9]。亚临界水提取法采用高温高压方式,将水加热至100~374 ℃(临界温度)的亚临界状态,水极性降低,使其对中低极性的化合物的溶解力增加,同时降低水的表面张力和黏度,高压则增加水对细胞的穿透性,加速胞内物质的溶出速度,具有高萃取效率、时间短、无残留的优点。亚临界水作为新兴提取方法已经较多的应用在提取中药精油、多酚、黄酮类物质[10],而在可溶性膳食纤维提取中应用近几年越来越多。张百胜等[11]采用亚临界水提取小麦麸皮SDF得率达到45.34%,较传统碱提取法提高2.96倍。刁春仁等[12]利用亚临界水提取藕渣中的SDF,得率较热水浸提法提高70.0%。Liu等[13]使用磷酸盐辅助亚临界水提取法从大豆皮中提取的SDF表现出更好的溶解性、黏度、体内降胆固醇活性。Klinchongkon等[14]利用亚临界水提取百香果果皮多糖得率达到21.0%,且所得多糖聚合度高(DP>7)。因此,亚临界水提取法是一种高效的SDF制备方法。
本研究利用亚临界水提取甘薯皮中的可溶性膳食纤维,并与常用的物理提取方法超声波和微波辅助提取方法对比,确定亚临界水提取甘薯皮可溶性膳食纤维的最优方法,并研究所得膳食纤维的物化和功能特性,对于提高甘薯皮利用率、解决污染、促进甘薯产业绿色、可持续发展具有重要意义[15]。
1 材料与方法
1.1 材料与设备
1.1.1 原料和试剂
甘薯皮(浙薯13品种甘薯削皮,皮厚约2~3 mm,清洗干净,50 ℃烘干至含水率5%以下,粉碎,过100目筛,备用)、耐高温-淀粉酶(麦克林)、淀粉葡萄糖苷酶(麦克林)、胰蛋白酶(麦克林)、95%乙醇、氢氧化钠、盐酸、1,1-二苯基-2-三硝基苯肼(DPPH·)、无水乙醇、硫酸亚铁、水杨酸、过氧化氢、抗坏血酸、葡糖糖、去离子水,以上试剂均为分析纯。偶联酶法葡萄糖含量试剂盒(购自苏州科铭生物技术有限公司)。
1.1.2 主要仪器
LDZF-30KB-Ⅱ型立式压力蒸汽灭菌锅(工作温度140 ℃,耐压0.30 MPa,工作原理:在排净空气后利用高温产生的水蒸气使釜内达到高温、无氧、低压的提取环境),上海申安医疗器械厂;FW200粉碎机,江苏省金坛市友联仪器研究所;LXJ-IIB离心机,上海安亭科学仪器厂;DHG-9146A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;WF-4000微波快速反应系统,上海屹尧分析仪器有限公司;KQ-500DB型数控超声波清洗器,昆山市超声仪器有限公司;Rheo3000流变仪,RheoTec Messtechnik GmbH;UV-1800紫外分光光度计,SHIMADZU岛津。
1.2 方 法
1.2.1 甘薯皮膳食纤维提取
将一定比例的蒸馏水加入甘薯皮粉中并充分搅拌至混合均匀,用不同物理方法提取。提取结束后冷却至室温,将pH值调节至6.0后,加入甘薯皮粉干质量2%的耐高温-淀粉酶、置于95 ℃的水浴锅中加热30 min,然后冷却至室温并调节pH值至4.5;再加入甘薯皮粉干质量1%的淀粉葡萄糖苷酶、置于60 ℃的水浴锅中加热30 min,取出冷却至室温并调节pH值至7.0;加入甘薯皮粉干质量0.1%的胰蛋白酶、于60 ℃水浴加热30 min,取出后冷却至室温,加入4倍体积95%乙醇静置24 h。去除上清液,将沉淀置于离心机中4 000 r/min离心20 min,将离心沉淀物取出冷冻干燥72 h,粉碎备用[16]。
1.2.2 膳食纤维含量的测定
参考Mccleary等[4]的酶质量法测定、利用公式(1)和(2)计算总膳食纤维(TDF)和可溶性膳食纤维(SDF)的含量和得率。
TDF得率(%)=TDF干质量×100/样品总干质量 (1)
SDF得率(%)=SDF干质量×100/样品总干质量 (2)
1.3 甘薯可溶性膳食纤维提取
将单因素试验设计为:设定提取时间15 min,温度120 ℃,考察料液比1:10、1:20、1:30和1:40条件下SDF的提取率;设定料液比1:20,时间30 min,考察提取温度110、120、130和140 ℃对SDF提取率的影响;设定料液比1:20,温度120 ℃,考察提取时间15、30、45、和60 min对SDF得率的影响[17]。
1.4 亚临界水提取法正交优化试验
根据单因素试验结果,以SDF提取率为指标,将料液比、提取时间、提取温度做L9(33)正交试验(表1),对试验结果进行极差分析,确定最佳提取工艺条件。

表1 L9(33)正交试验因素水平表
用于比较的无辅助热水提取、微波辅助提取和超声辅助提取按照同样方法在单因素试验基础上利用正交设计优化得到最佳提取条件[16]。
1.5 膳食纤维的物化性质测定
1.5.1 膳食纤维的持水性测定
根据Zhu等[18]的方法,称取1.0 g样品()到50 mL离心管中,加入20 mL蒸馏水震荡均匀,于室温下溶胀12 h至溶液饱和,此时SDF并未完全溶解但已充分溶胀,4 000 r/min离心20 min,除去上清饱和液,并用吸水纸除去管壁上残留的水,记录样品湿质量(1),利用公式(3)计算持水力。
持水力(g/g)=1/(3)
1.5.2 膳食纤维的吸水膨胀性测定
根据Zhu等[18]的方法,称取1.0 g样品()于25 mL量筒中,读取初始体积(1),加入足量蒸馏水后振荡均匀,室温下溶胀24 h,记录量筒内终体积(2),利用公式(4)计算膨胀力。
膨胀力(mL/g)=(2−1)/(4)
1.5.3 膳食纤维的持油性测定
根据Gouw等[19]的方法,称取1.0 g样品()到50 mL离心管中,加入40 mL植物油震荡摇匀,于室温下漩涡震荡3 h,4 000 r/min离心20 min,除去上清液,并用吸油纸除去管壁上的残留液体,记录湿质量(1),利用公式(5)计算持油力。
持油力(g/g)=1/(5)
1.5.4 膳食纤维的流变学特性测定
根据Feng等[20]的方法适当修改,称取1.0 g样品于容器中,准确加入10 mL蒸馏水,室温溶胀24 h,配置成10%的多糖溶液。使用旋转斜坡测量块模式,时间120 s,速度1~1 000 r/min,采集60个数据点。
1.5.5 膳食纤维的葡萄糖吸附能力测定
参考梅新[21]的方法并略做修改。将甘薯皮膳食纤维中的小分子糖除去后,取1.0 g样品,加入100 mL葡萄糖溶液(100 mmol/L),室温溶胀12 h,4 000 r/min离心20 min,上清液中葡萄糖含量用偶联酶法葡萄糖含量试剂盒测定。
1.6 膳食纤维的抗氧化性质测定
1.6.1 膳食纤维的羟基自由基(•OH)清除能力测定
参考Liu等[22]的方法略作修改,取1 mL配置好的浓度为10 mg/mL的样品溶液,加入浓度为9 mmol/L的水杨酸-乙醇溶液1 mL、浓度为9 mmol/L硫酸亚铁溶液1 mL和蒸馏水6 mL,充分混合摇匀后,加入8.8 mmol/L双氧水溶液1 mL,于37 ℃水浴锅中反应40 min,在510 nm处测定吸光度,以蒸馏水为空白,利用公式(6)计算自由基清除率。
清除率(%)=[−(1−0)]×100/(6)
式中为空白对照吸光度值;1为样品吸光度值;0为蒸馏水替代双氧水吸光值。
1.6.2 膳食纤维的DPPH自由基清除能力测定
采用Zhu等[23]的方法测定。
1.7 统计学分析
每组试验数据做3次平行并表示为平均值±标准偏差,利用SPSS 20.0进行显著性分析,Origin 2017软件绘图。
2 结果与分析
2.1 亚临界水提取法单因素试验结果
SDF得率随着提取温度的升高呈先增加后下降的趋势,当温度为120 ℃时,达到最高9.35%,当温度继续增加时,SDF得率下降(图1a)。由图1b可知,提取时间为30 min时SDF得率为最大值9.63%,继续延长时间到45 min时SDF得率略有下降,当提取时间继续增加,下降速率增大,60 min时SDF提取率为最低值。如图C所示,随着料液比的逐渐增大,SDF得率也不同程度的增大,料液比从1:10到1:20时SDF得率的增长率最高,料液比为1:20时SDF的提取率为8.7%,料液比为1:40时SDF的提取率为9.55%,然而料液比从1:30到1:40的增长率却最低,且大大增加了后续处理难度。通过比较不同提取条件对甘薯皮中SDF提取率的影响,发现随着提取温度和时间的延长,SDF得率并没有增长反而降低,可能是过高的温度和过长的时间使溶出的大分子多糖部分分解,因此,提取温度不宜过高、时间不宜过长[24]。
2.2 正交优化亚临界水提取膳食纤维
从表2的极差分析结果可以看出,各因素对亚临界水提取法提取SDF得率的影响顺序为料液比>时间>温度。根据均值结果选出最优提取方案为222,即料液比1:30、温度120 ℃、时间30 min[25]。由于该方案不在所列方案中,因此在该条件下进行3次平行验证试验,SDF得率为10.43%,总膳食纤维得率为24.68%(占原料)。正交优化结果表明,料液比是影响SDF提取率的最重要因素,当提取溶剂太少时,甘薯皮中的淀粉不能充分溶解糊化,致使提取体系黏度过高,影响了可溶性多糖的溶出[26],随着提取溶剂继续增加,SDF提取率却不再继续增加,反而增加了后续步骤的处理成本,因此溶剂添加量不宜过大。曹媛媛[27]利用机械筛分法从甘薯渣中获得SDF,得率为2.66%,本研究利用亚临界水提取法比其提高2.92倍。

注:a中固定料液比1:20,提取时间30 min;b中固定料液比1:20,提取温度120 ℃;c中固定提取时间15 min,提取温度120 ℃。
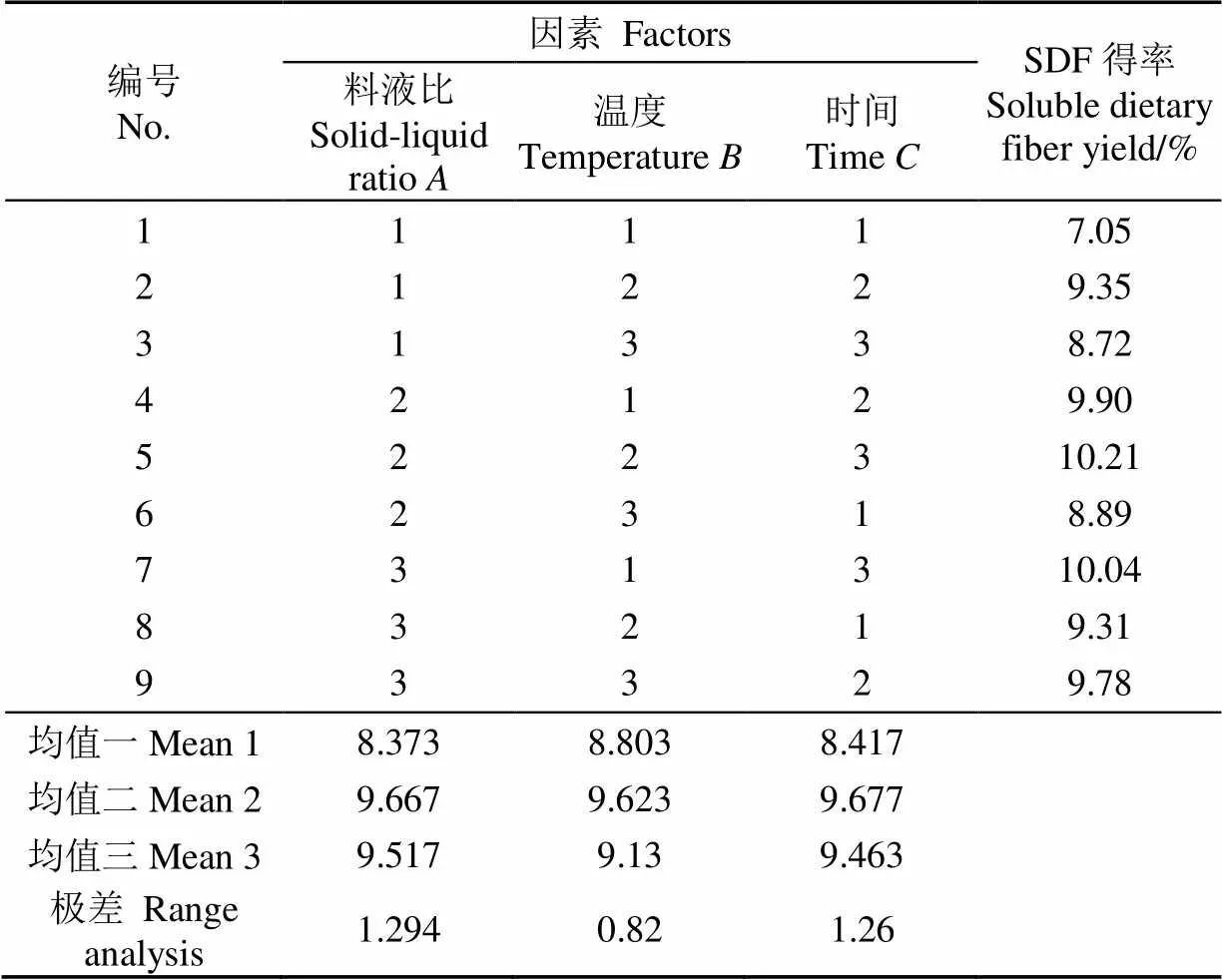
表2 亚临界水提取法正交设计和极差分析
2.3 不同物理提取甘薯皮膳食纤维得率比较
按照同样的方法,对无辅助热水、超声辅助提取和微波辅助提取条件进行正交试验分析,结果表明无辅助热水提取最优条件为料液比1:25、60 ℃、3 h,超声辅助提取最优条件为料液比1:30、70 ℃、提取功率400 W、30 min,微波辅助提取最优条件为料液比1:30、100 ℃、提取功率500 W、6 min。按照各自最优条件提取,超声辅助提取SDF得率为8.21%,微波辅助提取SDF得率为7.74%,而亚临界水提取法分别比这2种方法提高27.04%和34.75%,比无辅助热水提取法高出7.69倍,且亚临界水提取法中SDF/TDF值最高,比超声和微波提取法分别提高14.43%和19.24%,比无辅助热水提取高出6.66倍(表3)。此外,除亚临界水提取法外,其他方法对TDF的得率均无显著影响。
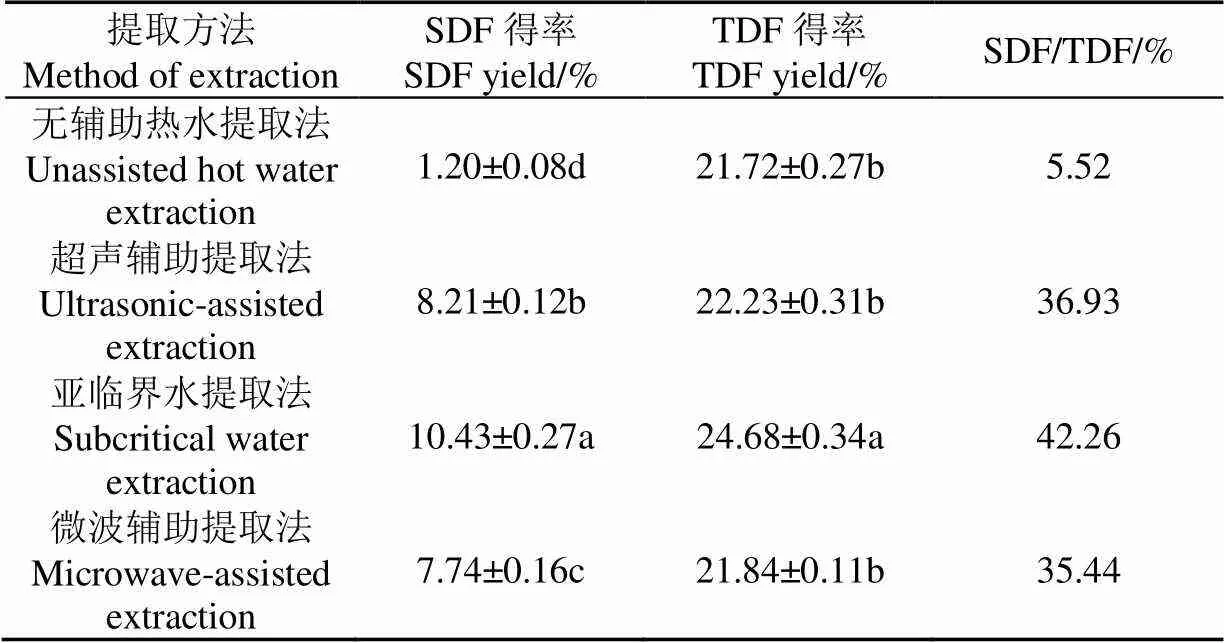
表3 亚临界水与超声、微波辅助提取条件下SDF得率比较
注:不同字母a、b、c表示差异显著(<0.05),相同字母则表示差异不显著(>0.05),下同。
Note: Different letters a, b and c indicate significant differences (<0.05), and the same letters indicate that the difference is not significant (>0.05), the same below.
2.4 亚临界水提取甘薯皮膳食纤维物化特性研究
2.4.1 亚临界水提取法对膳食纤维持水性的影响
持水力是指膳食纤维在外力作用下,保持水分的能力,人体摄入的膳食纤维由于持水作用,在肠道内形成高黏度的凝胶,延长胃排空,产生饱腹感,有非常好的减肥作用[28]。如图2a所示,不同物理提取法所得膳食纤维中,亚临界水提取的SDF持水性为4.83 g/g,显著优于超声辅助和无辅助热水提取法(<0.05),与微波辅助提取法没有显著差异。不同提取方法所得TDF持水性存在显著差异,微波法最高、其次为亚临界水提取法。研究表明,挤压蒸煮提高TDF中SDF含量的同时也提高了TDF的水合能力,因为挤压蒸煮处理能够有效增加TDF化学结构中亲水基团的外露[29]。在梅新[21]的研究中,冀薯98号的膳食纤维持水力为3.54 g/g,亚临界水提取的TDF持水性比其提高85.59%。
2.4.2 亚临界水提取法对膳食纤维吸水膨胀性影响
吸水膨胀性是指膳食纤维通过氢键和偶极子来吸收水分,使体积膨胀的能力。由图2b可知,不同提取方法所得SDF的吸水膨胀性均无显著性差异(>0.05);而不同方法提取的TDF吸水膨胀性显著差异,以亚临界水提取法最好,达到7.89 mL/g,相比超声和微波提取法分别提高99.24%和21.76%,比无辅助热水提高约48.31倍。
2.4.3 亚临界水提取法对膳食纤维持油性的影响
膳食纤维中的亲脂基团的数量决定了膳食纤维持油能力,持油性越高,则膳食纤维吸收食物中油脂的能力越高,也代表膳食纤维降低血液中胆固醇的能力越高,这对维持人体肠道健康有非常积极的作用[30]。由图2c可知,亚临界水提取法所得SDF的持油性并没有显著提高,且与超声和微波辅助提取法所得SDF的持油性相差不大。而亚临界水提取法所得TDF的持油性提升最为显著(4.74 g/g),比无辅助热水提取法、超声辅助提取法和微波辅助提取法所得TDF的持油性提高约1.5倍。
2.4.4 亚临界水提取法对膳食纤维流变学特性的影响
膳食纤维的流变学特性在食品加工应用领域具有非常重要的意义。从图2d中可知,SDF的峰值黏度均高于TDF的峰值黏度,而不同提取方法所得SDF之间没有显著差异,根据已有的研究报道,SDF的黏度通常与其来源和浓度密切相关[26]。亚临界水、超声和微波3种提取法所得的TDF的峰值黏度较无辅助热水提取均有显著提高(<0.05),且亚临界水提取(27.18 mPa/s)>超声提取(24.54 mPa/s)>微波提取(22.83 mPa/s)>无辅助热水提取(14.61 mPa/s)。
2.4.5 亚临界水提取法对膳食纤维葡萄糖吸附能力影响
膳食纤维的体外葡萄糖吸附能力是考察膳食纤维功能特性的一项重要指标。图2e结果显示,SDF的葡萄糖吸收能力显著高于TDF,且亚临界水提取法所得SDF的葡萄糖吸收能力最强,达到4.79 mmol/g,比无辅助热水、超声和微波提取法分别提高25.72%、13.78%和54.02%。亚临界水、超声辅助和微波辅助3种物理提取法所得TDF的葡萄糖吸收能力无显著性差异,但均显著高于无辅助热水提取法。黄六容等[31]通过超声改性大蒜秸秆不溶性膳食纤维将其葡萄糖吸附能力提升至4.72 mmol/g。阮传英等[32]发现,大豆豆渣中的SDF比不溶性组分表现出更强的葡萄糖吸附能力和NO2-吸附能力,同时SDF的浓度越高黏度也越高,与本文结果一致。在Yan等[33]研究中,通过新型喷砂工艺提高了麦麸膳食纤维中SDF含量,同时葡萄糖吸附能力也显著提高,因为SDF能够有效降低葡萄糖的扩散速率,形成的网状结构也能够将小分子物质截留,因此推断葡萄糖吸附能力可能与SDF的比例有关。
2.5 亚临界水提取甘薯皮膳食纤维抗氧化能力的比较
2.5.1 亚临界水提取法对膳食纤维羟基自由基(•OH)清除能力影响
羟自由基是活性最强的氧自由基,它可与活细胞中的任何分子发生反应而造成损伤,而且反应速度极快,被破坏的分子遍及糖类、氨基酸、磷脂、核苷和有机酸等[34]。如图3所示,SDF的羟基自由基清除能力高于TDF的羟基自由基清除能力,亚临界水提取SDF的羟基自由基清除率比无辅助热水、超声和微波提取法分别提高1.99、0.14和1.73倍,所得TDF的羟基自由基清除率同样显著高于其他方法的TDF,分别提高3.70、0.39和2.85倍。周小理等[35]发现经膨化改性的水溶性苦荞麸皮膳食纤维的羟自由基清除能力为58.81%。亚临界水提取会改变膳食纤维的网状结构,从而使包裹在膳食纤维内部或基质中的多酚类物质释放出来,从而具有抗氧化活性[36]。赵丽等[37]的研究结果表明,通过超声、微波等处理方式提取得到鲜食豆荚SDF的羟基自由基清除能力优于不溶性膳食纤维。从图3中可看出,亚临界水提取所得SDF的羟基自由基清除能力大约是TDF的2倍,显著高于其他方法所得的SDF,可能是亚临界水提取所得的膳食纤维中的糖醛酸分子含有大量活跃羟基,能够与羟自由基结合从而清除自由基[38]。
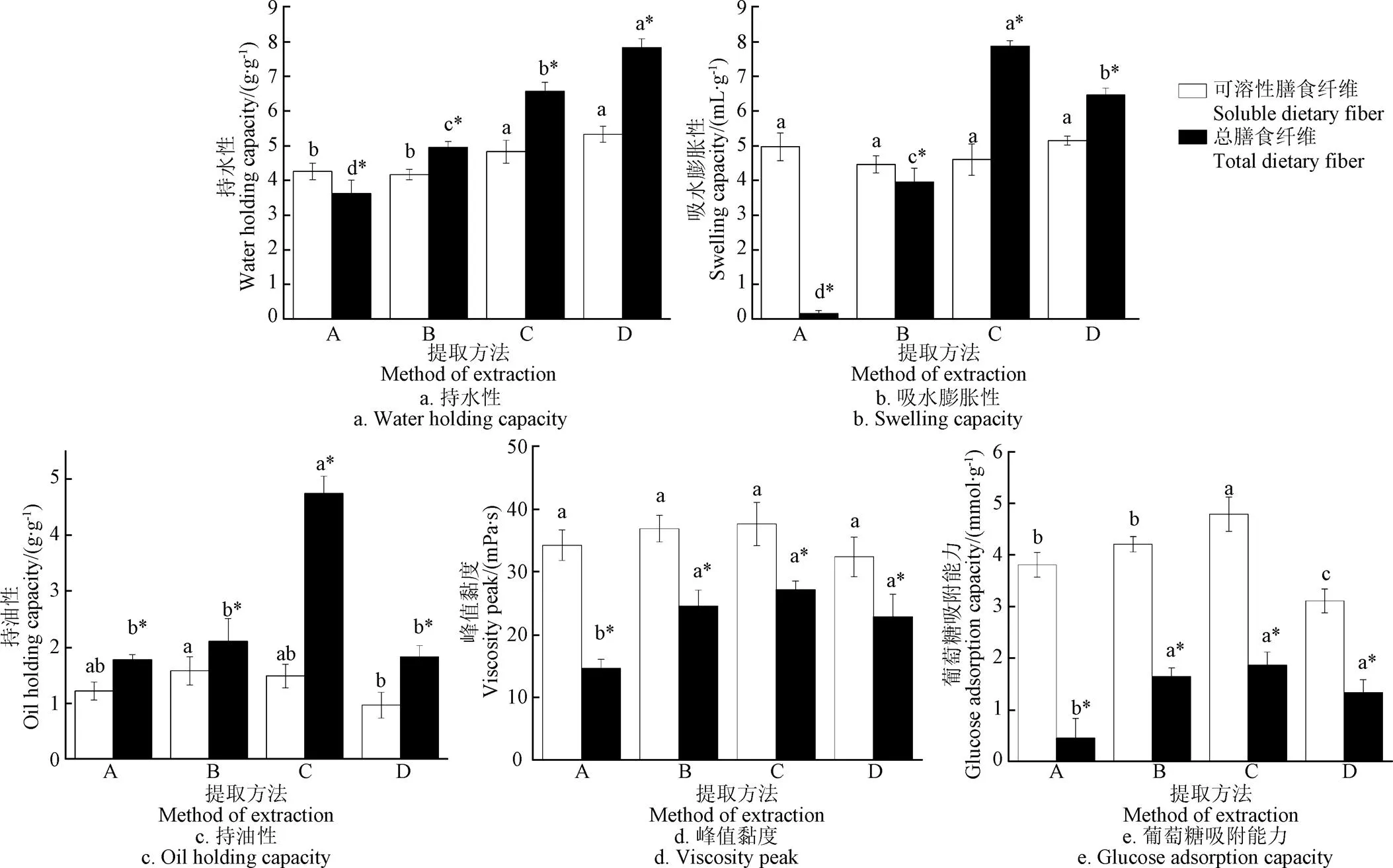
注:A为无辅助热水提取法;B为超声辅助提取法;C为亚临界水提取法;D为微波辅助提取法,*代表总膳食纤维组,下同。
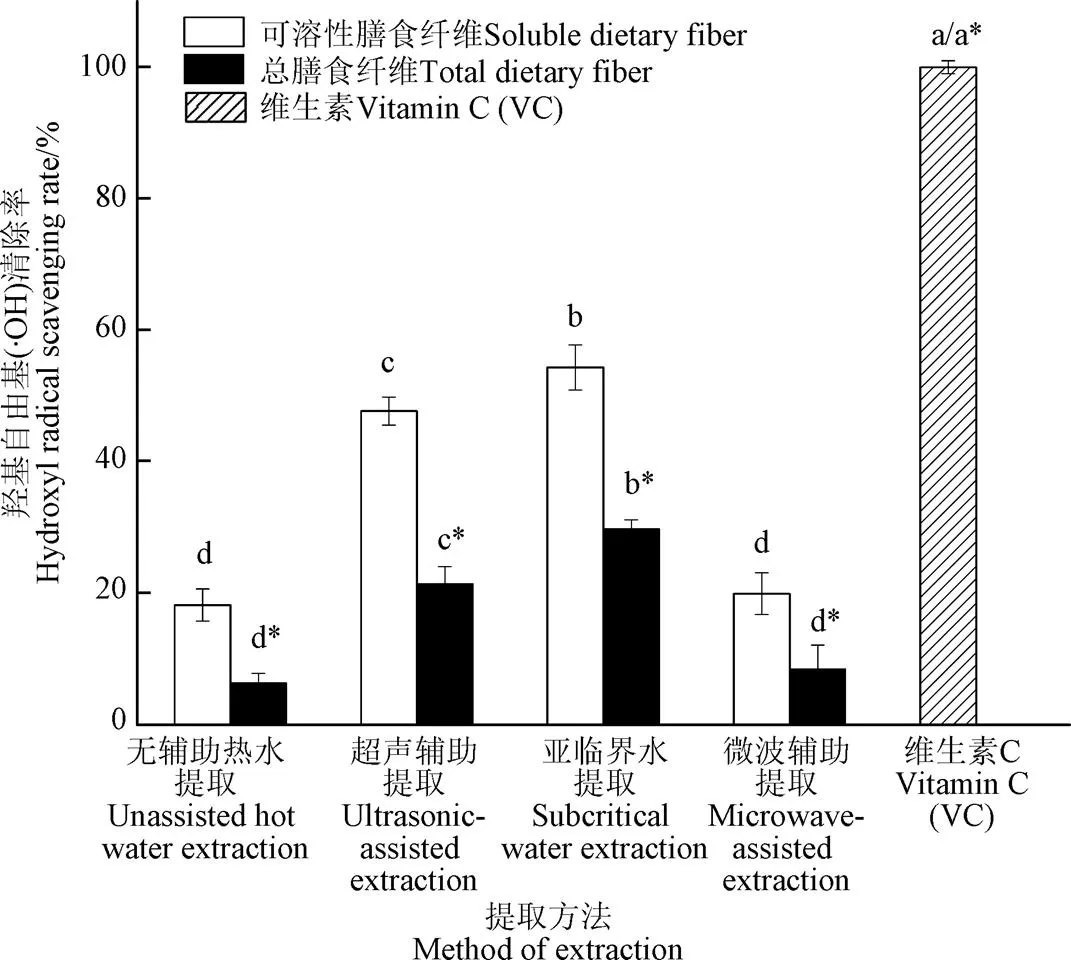
图3 亚临界水与其它提取法对甘薯皮膳食纤维羟基自由基清除率的影响
2.5.2 亚临界水提取法对膳食纤维DPPH自由基清除能力影响
从图4可知,随着溶液浓度的升高,SDF和TDF对DPPH自由基的清除能力都呈现出先增大后趋于平缓的趋势,当浓度为14 mg/mL时,亚临界水提取的SDF对DPPH自由基的清除能力最高(72.46%),显著高于超声辅助和无辅助热水提取所得SDF(<0.05);亚临界水提取所得TDF的DPPH自由基清除能力比无辅助热水提取法显著提高47.38%,比超声和微波辅助提取方法所得TDF的DPPH自由基清除能力分别提高9.0%和30.55%。石秀梅等[39]对比了柠檬皮渣、脐橙皮渣和小麦麸皮的抗氧化能力,发现柠檬皮渣的DPPH自由基清除能力最高,为56.32%。Wiboonsirikul等[40]用亚临界水从豆渣中提取多糖,发现多糖的DPPH自由基清除能力其中所含的酚类物质和可溶性多糖含量有关,且当温度高于240 ℃后,DPPH自由基清除能力下降。图4中SDF和TDF的DPPH自由基清除能力与浓度呈正相关,且亚临界水提取的SDF在DPPH自由基清除能力上显著高于其他方法,TDF也显著高于无辅助热水处理。普遍认为抗氧化剂清除DPPH自由基是由于它们的供氢能力,而分子量较大且具有较小分支的多糖结构具有较强的供氢能力[41]。

注:不同字母α、β和γ表示差异显著(P<0.05),相同字母则表示差异不显著(P>0.05)。
3 结 论
通过比较亚临界水和常用的超声和微波辅助提取条件下甘薯皮SDF的提取率,确定亚临界水提取为甘薯皮SDF的最适提取方法,即料液比1:30、温度120 ℃、时间30 min,SDF得率为10.43%,其中料液比是影响SDF得率的主要因素。
亚临界水提取法中SDF的葡萄糖吸附能力(4.79 mmol/g)、羟基自由基清除能力(54.28%)和DPPH自由基清除能力(69.28%)均高于无辅助热水、超声和微波辅助提取法的SDF;TDF的吸水膨胀性(7.89 mL/g)、持油性(4.74 g/g)和峰值黏度(27.18 mPa/s)显著高于其他方法所提取的TDF,同时亚临界水提取法SDF/TDF值(42.26%)也最高。
亚临界水法提取法无污染、效率高,具有一定的应用推广前景。此外,不同提取方法所得甘薯皮SDF和TDF的特性差异较大,可能与其中多糖物质的种类差异有关,后期可通过分析不同提取条件下甘薯皮粉微结构变化、SDF分子量和结构特征差异,探究甘薯皮SDF功能特性与其微观结构特征的相关性,为进一步提高甘薯皮利用率和附加值提供参考。
[1] 李雁,熊明洲,尹丛林,等. 红薯渣不溶性膳食纤维超高压改性[J]. 农业工程学报,2012,28(19):270-278.
Li Yan, Xiong Mingzhou, Yin Conglin, et al. Modification of insoluble dietary fiber from sweet potato residue with ultra high pressure processing technology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(19): 270-278. (in Chinese with English abstract)
[2] 张启堂,陈其恒,曹健生,等. 甘薯粉渣的营养成分含量及再利用研究[J]. 农业科学与技术(英文版),2015,16(11):2543-2545.
Zhang Qitang, Chen Qiheng, Cao Jiansheng, et al. Study on contents of nutritional ingredients and reutilization of sweet potato starch residue[J]. Agricultural Science & Technology, 2015, 16(11): 2543-2545. (in Chinese with English abstract)
[3] 孙健,钮福祥,岳瑞雪,等. 超声波辅助酶法提取甘薯渣膳食纤维的研究[J]. 核农学报,2014,28(7):1261-1266.
Sun Jian, Niu Fuxiang, Yue Ruixue, et al. Extraction of dietary fiber from sweet potato residues by enzymatic hydrolysis method assisted by ultrasonic technology[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(7): 1261-1266. (in Chinese with English abstract)
[4] Mccleary B V, Sloane N, Draga A, et al. Measurement of total dietary fiber using AOAC method 2009.01 (AACC International Approved Method 32-45.01): Evaluation and updates[J]. Cereal Chemistry, 2013, 90(4): 396-414.
[5] 王世清,于丽娜,杨庆利,等. 超滤膜分离纯化花生壳中水溶性膳食纤维[J]. 农业工程学报,2012,28(3):278-282.
Wang Shiqing, Yu Lina, Yang Qingli, et al. Purification of water soluble dietary fiber (SDF) from peanut hull using ultrafiltration[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(3): 278-282. (in Chinese with English abstract)
[6] Mei X, Mu T H, Han J J. Composition and physicochemical properties of dietary fiber extracted from residues of 10 varieties of sweet potato by a sieving method[J]. Journal of Agricultural and Food Chemistry, 2010, 58(12): 7305-7310.
[7] 阚茗铭,叶发银,赵国华. 成熟度对甘蓝膳食纤维单糖组成及抗氧化活性的影响[J]. 食品科学,2017,38(5):70-75.
Kan Mingming, Ye Fayin, Zhao Guohua. Effect of maturity on monosaccharide composition and antioxidant activity of cabbage dietary fiber[J]. Food Science, 2017, 38(5): 70-75. (in Chinese with English abstract)
[8] 何国菊,常艳菊,龙峰. 超微粉碎结合微波辅助提取马铃薯渣中可溶性膳食纤维[J]. 食品工业,2017(2):159-163.
He Guoju, Chang Yanju, Long Feng. Study on extracting soluble dietary fiber by phytate solution with super comminution and microwave from potato residue[J]. The Food Industry, 2017(2): 159-163 (in Chinese with English abstract)
[9] 丁宏伟. 超声波结合微波辅助提取米糠多糖的研究[J]. 核农学报,2013,27(3):329-333.
Ding Hongwei. Research on extracted quantity of rice bran polysaccharide processed by microwave and ultrasonic wave[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(3): 329-333. (in Chinese with English abstract)
[10] Ko M J, Cheigh C I, Chung M S. Relationship analysis between flavonoids structure and subcritical water extraction (SWE)[J]. Food Chemistry, 2014, 143(1): 147-155.
[11] 张百胜,陈海霞,张娟梅. 亚临界水法提取麸皮可溶性膳食纤维工艺优化[J]. 食品研究与开发,2014(14):50-53.
Zhang Baisheng, Chen Haixia, Zhang Juanmei. Optimization of subcritical water extraction process of soluble dietary fiber from wheat bran[J]. Food Research and Development, 2014(14): 50-53. (in Chinese with English abstract)
[12] 刁春仁,张海晖,李亚群,等. 藕渣中可溶性膳食纤维的亚临界水萃取[J]. 食品工业,2018,39(8):35-39.
Diao Chunren, Zhang Haihui, Li Yaqun, et al. Extraction of soluble dietary fiber from lotus root dregs by subcritical water[J]. The Food Industry, 2018, 39(8): 35-39. (in Chinese with English abstract)
[13] Liu C, Lin X L, Wan Z, et al. The physicochemical properties, in vitro binding capacities and in vivo hypocholesterolemic activity of soluble dietary fiber extracted from soy hulls[J]. Food & Function, 2016, 7(12): 4830-4840.
[14] Klinchongkon K, Khuwijitjaru P, Wiboonsirikul J, et al. Extraction of oligosaccharides from passion fruit peels by subcritical water treatment[J]. Journal of Food Process Engineering, 2017, 40(1): e12269
[15] 王晓梅,木泰华,孙红男,等. 3种不同破碎方式提取甘薯膳食纤维的物化功能性质比较研究[J]. 食品科技,2013(8):207-212.
Wang Xiaomei, Mu Taihua, Sun Hongnan, et al. Comparative on physico-chemical properties and functional properties of sweet potato dietary fiber extracted by three different crushing processe[J]. Food Science and Technology, 2013(8): 207-212. (in Chinese with English abstract)
[16] Jeddou K B, Chaari F, Maktouf S, et al. Structural, functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels[J]. Food Chemistry, 2016, 205: 97-105.
[17] 赵力超,于荣,刘欣,等. 大米抗性淀粉制备工艺优化及特性分析[J]. 农业工程学报,2013,29(12):277-285.
Zhao Lichao, Yu Rong, Liu Xin, et al. Preparation technology optimization and characteristic analysis of rice resistance starch[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(12): 277-285. (in Chinese with English abstract)
[18] Zhu Y, Chu J, Lu Z, et al. Physicochemical and functional properties of dietary fiber from foxtail millet () bran[J]. Journal of Cereal Science, 2018, 79: 456-461.
[19] Gouw V P, Jung J, Zhao Y. Functional properties, bioactive compounds, and in vitro gastrointestinal digestion study of dried fruit pomace powders as functional food ingredients[J]. Food Science and Technology, 2017, 80: 136-144.
[20] Feng Z, Dou W, Alaxi S, et al. Modified soluble dietary fiber from black bean coats with its rheological and bile acid binding properties[J]. Food Hydrocolloids, 2017, 62: 94-101.
[21] 梅新. 甘薯膳食纤维、果胶制备及物化特性研究[D]. 北京:中国农业科学院,2010.
Mei Xin. Characterization of Dietary Fiber and Pectin Extraction From Sweet Potato[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010. (in Chinese with English abstract)
[22] Liu Y, Zhou Y, Liu M, et al. Extraction optimization, characterization, antioxidant and immunomodulatory activities of a novel polysaccharide from the wild mushroom Paxillus involutus[J]. International Journal of Biological Macromolecules, 2018, 112: 326-332.
[23] Zhu H, Tian L, Zhang L, et al. Preparation, characterization and antioxidant activity of polysaccharide from spentsubstrate[J]. International Journal of Biological Macromolecules, 2018, 112: 976-984.
[24] 崔珊珊,木泰华,孙红男,等. 超高压下酶解处理对甘薯蛋白乳化特性的影响[J]. 核农学报,2016,30(6):1117-1125.
Cui Shanshan, Mu Taihua, Sun Hongnan, et al. Effect of enzymatic treatment under high hydrostatic pressure on the emulsifying properties of sweet potato protein[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(6): 1117-1125. (in Chinese with English abstract)
[25] 陈立宇,张秀成. 试验设计与数据处理[M]. 西安:西北大学出版社,2014.
[26] Iida Y, Tuziuti T, Yasui K, et al. Control of viscosity in starch and polysaccharide solutions with ultrasound after gelatinization[J]. Innovative Food Science and Emerging Technologies, 2008, 9(2): 140-146.
[27] 曹媛媛. 甘薯膳食纤维的制备及其物化特性的研究[D]. 乌鲁木齐: 新疆农业大学,2007.
Cao Yuanyuan. Study on Preparation and Physicochemical Properties of Dietary Fiber of Sweet Potato[D]. Urumqi: Xinjiang Agricultural University, 2007. (in Chinese with English abstract)
[28] Wang H, Hong T, Li N, et al. Soluble dietary fiber improves energy homeostasis in obese mice by remodeling the gut microbiota[J]. Biochemical and biophysical research communications, 2018, 498(1): 146-151.
[29] Zhong L, Fang Z, Wahlqvist M L, et al. Extrusion cooking increases soluble dietary fibre of lupin seed coat[J]. LWT, 2019, 99: 547-554
[30] Yu G, Bei J, Zhao J, et al. Modification of carrot (a. Linn. var. Sativa Hoffm.) pomace insoluble dietary fiber with complex enzyme method, ultrafine comminution, and high hydrostatic pressure[J]. Food Chemistry, 2018, 257: 333-340.
[31] 黄六容,陈甜,赵匀淑,等. 超声波改善大蒜秸秆不溶性膳食纤维结构及吸附性[J]. 农业工程学报,2018,34(12):294-299.
Huang Liurong, Chen Tian, Zhao Yunshu, et al. Improvement on structure and adsorption of insoluble dietary fiber from garlic straw induced by ultrasound[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(12): 294-299. (in Chinese with English abstract)
[32] 阮传英,涂宗财,王辉,等. 豆渣膳食纤维的体外吸附性能[J]. 食品科学,2014,35(15):109-112.
Ruan Chuanying, Tu Zongcai, Wang Hui, et al. In vitro adsorption capacity of dietary fibers from soybean dregs[J]. Food Science, 2014, 35(15): 109-112. (in Chinese with English abstract)
[33] Yan X, Ye R, Chen Y. Blasting extrusion processing: The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J]. Food Chemistry, 2015, 180: 106-115.
[34] 钟希琼. 大薯膳食纤维的提取及其对自由基的清除作用[J]. 食品科学,2010,31(24):139-141.
Zhong Xiqiong. Extraction of dietary fiber from big yam and its scavenging capability on free radicals[J]. Food Science, 2010, 31(24): 139-141. (in Chinese with English abstract)
[35] 周小理,钱韻芳,周一鸣,等. 不同处理工艺对苦荞麸皮膳食纤维体外抗氧化活性的影响[J]. 食品科学,2011,32(8):1-4.
Zhou Xiaoli, Qian Yunfang, Zhou Yiming, et al. Effect of different processing methods on in vitro antioxidant properties of dietary fiber from tartary buckwheat bran[J]. Food Science, 2011, 32(8): 1-4. (in Chinese with English abstract)
[36] 赵明慧,吕春茂,孟宪军,等. 苹果渣水溶性膳食纤维提取及其对自由基的清除作用[J]. 食品科学,2013,34(22):75-80.
Zhao Minghui, Lü Chunmao, Meng Xianjun, et al. Extraction of soluble dietary fiber from apple pomace and its scavenging capacity against free radicals[J]. Food Science, 2013, 34(22): 75-80. (in Chinese with English abstract)
[37] 赵丽,宋一茉,朱丹实,等. 不同提取方法对鲜食大豆荚膳食纤维抗氧化特性的影响[J]. 食品工业科技,2015,36(20):155-158.
Zhao Li, Song Yimo, Zhu Danshi, et al. Effect of different extraction methods on antioxidant properties of dietary fiber from vegetable soybean pods[J]. Science and Technology of Food Industry, 2015, 36(20): 155-158. (in Chinese with English abstract)
[38] 于丽娜,孙杰,刘少芳,等. 花生抗氧化水解产物制备及其抗氧化活性研究[J]. 核农学报,2013,27(2):188-196.
Yu Lina, Sun Jie, Liu Shaofang, et al. Preparation and antioxidant activities of peanut antioxidant hydrolysate[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(2): 188-196. (in Chinese with English abstract)
[39] 石秀梅,雷激,梁爱华,等. 3种来源膳食纤维抗氧化特性比较[J]. 食品科技,2013(1):71-75.
Shi Xiumei, Lei Ji, Liang Aihua, et al. Comparison of antioxidant properties among there dietary fibers[J]. Food Science and Technology, 2013(1): 71-75. (in Chinese with English abstract)
[40] Wiboonsirikul J, Mori M, Khuwijitjaru P, et al. Properties of extract from okara by its subcritical water treatment[J]. International Journal of Food Properties, 2013, 16(5): 974-982.
[41] Villaño D, Fernández-Pachón M S, Moyá M L, et al. Radical scavenging ability of polyphenolic compounds towards DPPH free radical[J]. Talanta, 2007, 71(1): 230-235.
Increasing yield of soluble dietary fiber from sweet potato peel by using subcritical water extraction
Meng Xianghe1, Dai Jianbo1, Cao Yan2, Chen Jianbing2, Xia Qile2, Wu Weicheng2※
(1310014,; 2310021,)
Sweet potato is an important economic crop growing in mountainous area of Zhejiang Province. Sweet potato was processed into traditional vermicelli and starch products, and dried sweet potato becomes more and more popular in recent years. Sweet potato peels is one of the main by-products during dried sweet potato processing, and it accounts for 20%-30% of the total fresh material. Only a small amount of sweet potato peels is used as animal feed because of low protein content, and the majority is dumped in the trash, leading to environmental pollution and waste of resources which restricts the sustainable development of the sweet potato industry chain. Therefore, improving the utilization rate of sweet potato peels is an urgent problem. Dietary fiber is known as the seventh nutrient with the characteristics of fermentability, water and oil retention, promoting gastrointestinal motility and lowering blood cholesterol. On the other hand, subcritical water extraction has the advantages of high efficiency, environmental protection and convenient operation as an emerging physical extraction method. In order to utilize sweet potato peels effectively, soluble dietary fiber (SDF) was extracted from sweet potato (Zheshu 13) peels by subcritical water. Effect of solid-liquid ratio, extraction temperature and extraction time on SDF yield was investigated, and orthogonal application was used to optimize the extraction conditions of SDF from sweet potato peels based on the individual factor experiment. The physicochemical properties of SDF and total dietary fiber (TDF) were evaluated by water holding capacity, swelling capacity, oil holding capacity, peak viscosity and glucose adsorption capacity. The functional properties of sweet potato peels SDF and TDF were evaluated by hydroxyl radical scavenging rate and DPPH radical scavenging activity. Meanwhile, the extraction yield and all the above properties of SDF and TDF extracted by subcritical water were compared with those under other extraction conditions (hot water extraction, ultrasonic-assisted extraction and microwave-assisted extraction). The results showed that the influence of subcritical water extraction factors on SDF yield was in the order of solid-liquid ratio>extraction time>extraction temperature, and SDF yield reached to 10.43% under the optimal extraction condition (the solid-liquid ratio 1:30, 120 ℃, 30 min), which was 769.17%, 27.04% and 34.75% higher than that in the cases of unassisted hot water extraction, ultrasonic-assisted extraction and microwave-assisted extraction respectively. The ratio of SDF in TDF (SDF/TDF) reflects the quality of TDF and it was the highest when subcritical water extraction was adopted (42.26%), which was 665.58%, 14.43% and 19.24% higher than that in the cases of unassisted hot water extraction, ultrasonic-assisted extraction and microwave-assisted extraction. The glucose adsorption capacity (4.79 mmol/g), hydroxyl radical scavenging capacity (54.28%) and DPPH free radical scavenging capacity (69.28%) of SDF extracted by subcritical water were higher than that extracted by unassisted hot water, ultrasonic-assisted extraction and microwave assisted-extraction. The swelling capacity (7.89 mL/g), oil holding (4.74 g/g) and peak viscosity (27.18 mPa/s) of TDF extracted by subcritical water were significantly higher than those under the other extraction conditions. However, there was no significant difference in the swelling capacity and the peak viscosity for SDF extracted by different methods. The results of this study will provide a theoretical basis for effective utilization of byproduct during sweet potato processing, and it will be a reference for further research on subcritical water in the field of dietary fiber extraction.
fiber; residues; extraction; sweet potato peels; subcritical water extraction; physicochemical properties; functional properties
孟祥河,戴建波,曹 艳,陈剑兵,夏其乐,吴卫成. 亚临界水提法提高甘薯皮可溶性膳食纤维得率[J]. 农业工程学报,2019,35(20):303-310.doi:10.11975/j.issn.1002-6819.2019.20.037 http://www.tcsae.org
Meng Xianghe, Dai Jianbo, Cao Yan, Chen Jianbing, Xia Qile, Wu Weicheng. Increasing yield of soluble dietary fiber from sweet potato peel by using subcritical water extraction[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(20): 303-310. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.20.037 http://www.tcsae.org
2019-05-11
2019-09-26
浙江省基础公益研究计划项目(LGN18C200030);浙江省农业科学院地方科技合作项目(LS2017012)
孟祥河,教授,博士,博士生导师,主要从事植物蛋白工程与营养功能因子研究。Email:mengxh@zjut.edu.cn
吴卫成,副研究员,主要从事农副产品综合利用研究。Email:wu_wc@sina.com
10.11975/j.issn.1002-6819.2019.20.037
TS215
A
1002-6819(2019)-20-0303-08
