TGFBR3错义突变与先天性心脏病遗传关联性研究
2019-12-19王红艳
吕 昕 王红艳, 张 斌
世界范围内平均每1 000个新生儿中有9个先天性心脏病(CHD)患儿[1]。CHD也是中国最常见的出生缺陷疾病之一,根据《中国出生缺陷防治报告(2012年)》,2011年CHD在中国的发生率为4.1%。
上皮-间充质转化(EMT)是心脏发育中一个重要环节,其对心脏瓣膜的形成、心脏心房和心室的间隔、心肌的生长和冠状动脉血管的形成均非常重要[2]。例如,心内膜细胞的EMT过程产生心脏瓣膜前体细胞,参与瓣膜的形成[3-5];心外膜细胞通过EMT过程,参与心肌细胞谱系的发生,参与心肌生长、冠状动脉血管生成以及心脏间质细胞的生成[6-8]。
转化生长因子β(TGF-β)信号通路在心脏发育的EMT过程中起着重要作用[9-11]。TGF-β有TGFBR1、TGFBR2和TGFBR3共3个受体。TGFBR3又称β-glycan。TGFBR3可通过胞内域与TGFBR1或TGFBR2形成蛋白复合物,抑制TGF-β信号通路活性[12]。TGFBR3胞外域包含两个与TGF-β配体具有很高的亲和性的结合域[13-15]。TGFBR3胞外域可以被细胞膜表面的蛋白酶切割释放到基质与基质中的TGF-β结合,从而减少TGF-β与TGFBR1/2的结合,拮抗TGF-β的作用[16]。TGFBR3是参与心脏发育和先天性心脏病发生的重要基因。TGFBR3纯合敲除小鼠在胚胎期13.5 d时呈现冠状动脉血管发育异常,在胚胎期14 d时冠状动脉血管形成失败,最终在14.5 d时小鼠死亡,这一时间正是有功能的冠状动脉血管对心脏发育和胚胎发育起作用的时间[17]。但是,目前关于TGFBR3在人类CHD中的作用尚未见报道。本研究旨在寻找CHD疾病特异性的TGFBR3基因突变位点,并初步验证其对基因功能的影响。
1 方法
1.1 伦理 本研究经过复旦大学生命科学学院伦理委员会批准[伦研批第(216)号]。研究对象的临床信息及血液样本采集均获得父母或监护人的书面知情同意,并严格遵守赫尔辛基宣言的各项规定。
1.2 研究对象 本研究病例组CHD患儿和对照组健康儿童的来源、CHD的亚型分类同文献[18]。
1.3 DNA测序和生物信息学分析 病例组和对照组外周静脉血基因组DNA的抽提方法以及TGFBR3基因的编码区靶向测序方法和测序公司等与文献[18]相同。测序结果参考hg19/GRCh37(NM_001202)版本对单核苷酸变异(SNV)进行注释,并经基因组进化速率评测(GERP)分析位点的保守性[19, 20]。筛选得到CHD特异突变后,应用以下3个公共数据库检测突变频率:千人基因组(1KG,http://www.1000genomes.org),the Exome Aggregation Consortium(ExAC, http://exac.broad-institute.org)和GnomAD (http://gnomad.broadinstitute.org)。再使用Sanger测序方法对相应样本的突变位点进行验证。突变有害性预测使用SIFT[21](http://sift.jcvi.org/)和PolyPhen-2[22](http://genetics.bwh.harvard.edu/pph/)软件。TGFBR3蛋白保守性分析参考UniProt数据库(https://www.uniprot.org/align/A)。
1.4 质粒构建和点突变 从HEK293T细胞(中科院典型培养物保藏委员会细胞库)中提取总RNA(中国天根生化科技有限公司总RNA提取试剂盒),反转录得到cDNA(中国天根生化科技有限公司FastQuant cDNA第一链合成试剂盒),再经PCR反应(扩增引物序列见表1引物1)扩增得到野生型TGFBR3编码序列,克隆到pGEM-T-Easy载体上(美国Promega公司),并通过PCR的方法定点突变获得突变型TGFBR3(点突变引物序列见表1引物2~4)。分别将野生型和突变型TGFBR3编码序列克隆至pCMV6-AC-GFP(美国Origene公司)表达载体。

表1 扩增引物序列
1.5 细胞培养与转染 HEK293T细胞用含有10%胎牛血清的DMEM(美国Gibico)在5% CO2,37℃的条件下进行培养。使用Lipo2000转染试剂(美国Thermofisher公司),遵照Lipo2000使用手册进行转染。
1.6 Western-blot实验 HEK293T细胞转染野生型或突变型TGFBR3表达质粒,转染后24 h收取细胞,使用RIPA试剂裂解细胞。细胞总蛋白上样,经过电泳、转膜、免疫反应和显影,然后使用ImageJ软件对显影结果进行灰度分析,计算并统计结果。免疫反应抗体anti-tGFP(美国Origene公司,1∶3 000稀释),anti-ACTIN(美国Origene公司,1∶5 000稀释),羊抗鼠二抗[艾比玛特生物医药(上海)有限公司,1∶10 000稀释],具体实验方法参考文献[18]。
1.7 双荧光素酶报告基因实验 在24孔板培养HEK293T细胞,长至60%密度,使用Lipo2000分别共转染等量的(300 ng)的野生型或突变型TGFBR3表达质粒或不等量(设置梯度:100 ng, 150 ng, 200 ng, 250 ng, 300 ng)的野生型或突变型TGFBR3表达质粒以及200 ng TGF-β信号通路报告基因质粒pGMSMAD-Lu(吉满生物科技(上海)有限公司)和10 ng内参Rellina基因pRL-TK质粒(美国Promega公司)。转染后24 h,使用双荧光素酶报告实验系统(美国Promega公司)检测荧光素酶活性,统计并计算结果。
1.8 无血清条件下双荧光素酶报告基因实验 实验发现血清影响最终的荧光素酶检测结果。在24孔板培养HEK293T细胞,长至60%密度时换液,即将旧的含血清培养基换成新的无血清的DMEM培养基,然后开始进行转染实验。使用Lipo2000分别共转染300 ng的野生型或突变型TGFBR3表达质粒以及200 ng TGF-β信号通路报告基因质粒pGMSMAD-Lu(吉满生物科技(上海)有限公司),10 ng内参Rellina基因pRL-TK质粒(美国Promega公司),其他同1.7。
1.9 统计学方法 蛋白质免疫印迹实验结果利用Image J软件进行灰度分析。灰度分析结果以及双荧光素酶报告基因实验结果都采用双尾非配对t检验分析显著性,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 本研究病例组404例,对照组213名,病例组年龄(2.9±2.7)岁,对照组年龄(7.1±3.7)岁;病例组和对照组的男女比例分别为1.2∶1和1∶1。CHD的亚型分类同文献[8]。
2.2TGFBR3基因新发现/稀有突变的鉴定TGFBR3基因外显子的深度靶向测序分析发现3个独立存在的CHD特有的突变:TGFBR3c.2054A>G(p.K685R)、TGFBR3c.2372C>T(p.A791V)和TGFBR3 c.2410G>T(p.A804S),以下分别简称为TGFBR3K685、TGFBR3A791V和TGFBR3A804S。Sanger测序进一步验证显示这3个突变均为杂合突变(图1A)。与千人基因组(1KG),ExAC和GnomAD等数据库数据比较结果显示:TGFBR3K685R在三个数据库中均未有报道,属于新发突变,而TGFBR3A791V和TGFBR3A804S是在亚洲人群中未有报道的稀有突变(GnomAD数据库中在总人群中突变频率分别为3.18×10-5和7.96×10-6),并且被预测为有害突变(表2)。突变TGFBR3K685R位于蛋白胞外Zona Pellucida结构域(ZP domain),突变TGFBR3A791V和TGFBR3A804S位于跨膜结构上(图1B)。3个突变处编码对应的氨基酸在脊椎动物中高度保守(图1C)。
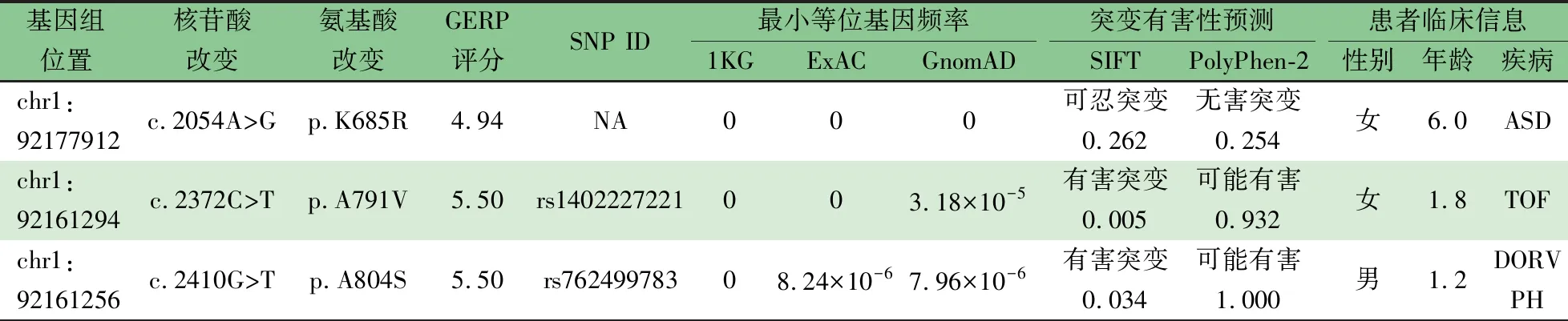
表2 携带TGFBR3稀有错义突变患者的基因型与临床信息
注 GERP:基因组进化速率评测,1 KG:千人基因组数据库,GenomAD:基因组聚集数据库,ASD:房间隔缺损,TOF:法洛四联症,DORV:右心室双出口,PH:肺动脉高压,NA:无数据
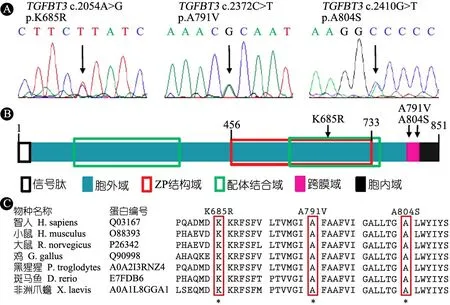
图1 先天性心脏病特异的新发现/稀有的TGFBR3错义突变
注 A:3个突变的一代测序结果图,箭头分别指示突变的位置;B:TGFBR3蛋白结构示意图,箭头分别指示3个突变在蛋白上的位置;C:人和其他部分脊椎动物TGFBR3氨基酸序列的部分比对,红框表示突变氨基酸的位置
2.3 突变TGFBR3K685R和TGFBR3A804S导致TGFBR3蛋白表达水平下降 Western Blot结果(图2A)显示,与野生型TGFBR3蛋白相比较,突变TGFBR3K685R和TGFBR3A804S的蛋白水平显著下降,而突变TGFBR3A791V的蛋白水平差异无统计学意义。
2.4 突变TGFBR3K685R、TGFBR3A791V和TGFBR3A804S导致TGFBR3对TGF-β信号通路的抑制作用降低。
2.4.1 图2B显示,HEK293T细胞转染等量突变型和野生型TGFBR3过表达质粒,相比空载对照组,野生型TGFBR3对TGF-β信号通路的应答有显著的抑制作用,突变TGFBR3A791V和TGFBR3A804S对TGF-β信号通路的抑制作用与野生型TGFBR3相似,但是突变TGFBR3K685R则部分丧失了对TGF-β信号通路的抑制作用。
2.4.2 图2C显示,为了排除细胞培养基中胎牛血清对实验的干扰,在转染HEK293T细胞前用无血清培养基替换含有血清的培养基,并转染等量的野生型和突变型过表达质粒,与野生型TGFBR3比较,3种突变蛋白TGFBR3K685R,TGFBR3A791V和TGFBR3A804S对TGF-β信号通路的抑制作用均显著降低。
2.4.3 图2D显示,通过调节突变型TGFBR3表达质粒的转染量,使被转染的HEK293T细胞中表达的突变型和野生型TGFBR3蛋白水平相似,这时与空载对照组比较,野生型TGFBR3对TGF-β信号通路有显著抑制作用,突变TGFBR3A791V和TGFBR3A804S对TGF-β信号通路的抑制作用与野生型TGFBR3相似,而突变TGFBR3K685R对TGF-β信号通路的抑制作用还是显著降低。
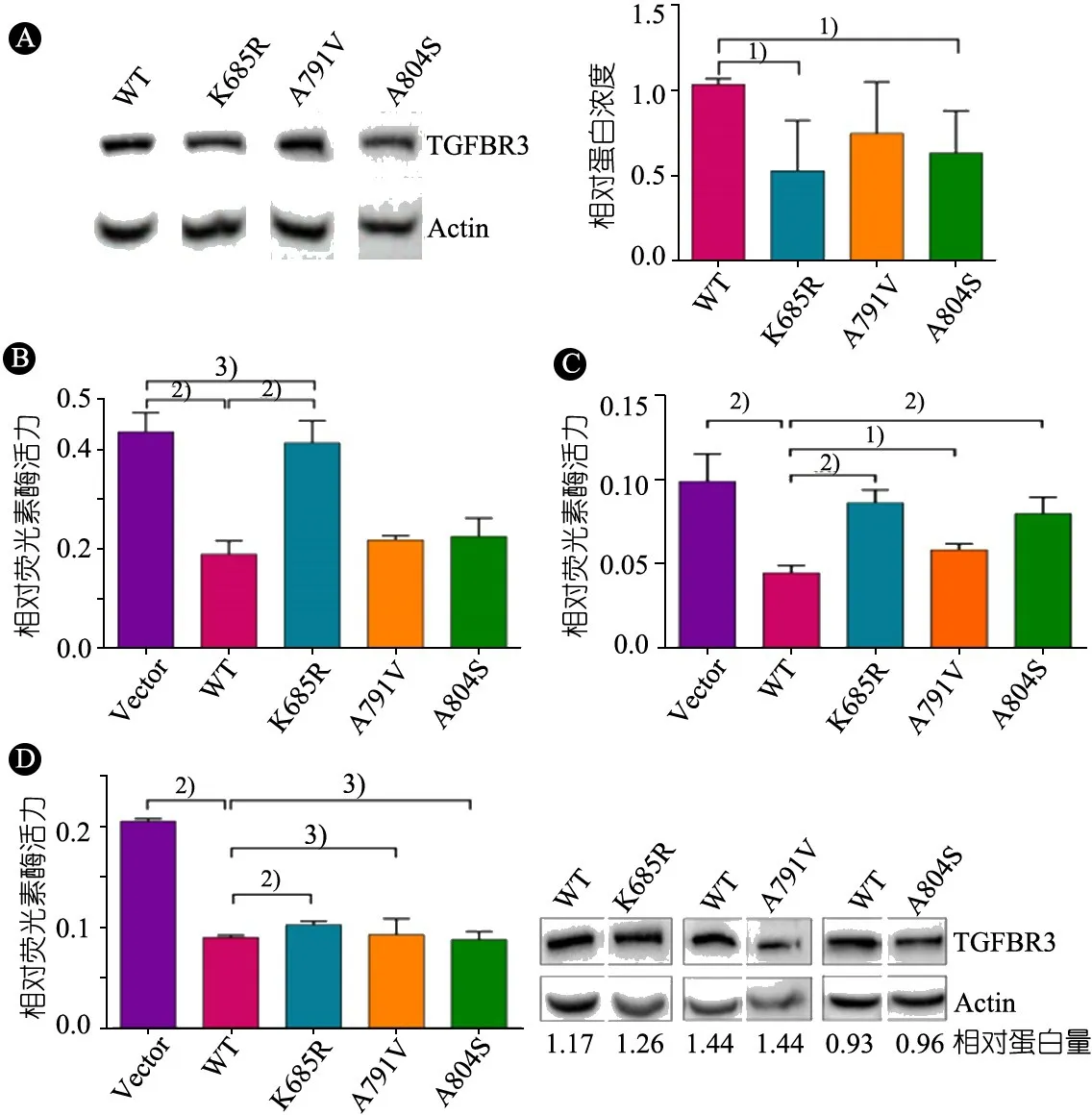
图2TGFBR3点突变对TGFBR3蛋白表达以及对TGF-β信号通路的影响
注 A:用2.5 μg野生型或突变型TGFBR3表达质粒转染后的HEK293T细胞TGFBR3蛋白的免疫印迹以及灰度分析。B:在正常培养基(10%FBS)培养条件下,等量的野生型或突变型TGFBR3表达质粒转染后HEK293T细胞的荧光素酶报告基因实验的统计分析结果。C:在无血清培养基条件下,等量的野生型或突变型TGFBR3表达质粒转染后HEK293T细胞的荧光素酶报告基因实验的统计分析结果。D:野生型/突变型TGFBR3蛋白表达相同时,在正常培养基(10%FBS)培养条件下HEK293T细胞的荧光素酶报告基因的统计分析结果和TGFBR3蛋白的免疫印迹。柱形图为三次重复实验统计结果,显示了平均值±标准差。1):P<0.05;2):P<0.01;3):差异无统计学意义
3 讨论
本研究通过中国山东地区汉族404例CHD样本以及213例对照样本的TGFBR3基因外显子靶向测序,发现1个疾病特异的新发杂合突变(TGFBR3K685R)和2个疾病特异的稀有杂合突变(TGFBR3A791V和TGFBR3A804S)。本文体外细胞实验还显示,突变TGFBR3K685R在有或无血清条件下都显著降低了TGFBR3对TGF-β信号通路的抑制作用,而TGFBR3A791V和TGFBR3A804S则只在无血清条件下对TGF-β信号通路的抑制作用显著降低。研究第一次揭示TGFBR3基因来自CHD患儿的稀有突变可能因为干扰TGF-β信号通路的功能参与CHD的发生。
基于小鼠TGFBR3是小鼠心脏发育不可缺少的重要基因的事实,本研究假设人TGFBR3基因的突变也与人CHD有关。本研究通过对中国山东汉族人群404例CHD样品和213例健康对照样品TGFBR3基因进行外显子靶向测序和生信分析,发现/验证了3个疾病特异性的新发/稀有突变:TGFBR3K685R,TGFBR3A791V和TGFBR3A804S。我们对突变蛋白的功能研究实验显示突变蛋白TGFBR3K685R和TGFBR3A804S表达水平显著下降。我们还发现这TGFBR3基因三个突变都显著减弱了对TGF-β信号通路的抑制作用。因此,我们的研究结果表明在先天性心脏病例发现的TGFBR3稀有突变也许与CHD的发生有关。
TGFBR3的胞外域能被切割下来形成可溶的sTGFBR3,通过竞争性结合TGF-β配体,抑制TGF-β与TGF-β通路核心受体TGFBR2结合,从而达到抑制通路信号传导的作用。同时TGFBR3胞内域与TGFBR2-配体复合物的结合(识别GIPC结构),也会竞争性抑制TGF-β信号转导[12, 23, 24]。TGFBR3K685R突变位于胞外ZP结构域上,同时也位于TGFBR3蛋白的第二个TGF-β配体的结合域。因此TGFBR3K685R突变蛋白可能有3种方式降低对TGF-β信号通路的抑制作用:①TGFBR3K685R突变导致蛋白表达水平显著下降,胞外被切割的sTGFBR3总量也减少,因而竞争性结合TGF-β配体的能力降低;②TGFBR3K685R蛋白表达水平显著下降使得能与TGFBR2结合的TGFBR3胞内域总量减少,因而对TGFBR2抑制作用减少;③TGFBR3K685R突变氨基酸可能导致sTGFBR3与配体结合能力下降,从而有更多TGF-β配体与TGFBR2结合激活TGF-β信号通路。TGFBR3A791V和TGFBR3A804S突变氨基酸都位于TGFBR3蛋白的穿膜结构域,因此猜测这2个突变氨基酸可能改变了TGFBR3蛋白空间三维结构从而导致TGFBR3上膜能力降低或者胞外域被切割能力降低,使得sTGFBR3浓度降低。从CHD病例发现的3个TGFBR3突变抑制TGF-β信号通路的能力降低的分子机制值得进一步的深入研究。
结论:TGFBR3K685R、TGFBR3A791V和TGFBR3A804S3个突变可能是导致CHD发生的风险因素。
