γ分泌酶抑制剂阻断Notch-Hes1信号通路对银屑病样皮炎小鼠γδT17细胞表达的影响
2019-12-19王燕芹李新新薛海波纪洪孙大康马蕾
王燕芹 李新新 薛海波 纪洪 孙大康 马蕾
1滨州医学院附属医院皮肤科,山东 256603;2滨州医学院附属医院内分泌与代谢病科,山东 256603;3滨州医学院附属医院病理科,山东 256603;4滨州医学院附属医院临床医学实验室,山东 256603
银屑病是一种免疫介导的慢性炎症性皮肤病,近来研究发现,白细胞介素17A(IL-17A)在银屑病的发病机制中发挥关键作用[1-3],且临床试验证实,IL-17A及IL-17受体拮抗剂治疗中重度斑块状银屑病疗效确切[4-5]。在银屑病皮损中,许多免疫细胞分泌IL-17A,T 细胞是其最主要来源[6]。以往研究提示,IL-17A 主要由 Th17 细胞产生[7-8]。新近研究显示,γδ T17 细胞亦是银屑病皮损中IL-17A 的主要来源T细胞[6,9]。Notch信号通路是一种高度保守的信号转导通路,在银屑病的发生发展中发挥重要作用[10],且 Notch 信号通路下游靶基因 Hes1 对γδT17 细胞分化发育及 IL-17A 产生至关重要[11]。目前尚无Notch-Hes1 信号通路对银屑病γδT17 细胞表达及其IL-17A分泌影响的研究报道。我们用5%咪喹莫特构建小鼠银屑病样皮炎模型,以γ 分泌酶抑制剂阻断Notch-Hes1信号通路,探讨在银屑病状态下,阻断Notch-Hes1信号通路对γδT17细胞表达及IL-17A分泌的影响。
材料与方法
一、材料
1.小鼠:雄性健康 SPF 级 BALB/c 小鼠产自济南朋悦实验动物繁育有限公司(动物合格证号:37009200014339),6 周龄,体重(18 ± 2)g,饲养于滨州医学院附属医院SPF 动物房[动物实验许可证号SYXK(鲁)20180022],室温23 ℃ ± 1 ℃,照度15 ~20 Lx,昼夜明暗交替时间12 h/12 h(光照时间为每天7:00 ~ 19:00),自由取食(标准灭菌饲料和高压蒸气灭菌用水),实验过程遵循减少、替代、优化的3R原则。
2.主要试剂和仪器:5%咪喹莫特乳膏(英国3M Health Care Limited 公司),γ 分泌酶抑制剂(2S)-N-N-(3,5-二氟苯乙酰基)-L-丙氨酰-2-苯基甘氨酸叔丁酯(DAPT,纯度99%,美国Selleck 公司),异硫氰酸荧光素标记的CD3单克隆抗体、藻青蛋白标记的γδT 单克隆抗体、藻红蛋白标记的IL-17A 单克隆抗体、细胞刺激剂(美国eBioscience 公司),固定/破膜剂、脱氧核糖核酸酶Ⅰ(DNaseⅠ)(美国Thermo Fisher 公司),胶原蛋白酶Ⅳ(美国Sigma 公司),Trizol RNA 提取试剂(美国Invitrogen公司),GoScript ™逆转录酶系统、GoTaq®qPCR Master Mix(美国Promega公司),IL-17A酶联免疫吸附实验(ELISA)试剂盒(上海酶联生物科技有限公司),玉米油(美国Sigma公司),DMEM培养基、红细胞裂解液、胎牛血清(FBS)、磷酸盐缓冲液(PBS,上海生工生物工程股份有限公司),FACS Calibur 流式细胞仪(美国BD 公司),Rotor-Gene 3000 实时PCR仪(澳大利亚Corbett Research公司),酶联免疫检测仪(美国Thermo公司)。
二、方法
1.小鼠分组:将45 只雄性SPF 级健康BALB/c小鼠按照简单随机抽样法分为对照组、模型组和干预组,每组15只,用动物专用剃刀剃去小鼠背部约2 cm×3 cm范围的被毛,电动剃须刀剃去毳毛。模型组和干预组小鼠每天涂抹5%咪喹莫特乳膏62.5 mg 于脱毛处,对照组小鼠涂抹等剂量白凡士林;先将DAPT 溶解于二甲基亚砜配成储存液(10 g/L),再以玉米油溶解DAPT 储存液配成工作液(0.2 g/L),在涂抹咪喹莫特后立即给予干预组小鼠腹腔注射DAPT(10 mg/kg)工作液,模型组及对照组小鼠腹腔注射等剂量玉米油。以上处理每天1次,连续6 d。每天记录3组小鼠皮损变化,第7天麻醉小鼠,剪破心脏取血,取脾脏及皮肤组织完成实验。本研究经医院实验动物伦理委员会讨论通过(编号20190104-15)。
2.各组小鼠银屑病样皮炎严重程度评分:用数码相机每天拍照记录小鼠皮损变化,计算银屑病皮损严重程度指数(psoriasis area and severity index,PASI)。红斑、鳞屑、浸润厚度按0 ~ 4 分计分,0 分为与处理前相比无变化,1 分为轻度,2 分为中度,3分为重度,4分为极重度,累加后得到总积分[12]。
3.小鼠皮肤组织病理学检查:剪取背部0.5 cm×0.5 cm 的皮肤组织,4%多聚甲醛固定,经石蜡包埋、切片、苏木精-伊红(HE)染色后于显微镜下观察。
4.脾指数计算:称量小鼠体重及脾重,计算脾指数(脾重/体重,mg/g)。
5.小鼠脾脏单细胞悬液制备:取出脾脏,用5 ml注射器芯在200目钢网上研磨,将细胞悬液移入离心管中,4 ℃、400 × g 离心10 min,弃上清液,加入红细胞裂解液重悬细胞,加入预冷PBS终止反应,4 ℃、400× g离心10 min,弃上清液,再次加PBS重悬细胞,重复1 次上述离心步骤,加入含15%FBS 和1%青链霉素的DMEM 重悬细胞,计数并调至1 × 106细胞/ml。
6.小鼠皮肤组织单细胞悬液制备:将皮肤组织剪成0.5 cm×0.5 cm 大小置于培养皿中,加入胰蛋白酶,37 ℃孵育2 h。进一步剪碎皮肤组织并转移至离心管中,依次加入DMEM 培养基、含10%FBS的DMEM 培养基、胶原蛋白酶Ⅳ、PBS、DNaseⅠ,37 ℃、90 r/min(振幅29 mm)振荡1 h。加入含10%FBS 的DMEM 培养基终止反应,过滤,1 250 r/min(半径18 cm)离心6 min,弃上清液。加PBS重悬细胞,1 250 r/min(半径18 cm)离心6 min,弃上清液。PBS重悬细胞,计数并调至1×106细胞/ml。
7.流式细胞仪检测γδT17 细胞比例:取脾脏、皮肤组织单细胞悬液各1 ml(约106个细胞)置于24 孔板,加入细胞刺激剂即佛波醇-十四酸酯-乙酸酯和离子霉素的混合物,37 ℃、5%CO2环境下共刺激培养4 h。取约105个细胞于流式管中,加入异硫氰酸荧光素-CD3、藻青蛋白-γδT 单克隆抗体室温下避光15 min 标记细胞膜;加入固定剂,室温下避光15 min,洗涤重悬细胞;加入透膜剂、藻红蛋白-IL-17A 室温下避光20 min,应用流式细胞仪检测。
8.实时定量反转录PCR 检测脾脏Hes1 mRNA表达水平:采用Trizol RNA 提取试剂抽提小鼠脾细胞总RNA,1.5%琼脂糖凝胶电泳检测RNA完整性,紫外分光光度仪测定其纯度,吸光度比值(A260/A280)在1.8 ~ 2.0之间为合格样本。采用GoScript™逆转录酶系统将RNA 逆转录合成cDNA,以β 肌动蛋白为内参照,采用GoTaq®qPCR Master Mix试剂盒于Rotor-Gene 3000 real-time PCR 仪上进行检测。PCR 反应体系:cDNA 模板 1 μl,正向引物(2 μmol/L)2 μl,反向引物(2 μmol/L)2 μl,GoTaq®qPCR Master Mix(2×)10 μl,RNase-free 去离子水5 μl;反应条件:95 ℃预变性2 min,95 ℃变性15 s、56 ℃退火30 s、72 ℃延伸30 s,共扩增40 个循环。以目的基因和内参基因拷贝数的比值表示Hes1 mRNA表达水平。
9.ELISA检测血清IL-17A含量:将血液标本室温下静置2 h,收集上层血清,按照小鼠IL-17A ELISA试剂盒说明书的操作标准进行检测。
10.统计学处理:PASI 评分比较采用单因素重复测量方差分析;其他指标比较采用单因素方差分析,组间比较采用最小显著差法。不同指标间相关性评价采用Pearson相关分析。采用SPSS17.0统计学软件进行数据分析,P <0.05 为差异有统计学意义。
结 果
一、小鼠一般情况及皮损形态、组织病理学改变
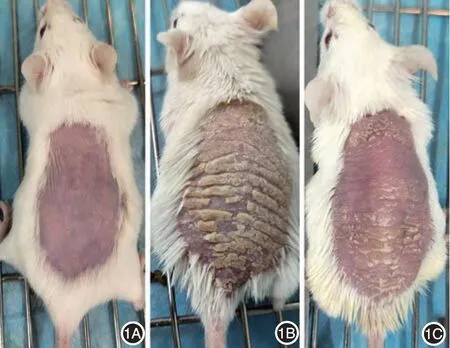
图1 咪喹莫特乳膏单独或联合γ分泌酶抑制剂处理6 d后小鼠背部皮肤表现 1A:对照组;1B:模型组;1C:干预组
所有实验鼠完成全部造模及干预过程,无死亡及其他特殊情况发生。末次处理24 h 后对照组小鼠皮肤较薄,无红斑、鳞屑及皮肤增厚改变;模型组小鼠皮肤出现明显红斑、鳞屑及浸润增厚;干预组小鼠皮肤红斑、鳞屑及浸润增厚现象较模型组明显减轻,见图1。PASI评分见图2。对照组PASI评分始终为0,模型组造模第2 天开始持续增加,至第6天达到最高值,干预组PASI评分与模型组变化趋势相似,但较模型组显著降低。重复测量方差分析显示,对照组、模型组、干预组3组间PASI评分差异有统计学意义(F=602.15,P < 0.01),且组间两两比较差异均有统计学意义(均P <0.01);不同观察时间点差异亦有统计学意义(F = 615.70,P <0.01),进一步组间比较显示,除PASI 评分在第5、6天之间差异无统计学意义外,其他各观察点之间差异均有统计学意义(均P <0.05)。并且,时间和组别对PASI 评分的影响具有交互作用(F =170.47,P < 0.01)。
HE 染色显示,对照组小鼠表皮层菲薄,仅由1 ~2层表皮细胞构成。模型组小鼠表皮层明显增厚,可见角化过度伴角化不全,部分区域可见Munro 微脓肿,表皮层细胞数量增加,表皮突向下延伸,真皮炎症细胞大量浸润,真皮浅层可见血管扩张。干预组小鼠表皮增厚及真皮炎症细胞浸润程度较模型组明显减轻。见图3。
二、小鼠脾指数及脾脏γδT17 细胞比例、Hes1 mRNA表达水平
1.脾指数:见表1。3 组间小鼠脾指数差异有统计学意义(P <0.01),组间两两比较显示,模型组小鼠脾指数明显高于对照组(t=14.20,P< 0.01),干预组显著低于模型组(t=-6.37,P< 0.01),干预组与对照组差异有统计学意义(t=7.83,P<0.01)。
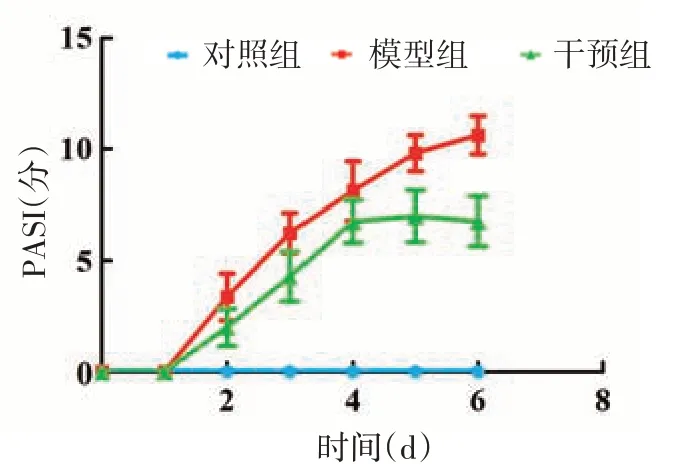
图2 银屑病样皮炎小鼠背部皮肤银屑病皮损严重程度指数(PASI)随时间变化曲线

图3 银屑病样皮炎小鼠皮肤组织病理学变化(HE×200) 3A:对照组小鼠表皮层菲薄,仅由1 ~2层表皮细胞构成;3B:模型组小鼠表皮层明显增厚,角化过度伴角化不全,表皮突向下延伸,真皮炎症细胞大量浸润,真皮浅层可见血管扩张;3C:干预组小鼠表皮增厚及真皮炎细胞浸润较模型组明显减轻
2.γδT17 细胞比例:见表 1、图 4。3 组间小鼠脾脏γδT17 细胞比例差异有统计学意义(P<0.01),而且组间两两比较显示,模型组显著高于对照组(t= 9.40,P< 0.01),干预组明显低于模型组(t=-5.77,P< 0.01),干预组与对照组间差异有统计学意义(t=3.64,P< 0.01)。
3.Hes1 mRNA表达水平:3组间小鼠脾脏单细胞悬液中Hes1 mRNA表达水平差异有统计学意义(P<0.01),组间两两比较显示,模型组显著高于对照组(t= 20.43,P< 0.01),干预组低于模型组(t=-14.23,P< 0.01),干预组与对照组间差异有统计学意义(t=6.19,P< 0.01),见表1。
表1 银屑病样皮炎小鼠脾指数、γδT17细胞比例、脾脏Hes1 mRNA表达水平及血清白细胞介素17A含量(±s)
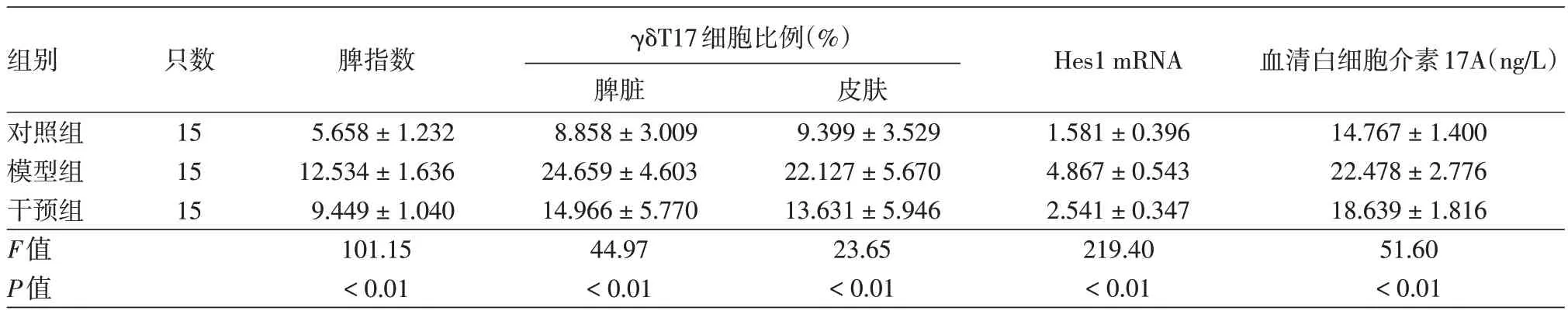
表1 银屑病样皮炎小鼠脾指数、γδT17细胞比例、脾脏Hes1 mRNA表达水平及血清白细胞介素17A含量(±s)
组别对照组模型组干预组F值P值只数15 15 15脾指数5.658±1.232 12.534±1.636 9.449±1.040 101.15<0.01 γδT17细胞比例(%)脾脏8.858±3.009 24.659±4.603 14.966±5.770 44.97<0.01皮肤9.399±3.529 22.127±5.670 13.631±5.946 23.65<0.01 Hes1 mRNA 1.581±0.396 4.867±0.543 2.541±0.347 219.40<0.01血清白细胞介素17A(ng/L)14.767±1.400 22.478±2.776 18.639±1.816 51.60<0.01
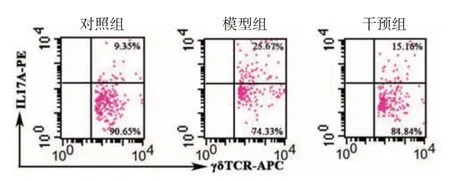
图4 流式细胞仪检测银屑病样皮炎小鼠脾脏γδT17 细胞比例 γδTCR-APC,藻青蛋白标记的γδT 细胞受体单克隆抗体;IL-17A-PE,藻红蛋白标记的白细胞介素17A单克隆抗体
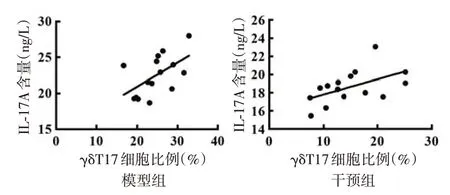
图5 银屑病样皮炎小鼠脾脏γδT17 细胞比例与血清白细胞介素17A(IL-17A)水平相关性分析(n=15)
三、小鼠皮肤组织中γδT17细胞比例
3组小鼠皮肤组织中γδT17细胞比例差异有统计学意义(P<0.01),组间两两比较显示,模型组明显高于对照组(t=6.75,P< 0.01),干预组较模型组显著降低(t=-4.51,P< 0.01),见表1。
四、小鼠血清中IL-17A含量
方差分析显示,3组间小鼠血清中IL-17A含量差异有统计学意义(P<0.01),而且组间两两比较显示,模型组明显高于对照组(t=10.16,P< 0.01),干预组则较模型组降低(t=-5.06,P< 0.01),见表1。
五、相关性评价
模型组及干预组小鼠脾脏γδT17 细胞比例与血清IL-17A 含量均呈正相关(r值分别为0.56 和0.53,均P< 0.05),见图5;皮肤组织中γδT17 细胞比例与 PASI 均呈正相关(r值分别为 0.56 和 0.52,均P< 0.05),见图6。
模型组及干预组小鼠脾脏Hes1 mRNA表达水平与γδT17 细胞比例均呈正相关(r值分别为0.61和0.58,均P< 0.05),与血清IL-17A 水平亦均呈正相关(r值分别为0.60和0.54,均P< 0.05)。见图7。
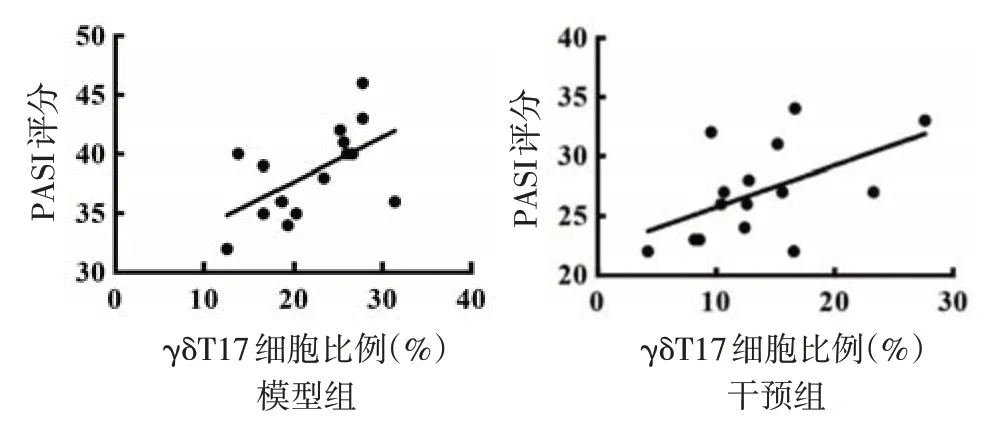
图6 银屑病样皮炎小鼠皮肤组织γδT17 细胞比例与银屑病皮损严重程度指数(PASI)相关性分析(n=15)
讨 论
免疫系统应答失调在银屑病疾病过程中发挥关键作用,目前认为T17细胞是最重要的致病因素之一[6,12-13]。T17 细胞包括 Th17、Tc17 和 γδT17 细胞,均能分泌IL-17等细胞因子。IL-17细胞因子家族包括6个成员,IL-17A是该家族最先发现也是最具标志性的细胞因子。大量研究已证实,IL-17A在银屑病发生及发展过程中发挥重要作用,能够促进角质形成细胞增殖,抑制角质形成细胞分化,破坏皮肤屏障,诱导多种前炎症细胞因子和趋化因子的表达分泌,启动并加重炎症反应[2-3,14-15]。在银屑病样皮炎动物模型研究中,同样证实了IL-17A 的致病作用[16]。临床试验证实,阻断IL-17A 或其受体对中重度斑块状银屑病疗效确切[4-5]。本研究结果显示,银屑病样皮炎小鼠脾脏及皮肤组织中γδT17细胞比例均明显高于对照组,且脾脏γδT17细胞比例与血清IL-17A含量呈正相关,皮肤组织中γδT17细胞比例与皮损PASI呈正相关,进一步证实γδT17细胞在银屑病发病机制中的重要作用[6]。
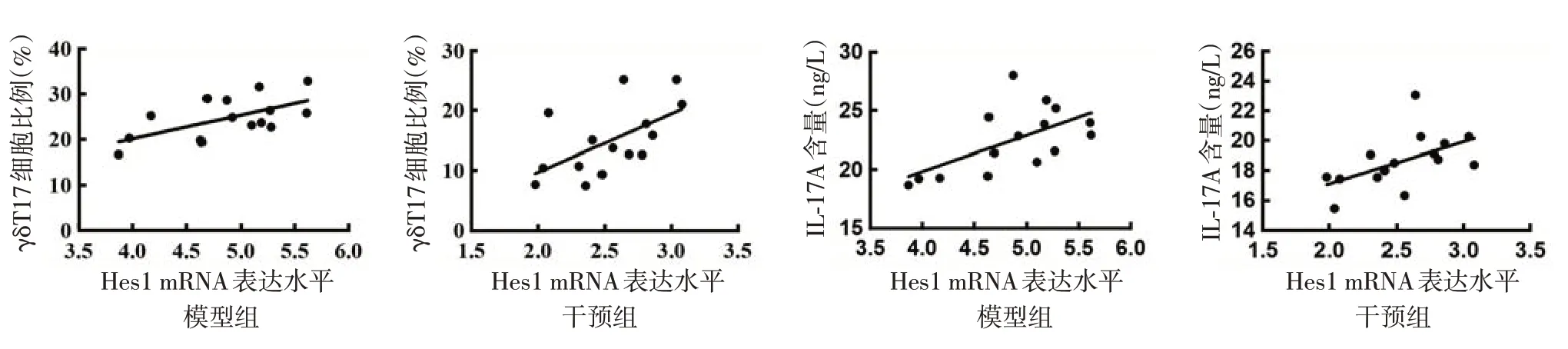
图7 银屑病样皮炎小鼠脾脏Hes1 mRNA表达水平与γδT17细胞比例、血清白细胞介素17A(IL-17A)含量相关性分析(n=15)
Notch信号通路作为一种高度保守的信号转导通路,在细胞分化、发育过程中尤其是在T 淋巴细胞分化中起关键作用[17]。Notch 信号通路由 4 种Notch 受体、5 种 Notch 配体、CSL(CBF1/Suppressor of hairless/Lag1)DNA 结合蛋白、其他效应物和Notch 调节分子等组成。Notch 配体与受体相互作用,在Notch受体分子的S2和S3两个位点发生连续切割,S3 被依赖早老素、包含γ 分泌酶的复合物切割后,释放出具有核定位信号的胞质区(Notch intracellular domain,NICD),NICD 转移至细胞核并形成NICD/CSL转录激活复合体,从而激活靶基因,发挥生物学作用。γ 分泌酶抑制剂能够作用于早老素分子,从而阻断γ分泌酶的作用,减少NICD的产生,下游信号分子由于NICD 的启动作用缺少或减弱而处于静止或下调状态。Notch信号通路在银屑病发病机制中的作用已有诸多报道[10],本研究结果证实,γ 分泌酶抑制剂DAPT 阻断Notch 信号后,银屑病样皮炎小鼠皮损严重程度明显改善,PASI降低,组织病理检查亦表明其表皮增厚及真皮炎症细胞浸润程度较模型组明显减轻。
在小鼠和人促Th17细胞分化的细胞因子环境中均有Notch 信号通路的活化,以γ 分泌酶抑制剂及siRNA 特异性阻断Notch1 信号通路能够降低Th17 细胞特异性转录因子RORγt 的表达,抑制其产生IL-17A 及相关炎症反应进程[18-19]。本课题组前期研究表明,用γ分泌酶抑制剂DAPT阻断Notch信号通路能够降低银屑病患者及模型小鼠外周血与脾脏单个核细胞中Th17 细胞比例、RORγt 及IL-17A 的表达[20-21]。RORγt 对于 Th17 细胞的分化必不可少,然而γδT17细胞在胸腺内的发育分化仅部分依赖RORγt[11,22]。Hes1是Notch信号通路下游的重要靶基因,对γδT17细胞的分化发育及其产生IL-17A 至关重要:在Hes1 基因缺陷的小鼠胸腺内γδT细胞数量较正常小鼠降低,且具备分泌IL-17A能力的γδT17 细胞数量降低更显著,脾脏内产生IL-17A 的γδT17 细胞数量亦明显降低;将转染有Notch1 胞内段NICD1 的胎肝细胞移至经放射线照射的小鼠,其胸腺内Hes1 表达水平及γδT17 细胞数量显著增加[11]。本研究结果显示,银屑病样皮炎小鼠脾脏Hes1 mRNA 表达水平、脾脏及皮肤组织中γδT17 细胞比例均显著增高,DAPT 能明显降低Hes1的表达水平及γδT17细胞比例,且模型组和干预组小鼠脾脏Hes1 表达水平均与γδT17 细胞比例及IL-17A 血清含量呈正相关,进一步说明银屑病状态下Notch-Hes1 信号通路对γδT17 细胞表达及分泌IL-17A的调控作用。
结合以往及本次研究结果,我们认为Notch-Hes1信号通路分别通过不同的转录因子途径对银屑病IL-17A 两大主要来源细胞即Th17 细胞和γδT17细胞进行表达调控,促进其产生分泌IL-17A,增强其致炎效应,加重银屑病皮损的炎症反应,阻断Notch-Hes1 信号通路可能是银屑病免疫治疗的新策略。
利益冲突所有作者均声明不存在利益冲突
