飞秒激光小切口角膜基质透镜取出术与经上皮准分子激光角膜切削术矫治中低度近视术后患者功能性光学区的对比研究
2019-12-18侯杰雷玉琳张颖马志兴张静
侯杰 雷玉琳 张颖 马志兴 张静
角膜屈光术后视觉质量的提升始终是人们重视和关心的话题,无论是准分子激光手术还是飞秒激光手术,除了设备的稳定性和安全性外,激光参数的设置和优化也是影响手术效果的关键因素之一。其中,光学区设计不当或者术后形成的光学区过小均会导致患者术后夜视力降低、光晕、眩光等并发症发生。研究证实,无论过渡区存在与否,术后功能性光学区均比预期设计的光学区偏小[1-4]。
飞秒激光小切口角膜基质透镜取出术(small incision lenticule extraction,SMILE)的临床开展使角膜屈光手术走向了微创、无瓣时代,术后视觉质量得到了改善和提升[5-6]。而单一步骤的经上皮准分子激光角膜切削术(transepithelial photorefractive keratectomy,TransPRK)作为一种新型的表层准分子激光屈光手术,同样以微创、无瓣、去除上皮和光学矫正一步完成的优势获得了临床认可[7-8]。理论上讲,两种全激光手术术后均会形成更为有效的光学区,但实际如何目前尚未见此方面的对比研究。本研究旨在通过测量功能性光学区的大小对比分析SMILE与TransPRK术后光学区的变化,同时分析并找寻影响其变化的相关影响因素,现报告如下。
1 资料与方法
1.1 一般资料与分组回顾性病例研究。选取2017年11 月至2018 年2 月在我院接受角膜屈光手术的近视及近视散光患者102 例(102眼),均纳入右眼进行分析,其中男60例(60眼)、女42例(42眼),年龄18~41(23.50±3.71)岁,术前球镜度数为-0.75~-6.00(-3.41±1.09)D;柱镜度数为0~-3.00(-0.53±0.50)D;等效球镜度数(spherical equivalent,SE)为-0.75~-6.38(-3.67±1.15)D。按患者选择的手术方式不同分为SMILE组62例(62眼)和TransPRK组40例(40眼)。
纳入标准:患者手术前后角膜形态规则无异常;泪液功能检测显示无严重干眼;角膜透明,无薄翳或斑翳;术前软性角膜接触镜停戴2周以上,硬性角膜接触镜停戴1个月以上,角膜塑形镜停戴3个月以上;术后随访至少3个月。所有患者均自愿接受手术,并签署知情同意书。
1.2 方法
1.2.1 常规检查术前常规行裸眼视力、最佳矫正视力、裂隙灯显微镜、眼压、泪液功能及眼底检查等。使用RTVue眼前节OCT(RTVue,Optovue公司,美国)测量中央角膜厚度(central corneal thickness,CCT)及角膜上皮厚度。使用Pentacam三维眼前节分析系统(6.07r29,Oculus公司,德国)测量并获取角膜平均曲率(mean keratometric value,Km)、6 mm直径范围的角膜球差值及非球面参数Q值。
1.2.2 功能性光学区的获取所有测量均由同一名经验丰富的眼科技师完成。分别于术前及术后3个月选取数据,要求选择的图像质量参数>95%、分析直径>9.0 mm、瞳孔中心偏移量<0.3 mm,手术前后瞳孔中心偏移量差值<0.1 mm,每眼测量3次并取平均值记录。在Pentacam三维眼前节分析系统的“Power Distribution”界面,以瞳孔为中心,选择环形法记录总角膜屈光力,通过鼠标调整环形直径的大小。参照文献[4],以环形角膜曲率平均值与瞳孔中心曲率差值为1.50 D时的区域最大直径记录为功能性光学区。
1.2.3 手术方法及术后处理所有患者的手术均由同一名经验丰富的医师完成。常规消毒铺巾,盐酸丙美卡因滴眼液行表面麻醉,开睑器开睑,平衡盐液冲洗结膜囊,并用三角海绵擦干角膜。两组手术光学区均根据屈光度及角膜厚度等参数个性化设置。SMILE组患者均应用VisuMax飞秒激光系统(Carl Zeiss公司,德国)进行手术,激光扫描频率500 kHz,能量为135 nJ,光学区直径为6.5 mm,角膜帽厚度为120 μm、直径为7.5 mm,切口位于角膜上方、大小设置为2 mm。手术时激光顺序为:(1)微透镜下表面;(2)微透镜侧切;(3)微透镜上表面;(4)制作微切口。激光完成后使用分离器钝性分离透镜并取出,手术结束。术后给予5 g·L-1左氧氟沙星滴眼液每天4次滴眼,共7 d;1 g·L-1氟米龙滴眼液每天4次滴眼,每周递减1次至停药。
TransPRK组患者均使用500 Hz的阿玛仕准分子激光仪(德国Schwind公司)ORK.CAM软件中的TransPRK切削模式,一步完成角膜上皮及角膜基质的切削,光学区直径为6.5 mm,术毕配戴绷带式角膜接触镜。术后给予5 g·L-1左氧氟沙星滴眼液滴眼,每天6次,上皮愈合后取出角膜接触镜,使用 1 g·L-1氟米龙滴眼液滴眼,每天4次,每月递减1次至停药。
1.3 统计学分析采用SPSS 20.0软件进行统计学分析。计量指标的数据资料经Kolmogorov Smirnov检验证实符合正态分布,数据以均数±标准差表示;两组术前与术后数据比较采用配对t检验;两组之间数据比较采用独立样本t检验,功能性光学区的变化与各参数的关系采用Pearson相关分析。检验水准:α=0.05。
2 结果
2.1 术前两组患者一般资料比较术前两组患者的一般资料见表1,两组间各参数差异均无统计学意义(均为P>0.05),具有可比性。
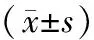
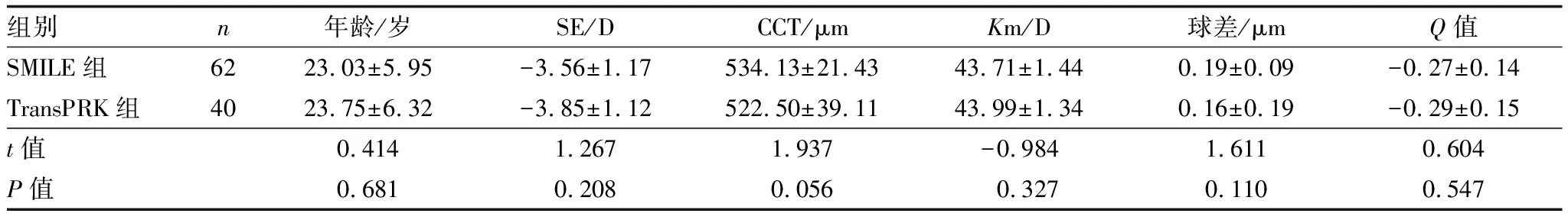
组别n年龄/岁SE/DCCT/μmKm/D球差/μmQ值SMILE组6223.03±5.95-3.56±1.17534.13±21.4343.71±1.440.19±0.09-0.27±0.14TransPRK组4023.75±6.32-3.85±1.12522.50±39.1143.99±1.340.16±0.19-0.29±0.15t值0.4141.2671.937-0.9841.6110.604P值0.6810.2080.0560.3270.1100.547
2.2 两组患者功能性光学区及比较两组患者术前及术后3个月测得的功能性光学区大小见表2。术后3个月,两组功能性光学区均较术前显著缩小,差异均有统计学意义(均为P=0.000)。在术前光学区设计相同的情况下,SMILE组功能性光学区的变化值为(1.18±1.00)mm,较TransPRK组的变化值(1.56±1.02)mm明显偏小,即SMILE组术后形成的实际有效光学区更大,两组相比差异有统计学意义(P=0.020)。
表2 两组术前及术后3个月功能性光学区大小及比较
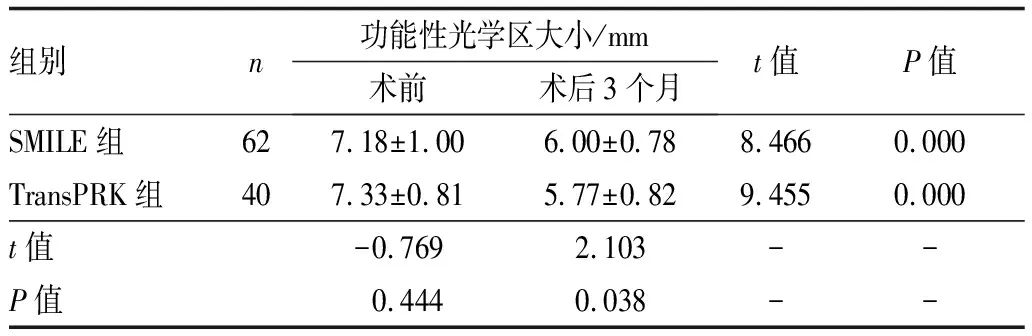
组别n功能性光学区大小/mm术前术后3个月t值P值SMILE组627.18±1.006.00±0.788.4660.000TransPRK组407.33±0.815.77±0.829.4550.000t值-0.7692.103--P值0.4440.038--
2.3 功能性光学区与可能影响因素的相关性分析将两组术前及术后3个月功能性光学区的变化量与可能的相关因素进行分析可见,两组功能性光学区的缩小与术前SE均呈显著负相关(均为P<0.05),与角膜曲率变化量、球差变化量及Q值变化量均呈显著正相关(均为P<0.01),与CCT均无显著相关性(均为P>0.05)。见表3。
表3 两组手术前后功能性光学区的变化量与各因素的相关系数
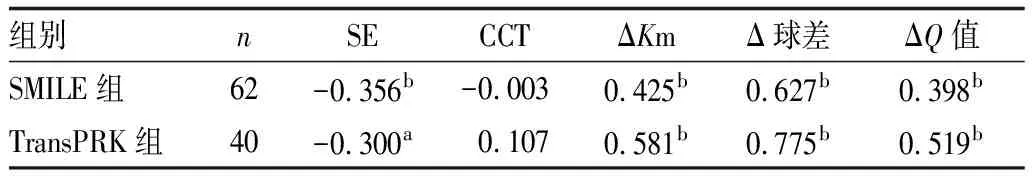
组别nSECCTΔKmΔ球差ΔQ值SMILE组62-0.356b-0.0030.425b0.627b0.398bTransPRK组40-0.300a0.1070.581b0.775b0.519b
注:与另一组比较,aP<0.05,bP<0.01
3 讨论
角膜屈光手术后视觉质量的降低与手术方式选择、术前屈光度、瞳孔直径大小、光学区大小等因素均有相关性。在现代角膜屈光手术的临床设计中,光学区是可以修改的控制术后视觉质量的参数,术后光学区的缩小会显著干扰夜间视功能,根据美国食品药品监督管理局的临床试验,较大的光学区可以使患者术后夜间视功能满意度由65%提高至86%[9]。因此,术前合理地设计光学区、术后形成更大的功能性光学区对提高患者术后视觉质量具有重要的临床意义。
角膜的功能性光学区通常是中央像差最小且视觉质量最好的区域,是为激光切削前后提供功能性视觉的角膜表面区域[1,10-12]。根据目前的研究,使用角膜地形图直接测量其大小是一种较为直观和常用的方法。Pentacam角膜地形图对角膜形态,特别是角膜屈光手术后角膜曲率测量的重复性及精确性已得到众多临床研究验证[13]。近期李华等[14]通过Pentacam眼前节分析系统、角膜地形图6种不同模式并联合自主研制的透明同心圆软件对接受FS-LASIK的患者术后光学区进行测量分析,结果显示,角膜轴向曲率差异图边界越清晰越有利于光学区的测量,并指出光学区在术后3个月趋于稳定。本研究测量了目前两种主流“微创”手术SMILE与TransPRK术后3个月功能性光学区的变化。
本研究结果显示,两种手术术后功能性光学区均较术前显著缩小,且较手术预计值偏小,与此前的研究结论一致[2-4]。其中,SMILE术后测得的功能性光学区为(6.00±0.78)mm,较术前功能性光学区缩小了(1.18±1.00)mm。Qian等[4]使用Pentacam角膜屈光力的分布图测量了角膜屈光术后功能性光学区的大小,结果显示,术前预设光学区直径6.5 mm组术后功能性光学区为(5.09±0.83)mm,比本研究的值偏小,可能与其选择的患者屈光度范围较大有关。近期我们使用切线曲率差异图计算了SMILE术后功能性光学区的变化,术后3个月为(5.34±0.23)mm,数值差异可能与采用的测量方法不同有关[15]。TransPRK组术后3个月功能性光学区为(5.77±0.82)mm,较术前功能性光学区缩小了(1.56±1.02)mm。Camellin等[16]使用德国AMARIS准分子激光仪的非球面切削模式进行LASEK及EPI-LASIK,并通过角膜像差测算术后功能性光学区,结果显示,当预设光学区直径小于6.75 mm时,术后实际的光学区直径比预计值要小0.25 mm;在预设光学区直径为6.75 mm以上时,术后实际光学区与预计光学区大小基本一致。然而,该研究中的功能性光学区使用角膜前表面像差进行定义,与本研究使用的总角膜屈光力尚不能进行直接对比。
术后功能性光学区缩小的原因可能与术后角膜形态的改变、角膜伤口愈合(如上皮重塑)、角膜生物力学的变化等因素有关[16-18]。SMILE由于手术设计因素及术中透镜分离的需求,其光学切削区边缘呈现为一个相对“锐利”的透镜边缘,避免了准分子激光在周边切削时能量的丢失,理论上讲,微透镜的直径基本为实际光学区的大小[19]。而TransPRK使用准分子激光进行基质切削,术中激光切削较飞秒激光制作透镜时向周围组织传输的能量高,导致术后伤口愈合反应更显著[20-21]。SMILE术中使用的能量相对较低,可有效减少术后角膜的炎症反应及角膜基质重塑效应[22],这可能是SMILE组患者术后获得更大的功能性光学区的原因之一。
Holladay等[23]研究表明,角膜非球面形态的变化是引起准分子激光角膜屈光手术后光学区缩小的主要原因。本研究发现,两种手术术后Q值的变化量及球差变化量与功能性光学区的缩小程度均呈显著正相关,即术后角膜形态越向扁球形方向变化,球差增加越显著,形成的功能性光学区便会越小。SMILE对角膜前表面形态的影响要小于TransPRK,这可能是SMILE组患者术后获得更大的功能性光学区的另一重要原因。
目前关于功能性光学区的变化与屈光度是否相关尚存在分歧。Wachler等[10]的研究表明,LASIK术后功能性光学区缩小量与预期矫正的屈光度呈正比;Qian等[4]对SMILE的研究发现,近视度数高低与术后功能性光学区的大小没有相关性,但是当屈光度超过7.50 D时术后功能性光学区会显著偏小。本研究发现,术前屈光度越高,术后形成的功能性光学区越小。因考虑表层手术的适应证,本研究纳入的患者均为中低度近视人群,缺乏较高近视度数的样本,因此尚需要更大样本量及屈光度范围的研究对功能性光学区与屈光度的关系进行验证。
综上所述,SMILE和TransPRK术后均出现功能性光学区的降低,与TransPRK相比,SMILE术后患者获得了更大的功能性光学区,这与术前屈光度的高低、术后角膜非球面形态的变化有关。关于角膜屈光手术后功能性光学区的变化对视觉质量特别是夜间视功能的影响有待进一步研究。
