IMRT 联合白蛋白结合型紫杉醇与吉西他滨治疗晚期胰腺癌的临床观察与效果评估*
2019-12-18张玉山王保全周黎明张永州郭建阔史朝辉
张玉山,王保全,周黎明,张永州,郭建阔,平 娟,史朝辉
胰腺癌是一种恶性程度极高,诊断和治疗都很困难的消化道恶性肿瘤疾病。 截至目前,除了手术治疗外,尚未有其他很好的治疗措施[1,2]。 基于胰腺癌难以治愈的特点,后续的放疗、化疗措施对延续患者的生存时间就显得十分重要[3-5]。白蛋白结合型紫杉醇(nab-paclitaxel,Nab-P)是新一代靶向紫杉醇制剂,它不需要合成的溶剂作为载体,不需要皮质固醇或抗组胺类药物等预处理,静脉滴注时间短(30 min),其利用了白蛋白的自然生物特性,临床前的研究模型证实了Nab-P 与传统溶剂相比,抗肿瘤活性明显增强[6-11]。 以此为基础,近年来,国内外进行了一系列Nab-P 用于各种恶性肿瘤化疗的研究,并取得了令人鼓舞的研究成果[12]。
调强适形放疗(intensity modulated radiotherapy,IMRT)是一种高精度的放射线治疗方法,其原理是根据肿瘤组织的3-D 形状通过调节辐射强度使得辐射剂量更加准确,使周围正常组织接受最小辐射剂量,比传统疗效更安全,不良反应小,正常组织遭受辐射剂量相对较低[13-15]。 目前,IMRT 被广泛应用于前列腺癌、头部、颈部及中枢神经系统癌症,也被广泛应用于治疗胸腔癌、甲状腺癌和肺癌[16,17]。多年来对胰腺癌的一线治疗一直未取得突破性进展,随着紫杉醇类化合物的问世,尤其是Nab-P,在临床上取得了较好的治疗效果。采用Nab-P 联合吉西他滨治疗晚期胰腺癌的化疗方法,在国际上也得到认可。 已经有多项研究证实,两药联合应用可明显地延长患者的中位生存时间,减少化疗等相关不良反应,提高患者的生存质量[18-21]。该研究回顾分析了笔者所在医院34 例仅行IMRT 治疗及31 例IMRT 联合Nab-P 与吉西他滨治疗晚期胰腺癌患者的临床资料及相关随访结果,对可能影响胰腺癌预后的各种因素进行单因素及多因素回归分析,探讨局部晚期胰腺癌的综合治疗模式,以期进一步提高晚期胰腺癌的疗效。
1 资料与方法
1.1 一般资料收集河南大学淮河医院2014 年6月—2017 年6 月普外科及消化内科收治的65 例晚期胰腺癌患者的临床资料,其中男29 例,女36 例;年龄30~75 岁。 所有患者均经B 超、CT、ERCP 等检查确诊为进展期或者有转移的胰腺癌患者,按照国际抗癌联盟(UICC)分期法进行临床分期,既往未接受过化疗、放疗,每例患者在治疗前均有完整的资料存档, 其中34 例患者仅行IMRT,31 例患者行IMRT 联合Nab-P 与吉西他滨化疗方案。 经病理学检测(组织学或者细胞学检测)证实为胰腺导管腺癌或者鳞癌,临床分期为T4N0-1M0(按照美国癌症联合 委 员 会:AJCC 分 期 标 准), 其 中5 例 腺 鳞 癌T4N0M0,39 例 导 管 腺 癌T4N0M0,21 例 导 管 腺 癌T4N1M0,CT 或者MRI 片上有可测量病灶,无重度骨髓抑制现象,心电图、血常规、肝肾功能均正常,所有患者无怀孕或者哺乳妇女,无梗阻性黄疸,无糖尿病或者传染病,6 个月内未接受过氟尿嘧啶类药物化疗或者无既往腹部放疗史, 无合并其他肿瘤,在化疗前期患者需要签署伦理学知情同意书。 两组患者一般临床资料差异无统计学意义, 具有可比性。
1.2 治疗方法IMRT 组: 选择针对胰腺癌病变区域及受累淋巴结区域行调强放疗, 剂量分割3 Gy/次,1 次/5 d·周,总剂量50~60 Gy,IMRT 联合Nab-P 与吉西他滨组: 其放疗方法同IMRT 组, 同步Nab-P 与吉西他滨化疗,其中Nab-P 用量125 mg/m2,第1、8 天静脉滴注,每隔3 W 重复,连续6 W,吉西他滨用量1000 mg/m2, 第1、8 天静脉滴注30 min,每隔3 W 重复、 连续6 W, 利用剂量体积直方图(DVH)进行剂量优化,90%等剂量完全覆盖计划靶区(PTV),肿瘤区域内部剂量均匀,剂量变化不超过5%,危及器官如胃肠道及骨髓等剂量均在可接受范围内,高剂量区的剂量限制≤10%。
1.3 生存质量评价依据Burris 等制定的临床受益反应标准,评价各组患者的临床受益反应,对患者疼痛强度、镇痛药物的消耗量,卡氏评分和体重变化综合评估,至少达到下列任何一项指标,其他各项指标稳定无恶化, 持续4 W 以上为临床受益:(1) 镇痛药物用药量减少≥50%;(2) 疼痛强度减少≥50%;(3) 体力状况改善≥20 分;(4) 体重增加≥7%。 计算临床受益率。
1.4 随访采用门诊随访及电话随访方式,随访时间截止到2019-03-31,疾病的进展期(TPP)定义为联合用药化疗开始至疾病进展的时间,总生存时间(OS) 定义为联合化疗开始至患者死亡或者末次随访时间。
1.5 不良反应及疗效评价应用CT 等影像资料,采用RECIST 标准,测量所有靶病灶的最长径,并计算所有靶病灶的最长径之和,与基线状态的最长径之和相比,肿瘤客观评价标准如下:完全缓解(complete response,CR),部分缓解(partial response,PR),稳定期(stable disease,SD),疾病进展期(progressive disease,PD), 以CR+PR+SD 计 算 疾 病 控 制 率(disease control rate,DCR),以CR+PR 为控制客观有效率(objective response rate,ORR),无进展生存期(progressive free survival,PFS)定义为从接受治疗开始至疾病不能耐受情况的时间,SD 以上患者继续使用原来方案, 直至PD 或出现不能耐受不良反应或患者拒绝再使用。
2 结 果
2.1 临床预后因素分析IMRT 组及IMRT 联合Nab-P 与吉西他滨组治疗单因素分析结果显示:性别、治疗方式、临床分期、照射靶区为患者预后的主要影响因素。Cox 多因素回归分析结果表明,临床分期、IMRT 是否联合Nab-P 与吉西他滨是其主要相关预后因素, 晚期病例姑息手术未延长患者生存期,见表1。
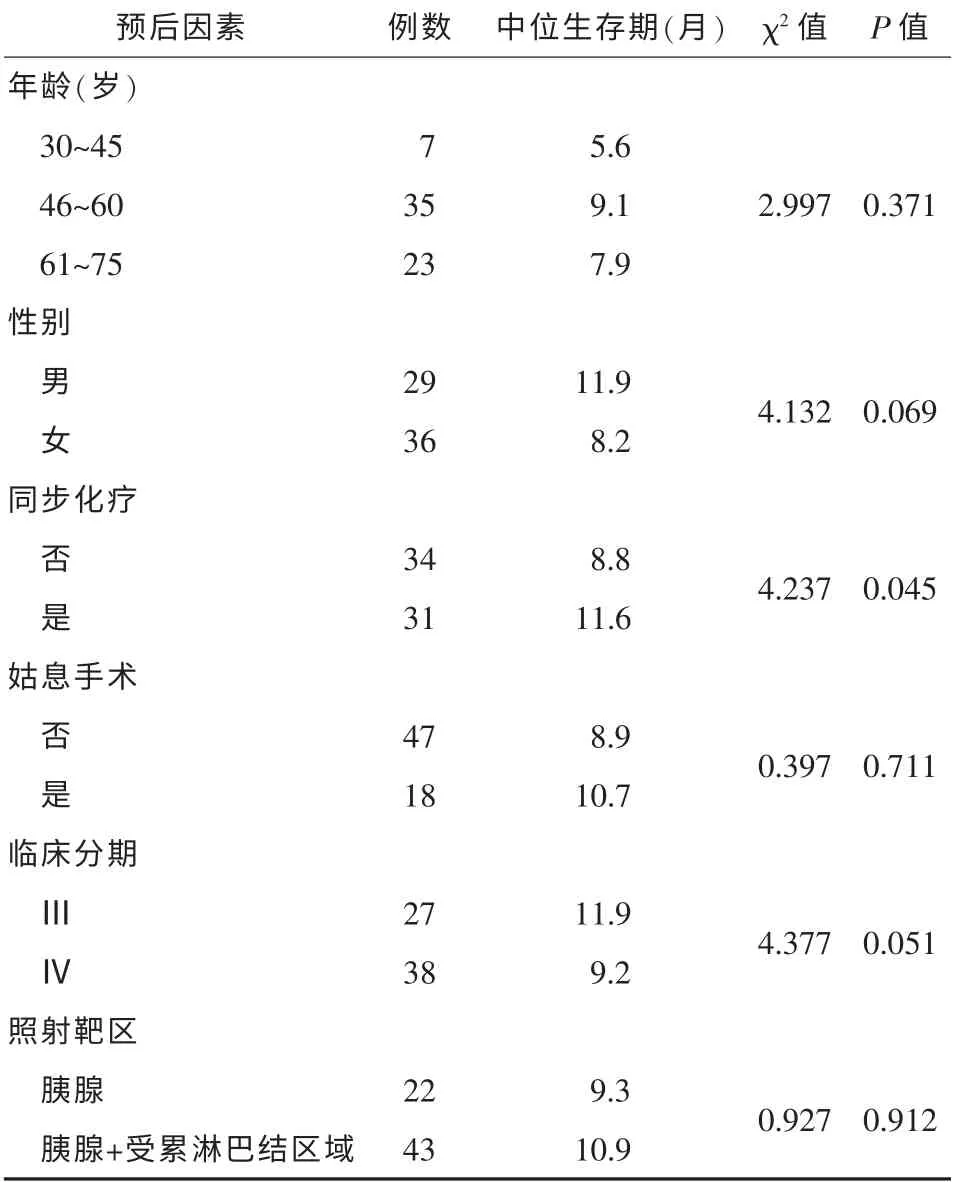
表1 65 例局部晚期胰腺癌患者的单因素分析结果
2.2 患者生存状况分析临床患者亚组分析结果显示:在所有临床Ⅲ期患者中,IMRT 联合Nab-P 与吉西他滨组患者的中位生存期(14.2 个月)明显高于IMRT 组患者(11.7 个月),χ2=3.99,P=0.041。 IV期患者中,IMRT 联合Nab-P 与吉西他滨组和IMRT组患者的中位生存期分别为12.9 个月和7.6 个月,两组之间的差异无统计学意义(χ2=0.713,P=0.457)。见图1。
2.3 临床不良反应评价及患者生存质量分析胰腺癌患者化疗后不良反应主要为恶心、呕吐、腹痛、骨髓抑制、上消化道出血及肝肾功能损伤等,如表2所示。 恶心、呕吐等症状发生率较高,其他症状的发生率均在可接受范围内,且给予对症支持治疗后好转。两组不良反应发生率比较,无统计学意义。发生率未明显增加,患者耐受良好。 依据Burris 等制定的临床受益反应标准,IMRT 组34 例患者中,3 例患者镇痛药物用药量减少≥50%,8 例患者疼痛强度减少≥50%,6 例患者体力状况改善≥20 分,5 例体重增加≥7%, 临床受益率为64.71%;IMRT 联合Nab-P 与吉西他滨组31 例患者中,6 例患者镇痛药物用药量减少≥50%,10 例患者疼痛强度减少≥50%,4 例患者体力状况改善≥20 分,2 例体重增加≥7%,临床受益率为70.96%。两组生存质量分析表明,两组患者临床均有良好受益率,但两组之间的差异无统计学意义。

图1 不同临床分期患者的胰腺癌的生存曲线
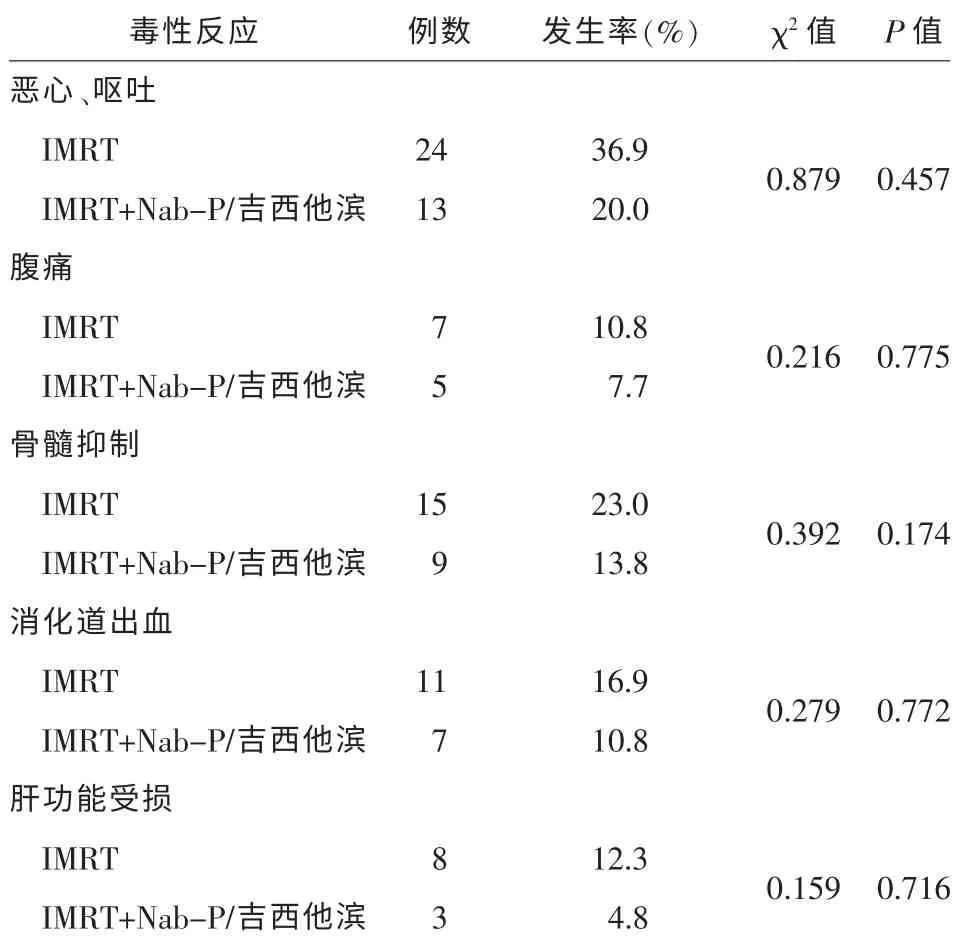
表2 65 例晚期胰腺癌患者的化疗方案及不良反应
3 讨 论
多年来,晚期胰腺癌只有吉西他滨单药化疗的标准治疗,但由于其疗效有限,多数患者接受吉西他滨治疗后不久便出现病情进展。 目前对晚期胰腺癌的晚期治疗尚没有标准的治疗方案。 因此,迫切需要寻找晚期胰腺癌最优治疗方案。 Nab-P 是紫杉醇和白蛋白结合形成的一种纳米颗粒制剂,其是利用白蛋白受体的独特靶向转运机制,使Nab-P 直接分布于肿瘤细胞, 增加肿瘤间质中的紫杉醇浓度,提高了抗肿瘤活性,该药静脉滴注时间短、抗肿瘤活性强、不良反应低。有文献报道,应用Nab-P 治疗晚期胰腺癌的Ⅱ期临床研究。 在该研究中, 应用IMRT 联合Nab-P 与吉西他滨组治疗后, 患者中位生存期明显延长,不良反应未明显增加。
该研究首次将IMRT 联合Nab-P 与吉西他滨方法应用于晚期胰腺癌患者治疗,结果发现晚期胰腺癌患者的临床分期和IMRT 是否联合Nab-P 与吉西他滨是影响局部晚期胰腺癌治疗后生存时间的主要相关因素。 临床研究结果发现,晚期胰腺癌Ⅲ期患者中IMRT 联合Nab-P 与吉西他滨组的中位生存期(14.2 个月) 明显高于IMRT 组(11.7 个月), 且两组之间的差异有显著统计学意义 (P<0.05),而IV 期患者中,两组中位生存期差异无统计学意义(P>0.05)。
综上所述,采用IMRT 联合Nab-P 与吉西他滨对晚期胰腺癌患者疗效较好,并且不良反应可以耐受,安全性较好。 此治疗方案为晚期胰腺癌的后续治疗提供了选择性。 但该研究样本量较小,后续仍待进一步观察分析和研究。
