气相色谱法测定噻虫嗪在稻田中的残留
2019-12-18郭明程郑尊涛聂东兴
郭明程,郑尊涛,聂东兴,汤 涛
(1.农业农村部农药检定所,北京 100125;2.浙江省农业科学院农产品质量标准研究所,杭州 310021)
噻虫嗪(thiamethoxam),化学名称为3-(2-氯-1,3-噻唑-5-基甲基)-5-甲基-1,3,5-二唑-4-亚基(硝基)胺,是由先正达公司开发的第二代新烟碱类杀虫剂,可选择性抑制昆虫乙酰胆碱酯酶受体,进而阻断中枢神经系统的正常传导,使昆虫麻痹死亡,主要用于水稻、棉花、蔬菜等作物,有效防治同翅目、双翅目、鞘翅目等害虫[1-3]。目前已报道的噻虫嗪在稻田系统相关基质中的残留检测方法较少[4-5],而采用气相色谱法检测尚未见报道。本研究建立了气相色谱法测定糙米、谷壳、植株、土壤和稻田水中噻虫嗪残留量的分析方法,方法简便、快速,准确度和精密度高,适用于大量样品中噻虫嗪的残留检测。
1 材料与方法
1.1 仪器与试剂
GC-2010气相色谱仪(具ECD检测器),岛津公司;SPS402F电子天平(精确至0.01 g),奥豪斯公司;AB135-S电子天平(精确至0.1 mg),梅特勒-托利多公司;TYZD-IIA振荡器,天仪电子仪器有限公司;VTX-3000L涡旋仪,杭州雷琪实验器材公司;R-210旋转蒸发仪及V-700真空泵,瑞士Buchi公司。
噻虫嗪标准品(纯度99%),德国Dr.Ehrenstorfer公司;甲醇、乙腈(色谱纯),德国Merck公司;丙酮、石油醚、氯化钠、无水硫酸钠(分析纯),国药集团化学试剂有限公司;中性氧化铝(100~200目,5%水脱活),天津博纳艾杰尔科技有限公司;实验用水均为经Milli-Q超纯水器纯化的超纯水。
1.2 样品前处理
1.2.1 提取
糙米、谷壳、植株、土壤:称取样品10~20 g(糙米和土壤为20 g、谷壳和植株为10 g,精确至0.01 g),置于250 mL具塞三角瓶中,加入50.0 mL乙腈(谷壳和植株样品再加10.0 mL蒸馏水),振荡60 min,用布氏漏斗抽滤后,抽滤液转移至100 mL具塞量筒(已装约10 g氯化钠),振荡1 min,静置分层,吸取25.0 mL(糙米样品取10.0 mL)上清液至50 mL或100 mL平底烧瓶中,于40℃水浴锅中浓缩干,待净化。
稻田水:量取水样25.0 mL(精确至0.1 mL),置于100 mL具塞量筒中(已装有10 g氯化钠),加入50.0 mL乙腈,剧烈振荡1 min,静置分层,吸取40.0 mL上清液至100 mL平底烧瓶中,于40℃水浴锅中浓缩干,待净化。
1.2.2 净化
在玻璃层析柱中装填5.0 g中性氧化铝,10.0 mL石油醚预淋,用5.0 mL石油醚和丙酮(体积比1∶1)溶解平底烧瓶中的残留物并上柱,用25.0 mL石油醚和丙酮(体积比1∶1)淋洗,再用30.0 mL乙腈淋洗并收集淋洗液,于40℃水浴锅中浓缩干,用5.0 mL乙腈定容(水、糙米样品定容至2.0 mL),待气相色谱仪检测。
1.3 仪器检测条件
色谱柱:RXT-1701色谱柱(30 m×0.25 mm,0.25 μm);载气:氮气,200 kPa(恒压模式);进样口温度:260℃;检测器温度:300℃;程序升温:120℃,1 min,25℃ /min;250℃ ,3 min,30℃ /min;280℃ ,2 min;分流比:10∶1;进样量:1.0 μL。
1.4 标准曲线的绘制
将108 mg/L噻虫嗪标准溶液用乙腈稀释,得到0.010 8、0.021 6、0.054 0、0.108、0.216、0.540、1.08 mg/L系列标准溶液。在上述色谱条件下进行测定,以噻虫嗪标准溶液质量浓度为横坐标(x),标样峰面积为纵坐标(y)绘制标准曲线。
1.5 添加回收率的测定
分别在空白稻田水、土壤、糙米、植株和稻壳样品中添加3档不同浓度的噻虫嗪标样溶液,每档浓度重复5次,用上述分析方法测定回收率及变异系数。
2 结果与分析
2.1 提取剂的优化
选择合适的提取溶剂,有利于目标化合物由基质向提取溶剂转移,从而提高目标化合物的提取效率。常用的提取溶剂有乙腈、丙酮、甲醇、乙酸乙酯等,本研究选取乙腈、乙酸乙酯和甲醇作为提取溶剂,对比各提取溶剂对糙米、谷壳、植株、土壤和稻田水等5种基质中噻虫嗪的提取效果,结果见图1。乙腈、乙酸乙酯、甲醇的回收率分别为88%~102%、65%~74%、81%~92%,变异系数分别为1.0%~6.8%、2.7%~10.3%、9.4%~16.3%。乙腈和甲醇的提取效果均较好,但乙腈提取平行性更佳。因此,最终选择乙腈作为提取溶剂。
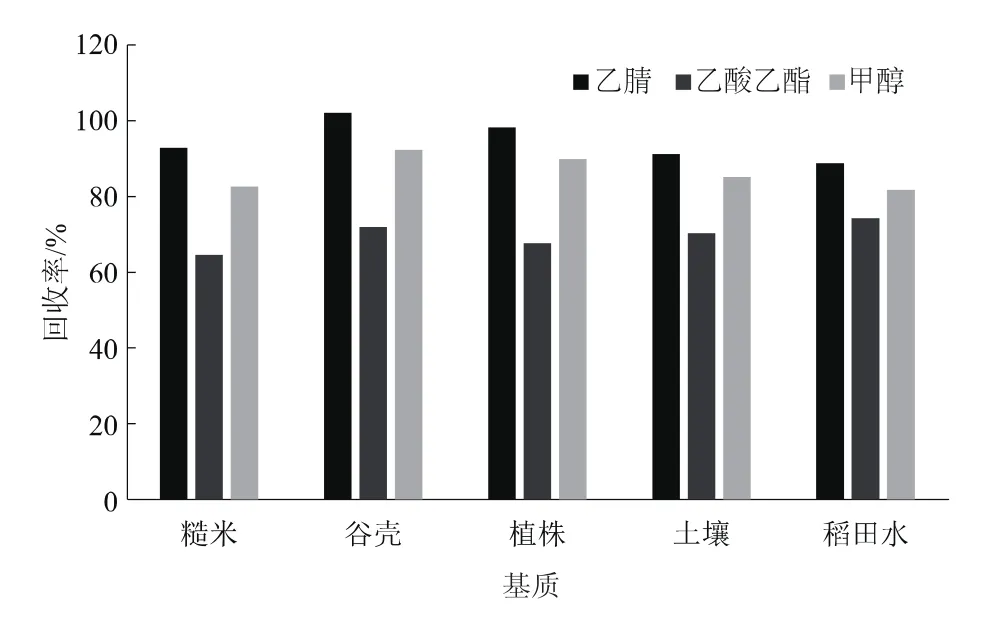
图1 提取溶剂对5种基质中噻虫嗪的提取效率的影响
2.2 净化材料的选择
基质中的其他杂质可干扰噻虫嗪的检测,为消除干扰,选择5.0 g弗罗里硅土(2%水脱活)、5.0 g弗罗里硅土(2%水脱活)+0.1 g活性炭、5.0 g中性氧化铝(5%水脱活)、5.0 g中性氧化铝(5%水脱活)+0.1 g活性炭作为层析净化材料,并对比其净化效果,结果见图2。

图2 净化材料对5种基质中噻虫嗪的提取效率的影响
弗罗里硅土(2%水脱活)、弗罗里硅土(2%水脱活)+活性炭、中性氧化铝(5%水脱活)、中性氧化铝(5%水脱活)+活性炭的回收率分别为85%~110%、79%~97%、85%~106%、77%~105%,变异系数分别为3.5%~11.8%、3.1%~11.3%、5.1%~9.4%、5.9%~10.2%。4组净化材料均满足提取噻虫嗪的要求,但考虑到弗罗里硅土的价格较高和实验操作的便利性,最终选择5.0 g中性氧化铝(5%水脱活)作为层析净化材料。
2.3 方法线性范围、检出限与定量限
噻虫嗪的峰面积与其质量浓度在0.010 8~1.08 mg/L范围内呈良好的线性关系,其标准曲线方程为y=444 293x-3 162.5,相关系数为0.999 8。以3倍信噪比(S/N)计算,噻虫嗪的检出限为1.1×10-11g,以低档添加水平为准,噻虫嗪在稻田水中的定量限为0.005 4 mg/L,在糙米、土壤中的定量限均为0.011 mg/kg,在稻壳、植株中的定量限均为0.054 mg/kg。
2.4 添加回收率和精密度
在优化的仪器条件和样品前处理条件下,采用空白基质进行加标回收试验,结果见表1。噻虫嗪在植株中添加0.054~2.2mg/kg时,平均回收率为96%~107%,变异系数为1.4%~7.5%;土壤中添加0.011~1.1 mg/kg时,平均回收率为93%~100%,变异系数为3.8%~4.4%;稻田水中添加0.005 4~0.22 mg/kg时,平均回收率为92%~100%,变异系数为2.5%~5.1%;糙米中添加0.011~1.1 mg/kg时,平均回收率为86%~97%,变异系数为0.6%~2.7%;谷壳中添加0.054~2.2 mg/kg时,平均回收率为83%~102%,变异系数为4.0%~9.8%。图3~图11为噻虫嗪标样、土壤空白、土壤添加、植株空白、植株添加、稻田水添加、糙米添加和谷壳添加噻虫嗪的色谱图。回收率和精密度均满足检测稻田基质中噻虫嗪的方法要求。

表1 噻虫嗪在植株、土壤、稻田水、糙米和谷壳中的添加回收率及变异系数

图3 噻虫嗪溶剂标样色谱图(0.108 mg/L)

图4 噻虫嗪溶剂标样色谱图(1.08 mg/L)

图5 土壤空白色谱图
图6 土壤添加噻虫嗪(0.1 mg/L)色谱图
图7 植株空白色谱图

图8 植株添加噻虫嗪(0.2 mg/L)色谱图

图9 稻田水添加噻虫嗪(0.2 mg/L)色谱图

图10 糙米添加噻虫嗪(0.1 mg/L)色谱图

图11 谷壳添加噻虫嗪(2 mg/L)色谱图
3 结论
本研究建立了糙米、谷壳、植株、土壤和稻田水中噻虫嗪残留量的检测方法。在优化条件下,噻虫嗪在各基质中的回收率为83%~107%,变异系数为0.6%~9.8%,噻虫嗪在稻田水中的定量限为0.005 4 mg/L,在糙米、土壤中的定量限均为0.011 mg/kg,在谷壳、植株中的定量限均为0.054 mg/kg。方法的重复性好、灵敏度高,符合农药残留检测要求,适用于稻田样品中噻虫嗪残留量的检测。
