PET/CT和MRI在多发性骨髓瘤诊断中的应用价值及影像表现分析
2019-12-18江苏省南通市肿瘤医院影像科江苏南通226006
江苏省南通市肿瘤医院影像科(江苏 南通 226006)
周存凉1 丁勇生1 沈月红1
多发性骨髓瘤(MM)是骨髓内浆细胞出现异常增殖引起血液系统恶性肿瘤,通常前驱病变表现为单株免疫球蛋白血症。在血液系统肿瘤中MM占比10%左右,多见于中老年患者,但近年来发病年龄有年轻化趋势[1-2]。MM临床表现有骨质疏松、骨痛、出血等,骨髓瘤骨病是其特征性病症。由于MM病因尚未明确,病情发展隐匿缓慢,漏诊率及误诊率均较高[3]。有研究显示在MM无症状期进行早期干预有利于延长患者生存期,因此有效诊断MM十分关键。常规X线检测是诊断MM的基本标准,但患者仅在骨小梁被破坏超过30%时才显示阳性,大约有20%左右患者在X线检查后表现出阴性[4]。磁共振成像(MRI)可在骨破坏早期显示患者骨髓内异常浆细胞浸润情况,但扫描范围较为局限,全身显像耗时长且费用昂贵[5]。正电子发射计算机断层显像(PET/CT)是一种分子影像学检查方式,可通过评估病灶处代谢增值情况进行诊断,诊断范围更广且诊断效能更高[6]。基于此,本研究通过MRI及PET/CT诊断MM,旨在比较两种检测方式在MM诊断中应用价值。
1 资料与方法
1.1 一般资料 选择2016年12月到2018年3月到医院就诊MM患者55例,年龄45-80岁,平均(61.27±6.30)岁;男性29例,女性26例;贫血51例,骨痛46例,发热32例,病理性骨折18例;合并高血压20例,冠心病12例。纳入标准:(1)根据《中国MM诊治指南2015》[7]检查确诊为MM患者;(2)患者及医院伦理委员会同意该研究。排除标准:(1)对所用造影剂过敏者;(2)严重心脑血管疾病者;(3)严重出血倾向患者;(4)肝肾功能严重异常者;(5)合并其他恶性肿瘤患者;(6)严重代谢性疾病患者;(7)精神疾病者;(8)糖尿病或其他糖代谢异常疾病患者;(9)检查前3周内有放化疗史者;(10)MRI检查禁忌症者。
1.2 检测方法 所有患者均进行MRI、PET/CT检查,MRI检测:采用德国西门子公司生产MRI扫描仪,利用体线圈扫描患者胸椎、腰椎等部位,层厚选择5mm,层距选择5mm,扫描常规序列,包括矢状位T1WI、T2WI脂肪抑制序列及轴位T2WI等;静脉注射剂量为0.2ml/kg的对比剂钆喷酸葡胺(国药准字H19991127,上海旭东海普药业有限公司,15ml:7.04g)行增强扫描。PET/CT检查:患者检查前禁食6h,控制空腹血糖值低于6.5mmol/L,注射剂量为6.0MBq/Kg显像剂氟代脱氧葡萄糖(18F-FDG)(国药准字H20051183,上海原子科兴药业有限公司,370MBp),休息40min后进行排尿,分别进行身体及颅脑扫描;患者检查途中需保持平静呼吸,CT扫描参数为电流100mA,电压120kV,层厚5mm,螺距5.0;PET显像采集6-7个床位,通过3D采集模式,每个床位采集时间约2min;将PET及CT图像进行融合,勾选感兴趣区并计算相应参数。
1.3 观察指标 ①统计MM在MRI、PET/CT中影像学表现;②统计MRI、PET/CT诊断效能;③统计MRI、PET/CT对不同类型MM检出率;④与病理检测结果比较,统计MRI、PET/CT对MM分期情况。
1.4 统计学方法 本文数据通过SPSS17.0处理,无序分布数据组间比较采取χ2检验,等级资料采用秩和检验,P<0.05表示有统计学意义。
2 结 果
2.1 MM在MRI、PET/CT中影像学表现 MM患者在常规T1WI序列上骨髓信号表现为弥漫性低信号,受累严重病灶在T1WI序列表现为结节状或斑片状低信号骨质破坏,并在T2WI序列上表现为高信号。MM患者在PET/CT中表现如下:骨髓弥漫型患者多处骨质摄取FDG不均匀,难以见到骨破坏征象,但在高水平最大标准化摄取值(SUVmax)时可显示;骨质破坏型患者病灶处可见异常18F-FDG摄取浓聚,表现为穿凿样或膨胀性皂泡,周围存在软组织肿块影;髓外病变型患者可见全身骨质遭到不同程度破坏,FDG存在不同程度摄取。
2.2 MRI、诊断效能比较PET/CT诊断准确率、灵敏度均高于MRI,差异有统计学意义(P<0.05);MRI、PET/CT特异度差异无统计学意义(P>0.05);见表1。
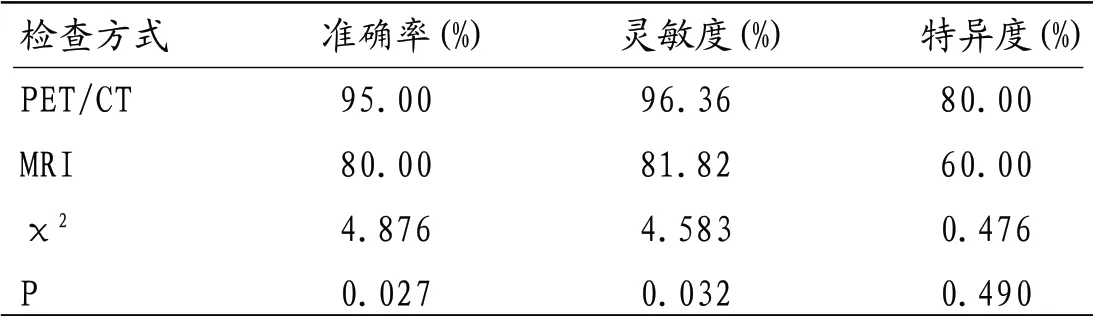
表1 MRI、PET/CT诊断效能比较
2.3 MRI、PET/CT对不同类型MM检出率比较 PET/CT在骨质破坏型检出率高于MRI,差异有统计学意义(P<0.05);MRI、PET/CT在骨髓弥漫型及髓外病变型检出率无明显差异,差异无统计学意义(P>0.05);见表2。
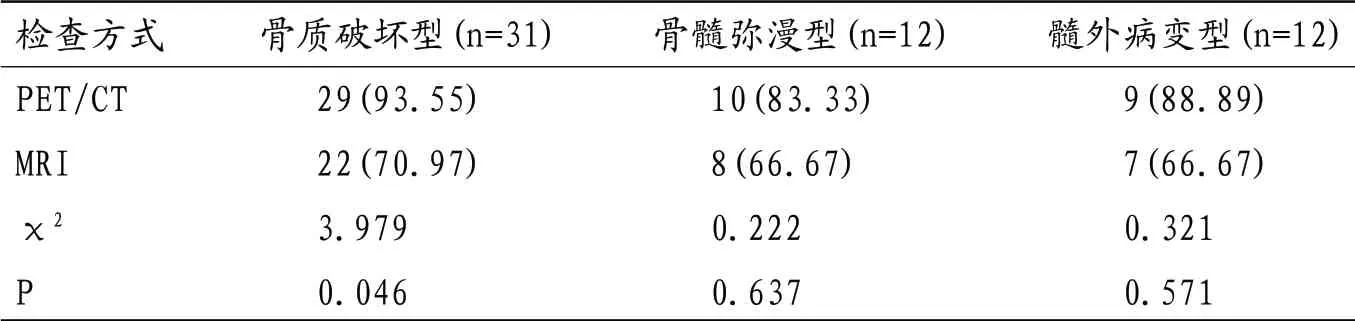
表2 MRI、PET/CT对不同类型MM检出率比较[例(%)]
2.4 MRI、PET/CT对MM分期情况比较 MRI、PET/CT对MM分期情况无明显差异,差异无统计学意义(P>0.05);见表3。

表3 MRI、PET/CT对MM分期情况比较(例)
2.5 图像分析 MM患者为女性,55岁,PET/CT及MRI检测图像,见图1-6。
3 讨 论
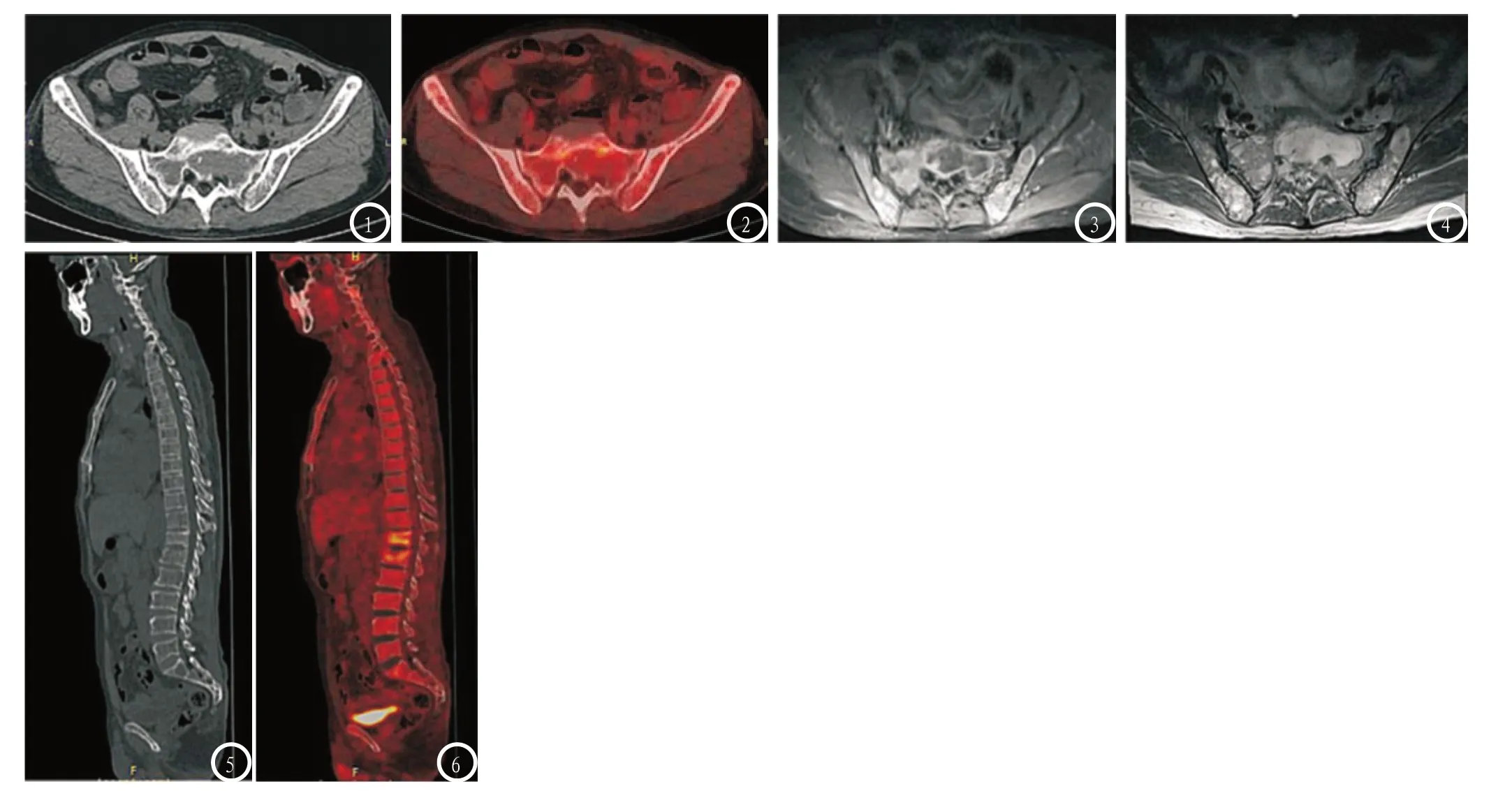
图1 CT显示骶骨见斑片状骨质破坏,两侧髂骨密度不均匀;图2 PET/CT图像显示骶骨及两侧髂骨不均匀放射性浓聚;图3 T1WI增强图像,骶骨及两侧髂骨不均匀强化;图4 T2WI图像,骶骨及两侧见片状及斑点状高信号。图5 CT图像显示胸腰椎骨质疏松,T12、L1椎体骨质破坏不明显,L1椎体轻度压缩改变;图6 PET/CT图像显示T12、L1放射性浓聚
MM在恶性肿瘤中发病率占比1%左右,仅低于白血病及非霍奇金淋巴瘤。流行病学调查显示MM在60-70年龄范围中发病率最高,男女发病比例约为1.5:1。MM首发病症通常为骨痛或病理性骨折,病情发展中超过70%的MM患者将表现出骨质破坏,可能与患者体内成骨细胞与破骨细胞代谢失衡有关[8]。MM源于红骨髓,发病初期骨髓瘤细胞仅局限于骨髓腔内,但随着病情发展,骨髓瘤细胞以弥漫性浸润方式生长,将破坏骨皮质及周围软组织,晚期甚至侵犯邻近器官并向远处转移[9]。
诊断MM主要依据是骨髓穿刺结合血清游离轻链定量等生化参数[10],而影像学检测对诊断及检测疗效十分关键。常规X线检测具有可行性高、骨骼检查全面及费用较低等优势,但无法表现髓外病变及骨髓浸润性病变,对良性骨病鉴别价值有限[11]。国际骨髓瘤组织认为通过DS分期患者,未出现骨骼病变病症也应进行治疗干预,提示部分患者由于X线检查不足无法得到有效治疗。MRI可有效显示骨髓浆细胞出现弥漫性浸润病变,并提升检测不同病因导致压迫骨髓敏感性,其中脂肪抑制序列可进一步提高T2加权像检测骨髓病变敏感度[12]。但由于MRI造影剂具有加大患者出现肾源性系统性纤维化风险,同时存在扫描全身耗时较长、金属异物检查禁忌症等不足,限制其检测效果。PET/CT是一种新型将功能代谢显像及解剖结构显像结合为一体的影像学技术,可显示患者解剖形态并反映组织病理代谢变化[13]。18F-FDG为其常用显像剂,可进入肿瘤细胞内并滞留其中,在肿瘤细胞代谢处于高水平时,将呈现浓聚状态,并通过PET检测出从而产生图像。PET/CT扫描后即可判断肿瘤受累范围及形态大小,并显示其FDG代谢率,从而辨别肿瘤良恶性。有研究显示PET/CT可识别MM中90%以上溶骨性病变及5%以上成骨性病变,有较高敏感性及特异性[14]。
本研究发现PET/CT诊断准确率、灵敏度更高,可能原因为MM骨病累及范围广泛且分布不均,而PET/CT中SUVmax几乎不受部分容积效应影响,同时不受感兴趣区影响,更能反映肿瘤代谢活性。李剑秋等[15]研究发现18F-FDG PET/CT诊断MM准确率96.97%,灵敏度100.00%,特异度83.33%。本研究发现采用PET/CT对骨质破坏型MM检出率更高,可能原因为PET/CT可灵敏显示患者病灶处异常放射性浓聚,呈现特征性表现。
综上所述,本研究采用MRI及PET/CT诊断MM,PET/CT诊断准确率、灵敏度更高,对骨质破坏型患者检出率更高。
