不同浓度葡萄糖对小鼠海马神经元细胞系HT-22细胞凋亡的影响
2019-12-16朱金凤许永劼朱丽英代龙光钱雯张競之许雯李兴潘卫
朱金凤,许永劼,朱丽英,代龙光,钱雯,张競之,许雯,李兴,2△,潘卫,3△
糖尿病脑病是糖尿病慢性并发症之一,以神经元损伤引起的认知功能障碍为主要特征[1],其发病机制复杂,至今尚未完全阐明。脑血管神经病变、氧化应激、炎症反应以及细胞凋亡等均与糖尿病认知障碍机制有关[2]。认知功能障碍的危害性和严重性受到越来越多的关注,有研究表明,一些神经退行性疾病如阿尔茨海默病、帕金森病等均与神经元发生过早、细胞凋亡过度有关[3]。目前常用高糖诱导细胞建立糖尿病脑病模型,主要有原代细胞、神经胶质细胞、大脑皮层细胞、基因工程细胞等,但细胞培养成本较高,不易获得且周期较长。HT-22 细胞是一种永生化的小鼠海马神经元细胞,具有生长稳定,易获得的特点。本研究以HT-22细胞为研究对象,体外模拟高血糖环境,观察不同浓度葡萄糖对HT-22细胞生长和凋亡的影响,从而为进一步从细胞水平探讨糖尿病脑病的发病机制提供理论基础。
1 材料与方法
1.1 试剂与仪器 小鼠海马神经元HT-22细胞购于中乔新舟公司;葡萄糖购于天津风船化学试剂科技有限公司;CCK-8 试剂盒购于日本同仁;二甲基亚砜(DMSO)购于索莱宝公司;0.25%胰蛋白酶、DMEM培养液购于美国Gibco公司;胎牛血清购于以色列BI公司;青霉素及链霉素购于Hyclone公司;乳酸脱氢酶(LDH)试剂盒购于南京建成生物工程研究所;兔源Bcl-2 多克隆抗体购于碧云天生物技术研究所;兔源βactin 多克隆抗体、兔源Bax 多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔抗体均购于武汉三鹰公司。CO2培养箱购于日本SANYO公司;倒置相差显微镜购于日本Nikon公司;Western Blot电泳仪购于美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养、传代及冻存 HT-22 细胞正常生长于含10%胎牛血清的DMEM培养液中,置于37 ℃,5%的CO2培养箱中,隔天传代,传代比例为1∶3。取对数生长期的细胞,弃去培养液,无菌37 ℃磷酸盐缓冲液(PBS)清洗3 次,取1 mL的0.25%胰蛋白酶显微镜下消化15 s左右,用DMEM 培养液终止消化、吹打混匀、重悬,采用低速离心机800 r/min,离心5 min,弃上清液,加入现配的冻存液(DMSO∶FBS=1∶9)吹打混匀后,分装于冻存管中,标明细胞代数、种类、日期及冻存者。置于梯度冻存盒中12 h 以上后存放于液氮罐中长期保存。
1.2.2 CCK-8 法检测不同浓度葡萄糖对HT-22 细胞活力的影响 取对数生长期的HT-22 细胞,经消化、吹打、离心后,以4×104/mL 的密度均匀接种于96 孔板中,每组细胞平行设置5 个复孔。置于37 ℃、5%的CO2培养箱中培养12 h,待细胞生长稳定,用含不同浓度的高糖培养液(25、35、45、55、65、75 mmol/L)分别作用于细胞24、48、72 h,其中以25 mmol/L糖浓度为对照组,其余为实验组,另设没有细胞的空白组。处理结束后每孔加10 μL 的CCK-8 试剂,37 ℃温箱孵育1.5 h,使用酶标仪于450 nm 波长处读取各组细胞光密度(OD)值。细胞活力计算公式=(实验组OD 均值-空白组OD 均值)/(对照组OD均值-空白组OD均值)×100%。
1.2.3 LDH 试剂盒检测不同浓度葡萄糖对HT-22 细胞LDH释放率的影响 将细胞以4×104/mL的密度均匀接种于96孔板中,其中设置空白孔、标准孔、测试孔、对照孔。每组细胞平行设置5个复孔,37 ℃、5%的CO2培养箱中培养12 h后,待细胞生长稳定,将培养液分别更换为不同浓度葡萄糖(同1.2.2),细胞处理48 h后,取每孔细胞上清液20 μL置于96孔板中,严格按照LDH 试剂盒说明书操作进行,使用酶标仪于450 nm波长处读取各组细胞OD值。
1.2.4 光学显微镜观察不同浓度葡萄糖作用HT-22 细胞形态的变化 将细胞以6×104/mL的密度均匀铺板于6孔板中,待细胞生长至60%左右时,将培养液分别更换为不同浓度葡萄糖(同1.2.2),细胞处理48 h 后,采用倒置相差显微镜观察各组细胞形态及数量的变化。
1.2.5 流式细胞术检测不同浓度葡萄糖对HT-22 细胞凋亡的影响 将细胞以6×104/mL的密度均匀铺板于6孔板中,置于37 ℃、5%的CO2培养箱中培养12 h 后,待细胞生长稳定,将培养液分别更换为不同浓度葡萄糖(同1.2.2),细胞处理48 h后,弃去培养液,37 ℃无菌PBS清洗3次,加入0.125%不含EDTA 的胰蛋白酶显微镜下消化5~10 min,加入适量DMEM 培养液终止消化。采用低速离心机1 000 r/min,离心5 min,弃上清,收集细胞,按照说明书操作进行,加入500 μL的Binding Buffer 悬浮细胞,按要求依次加入5 μL 的Annexin V-FITC 和 5 μL 的 Propidium Iodide 充分混匀,室温避光反应10 min,1 h内采用流式细胞仪检测细胞凋亡情况。
1.2.6 蛋白印迹法检测不同浓度葡萄糖对HT-22 细胞凋亡相关蛋白表达的影响 将各组细胞培养后,弃上清,37 ℃无菌PBS 清洗3 次后,加入细胞裂解液冰上裂解30 min,置于4 ℃低温高速离心机12 000 r/min离心10 min,取上清液,BCA法测定蛋白浓度。以30 μg 蛋白质溶液为总上样量,取适量体积的5×SDS 上样缓冲液充分混匀,100 ℃变性10 min,经12%SDS-PAGE 凝胶电泳分离后,将蛋白转移到0.45 μm 的PVDF 膜上,脱脂奶粉室温封闭2 h,4 ℃摇床孵育一抗βactin(1∶10 000)、Bcl-2(1∶1 000)、Bax(1∶10 000)过夜。TBST 缓冲液洗膜3 次,每次10 min,室温下孵育带有HRP 标记的羊抗兔 IgG(1∶20 000)二抗2 h,TBST 缓冲液洗膜3 次,每次10 min。使用化学发光成像系统采集图像,Image J软件进行分析统计,计算各组蛋白的相对表达量。
1.3 统计学方法 采用SPSS 19.0统计学分析软件进行数据处理。计量数据采用均数±标准差(±s)表示,细胞存活率均数比较采用重复测量数据方差分析,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度葡萄糖对细胞活力的影响 不同浓度的高糖分别处理HT-22 细胞24、48、72 h 后,结果显示以剂量依赖(F=53.836,P<0.01)和时间依赖(F=15.211,P<0.01)降低细胞活力,并且两者具有交互作用(F=12.512,P<0.01)。48 h 后,55 mmol/L和65 mmol/L 浓度组细胞活力为80%左右,见表1。根据美国药典细胞毒性分级,当细胞活力≥80%时属于1 级细胞,可满足实验要求。后续研究将48 h 确定为最适作用时间。
Tab.1 The effects of different concentrations of glucose and different treatment time on the viability of HT-22 cells表1 不同浓度葡萄糖处理不同时间对HT-22细胞活力的影响 (n=5,%,±s)

Tab.1 The effects of different concentrations of glucose and different treatment time on the viability of HT-22 cells表1 不同浓度葡萄糖处理不同时间对HT-22细胞活力的影响 (n=5,%,±s)
**P<0.01;a 与 35 mmol/L 组比较,b 与 45 mmol/L 组比较,c 与 55 mmol/L组比较,d与65 mmol/L组比较,P<0.05
组别35 mmol/L组45 mmol/L组55 mmol/L组65 mmol/L组75 mmol/L组F 24 h 95.21±4.41 92.62±6.66 89.47±5.59 86.46±8.16a 73.79±6.29abcd 8.639**48 h 93.84±2.57 93.61±3.80 82.42±7.37ab 80.78±4.35ab 72.42±3.53abcd 19.515**72 h 79.10±6.27 69.24±4.45a 68.02±5.77a 63.64±5.51a 54.89±2.59abcd 14.961**
2.2 不同浓度葡萄糖对HT-22 细胞LDH 释放率的影响 不同浓度葡萄糖作用48 h 后,随着糖浓度的增加,HT-22 细胞LDH 释放率逐渐增加(P<0.05),见表2。
2.3 不同浓度葡萄糖对HT-22 细胞形态变化的影响 不同浓度葡萄糖作用HT-22 细胞48 h 后,倒置相差显微镜下可见对照组细胞生长状态良好,细胞密度大,呈梭形和不规则形,突触交织成致密网状结构,有分支,树突较粗,核仁轮廓隐约可见。其他各实验组出现细胞数目减少,胞体变大,部分胞核溶解,突触断裂,细胞碎片等现象,其中以55、65、75 mmol/L变化较为明显。见图1。
2.4 不同浓度葡萄糖对HT-22 细胞凋亡率的影响 流式细胞术检测结果显示不同浓度葡萄糖作用HT-22细胞48 h后,葡萄糖浓度越高,细胞凋亡情况越严重(P<0.05)。见图2,表2。
2.5 不同浓度葡萄糖对HT-22 细胞凋亡相关蛋白表达的影响 Western blot 结果显示,不同浓度葡萄糖作用 HT-22 细胞 48 h 后,55、65、75 mmol/L 组Bax蛋白表达量显著高于对照组,而Bcl-2 蛋白表达量显著低于对照组(P<0.05)。见图3,表3。
Tab.2 The effects of different concentrations of glucose on LDH release rate and apoptosis rate of HT-22 cells表2 不同浓度葡萄糖对HT-22细胞LDH释放率及凋亡率的影响 (±s)
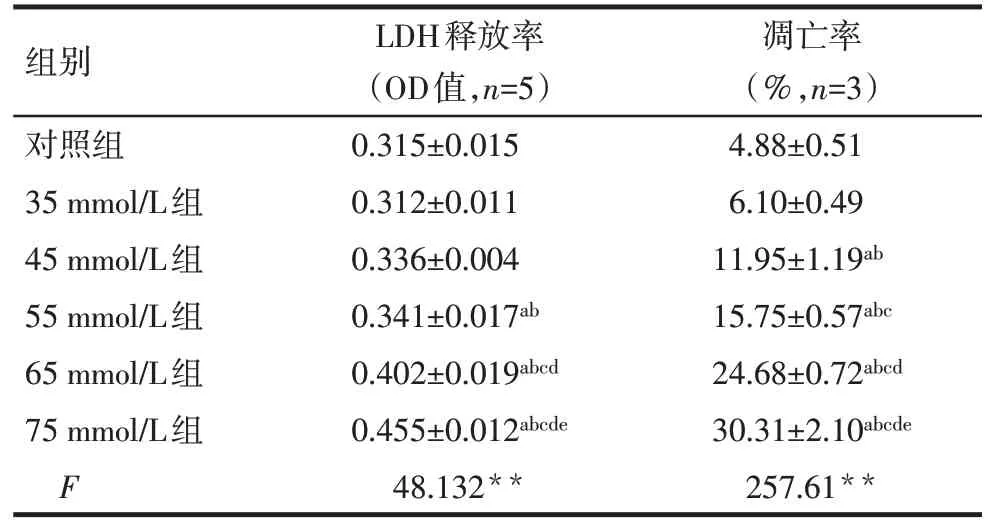
Tab.2 The effects of different concentrations of glucose on LDH release rate and apoptosis rate of HT-22 cells表2 不同浓度葡萄糖对HT-22细胞LDH释放率及凋亡率的影响 (±s)
**P<0.01;a与对照组比较,b与35 mmol/L 组比较,c与45 mmol/L组比较,d与55 mmol/L组比较,e与65 mmol/L组比较,P<0.05
组别对照组35 mmol/L组45 mmol/L组55 mmol/L组65 mmol/L组75 mmol/L组F LDH释放率(OD值,n=5)0.315±0.015 0.312±0.011 0.336±0.004 0.341±0.017ab 0.402±0.019abcd 0.455±0.012abcde 48.132**凋亡率(%,n=3)4.88±0.51 6.10±0.49 11.95±1.19ab 15.75±0.57abc 24.68±0.72abcd 30.31±2.10abcde 257.61**

Fig.1 The effects of different concentrations of glucose on the morphology of HT-22 cells(×200)图1 不同浓度葡萄糖对HT-22细胞形态的影响(×200)
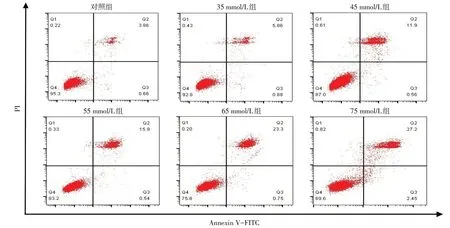
Fig.2 The changes of apoptosis rate of HT-22 cells treated with different concentrations of glucose图2 不同浓度葡萄糖对HT-22细胞凋亡率的影响

Fig.3 The changes of protein levels of Bax and Bcl-2 of HT-22 cells treated with different concentrations of glucose图3 不同浓度葡萄糖对HT-22细胞Bax和Bcl-2表达的影响
Tab.3 Comparison of different concentrations of glucose on the expressions of Bax and Bcl-2 in HT-22 cells表3 不同浓度葡萄糖对HT-22细胞Bax和Bcl-2表达情况的比较 (n=3,±s)
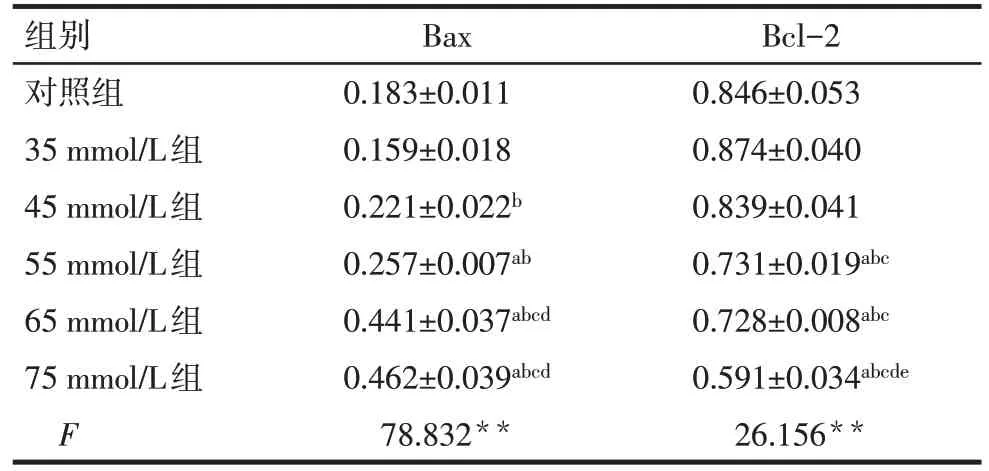
Tab.3 Comparison of different concentrations of glucose on the expressions of Bax and Bcl-2 in HT-22 cells表3 不同浓度葡萄糖对HT-22细胞Bax和Bcl-2表达情况的比较 (n=3,±s)
**P<0.01;a与对照组比较,b与35 mmol/L 组比较,c与45 mmol/L组比较,d与55 mmol/L组比较,e与65 mmol/L组比较,P<0.05
组别对照组35 mmol/L组45 mmol/L组55 mmol/L组65 mmol/L组75 mmol/L组F Bax 0.183±0.011 0.159±0.018 0.221±0.022b 0.257±0.007ab 0.441±0.037abcd 0.462±0.039abcd 78.832**Bcl-2 0.846±0.053 0.874±0.040 0.839±0.041 0.731±0.019abc 0.728±0.008abc 0.591±0.034abcde 26.156**
3 讨论
糖尿病脑病作为糖尿病严重并发症之一,认知功能障碍是其主要表现特征[4]。研究表明,高血糖是糖尿病认知功能障碍的重要原因之一,认知功能损害的严重程度与血糖控制水平的高低有直接关系[5]。正常浓度的葡萄糖可以促进细胞增殖,然而高浓度的葡萄糖可损害细胞功能并诱导细胞发生凋亡[6-7]。细胞凋亡是引起糖尿病脑神经病变的一种重要方式,脑细胞凋亡在糖尿病性脑神经病变病理过程中起重要的作用,已有研究表明高糖对多种细胞或动物模型具有诱导细胞衰老与凋亡的作用。本研究以小鼠海马神经元细胞系HT-22细胞为对象,研究不同浓度葡萄糖对细胞凋亡的影响。
Keats 等[8]发现高血糖水平可导致内皮细胞生长抑制并且可改变分化潜能。另有研究表明高糖可诱导细胞损伤,其中包括细胞活力降低及凋亡率增高[9]。本研究发现,高糖对HT-22 细胞生长具有明显的抑制作用,并且具有浓度依赖性,葡萄糖浓度越高,抑制细胞活性作用越强。参照课题组前期对原代海马神经元细胞培养的研究[10],本研究设置了相应的糖浓度,不同浓度葡萄糖分别作用HT-22细胞48 h,细胞活力显著下降,且LDH 释放率显著上升,大部分细胞活力在80%以上。因此,本研究将高糖浓度作用最佳时间确定为48 h,这为后续细胞损伤模型的建立奠定了基础。Dludla等[11]和梁家亮等[12]发现高糖可诱导H9c2心肌细胞发生凋亡;侯佳等[13]发现高糖浓度在40、50 mmol/L时能显著诱导小鼠视网膜毛细血管周细胞发生凋亡。本研究结果显示在高糖环境下,随着糖浓度增高,HT-22细胞凋亡率明显增高,由此可见,高糖导致HT-22细胞凋亡可能是引起糖尿病脑病的一个重要因素。
越来越多的研究表明细胞凋亡在糖尿病脑病的发生发展中扮演着重要的角色。细胞凋亡是由基因控制的细胞自主有序性的死亡,其中涉及一系列基因的激活、表达以及调控等过程。其中,Bcl-2 家族在各刺激信号引起的细胞凋亡过程中发挥着重要作用,是目前研究细胞凋亡机制较为常见和成熟的途径之一,在调节线粒体凋亡通路中起着关键作用,其家族包括以Bax 为代表的促凋亡因子和以Bcl-2 为代表的抗凋亡因子。当Bax 过度表达,Bax 与Bcl-2异源二聚体解离,形成Bax-Bax的同源二聚体,从而加速细胞凋亡,减弱Bcl-2 对细胞的保护作用。由此可以看出,促进凋亡蛋白和抑制凋亡蛋白的比值共同决定了细胞的命运[14]。有研究发现脂联素可减轻高糖对人心肌细胞株凋亡情况,可使Bax 表达下调,Bcl-2表达上调[15]。本研究发现随着糖浓度的增高,细胞凋亡率也明显增高,此结果与杨璐等[16]的研究结果一致,并且本研究将高糖浓度范围更加细化,并进一步研究发现高糖浓度在55、65、75 mmol/L 作用细胞时,凋亡相关蛋白Bax 表达增加,Bcl-2 表达下降。由此可以证明高糖可通过调节Bax 和Bcl-2蛋白的表达,从而促进HT-22细胞发生凋亡。
综上所述,高糖可通过诱导细胞发生凋亡而抑制HT-22细胞生长,且随着糖浓度的升高,凋亡率也显著上升,具有浓度依赖性。今后将继续更加深入研究糖尿病脑病发生发展的机制,为糖尿病脑病防治提供思路和方向。
