胃癌组织中幽门螺杆菌感染和p-p65、EMT相关蛋白的表达及临床意义
2019-12-13谭林王骞屈伟明艾琼嘉陈维顺黄美园
谭林,王骞,屈伟明,艾琼嘉,陈维顺,黄美园
胃癌是严重威胁人类生存和健康的恶性肿瘤,我国是全世界胃癌的高发地域之一,据统计我国胃癌无论发病率还是死亡率均高居所有恶性肿瘤前三位[1]。由于早期症状不明显,大部分患者胃癌确诊时已发生转移,导致患者不良预后。幽门螺杆菌(Helicobacterpylori,H.pylori)感染易引起慢性胃炎和消化性溃疡,已被WHO作为Ⅰ类致癌因素[2]。研究发现,幽门螺杆菌的毒力因子CagA在胃黏膜上皮细胞可通过激活NF-κB通路发挥多种生物学效应,如炎性,细胞永生化,细胞增殖,抗凋亡,血管新生,上皮细胞延伸和极性的丧失诱发上皮间质转化(Epithelial-Mesenchymal Transition, EMT)导致肿瘤侵袭转移等,与胃癌的发生发展密切相关[3-4]。磷酸化p65(p-p65)是NF-κB信号通路重要组成部分,可作为NF-κB信号传导通路活化的标志[5]。本研究通过检测胃癌和癌旁正常组织中H.pylori感染情况及p-p65、EMT相关蛋白的表达,探讨胃癌组织中H.pylori感染和p-p65、EMT相关蛋白表达之间的关系及其临床意义,有望为胃癌转移的预测、诊断和药物或生物治疗提供新的线索。
1 对象与方法
1.1 标本收集
收集中南大学湘雅医学院附属株洲医院2014年8月至2016年5月普外科胃癌根治手术切除标本115例,癌旁正常胃组织标本20例(均为手术切缘,病理证实无癌浸润)。患者术前均未接受放、化疗,所有标本均经术后病理证实,且已通过Giemsa染色法检测法判断患者是否有H.pylori感染。其中阳性68例,阴性47例,男性82例,女性33例,年龄35~86岁(平均年龄61.0岁)。患者对本实验均知情,组织标本的获取和使用均获得本院伦理委员会批准同意。胃癌组织根据国际抗癌联盟(UICC)第7版标准进行临床TMN分期,浸润深度按照UICC标准中的T分期标准确定,依据病理标准确认分化程度。所有标本经4%多聚甲醛固定后,脱水、透明、浸蜡包埋,制成4 μm厚连续切片。
1.2 试剂
兔抗人p-p65(Ser536)多克隆抗体(ab86299)购自英国Abcam公司,鼠抗人E-cadherin单克隆抗(MAB-0738)、鼠抗人Vimentin单克隆(MAB-0738)抗均购自福州迈新公司。SP试剂盒、DAB显色剂、中性树胶封片剂购自北京中杉金桥生物技术有限公司。二甲苯、无水酒精、石蜡、PBS缓冲液、枸橼酸钠缓冲液购自广州瑞斯生物技术有限公司。
1.3 免疫组化染色
常规脱蜡、水化,枸橼酸高压修复2.5 min,H2O2封闭内源性过氧化物酶活性,正常山羊血清封闭,滴加一抗(p-p65浓度为1∶800,Vimentin和E-cadherin均为抗体原液),孵育过夜。DAB显色,苏木素复染,中性树胶封片,显微镜镜检及图像采集分析。
1.4 结果的判断
H.pylori感染的判断:Giemsa染色后在显微镜下观察,胃小凹及腺腔有“S”形分布的红色颗粒为H.pylori感染阳性,否则为H.pylori感染阴性。
免疫组化结果判断:由病理科医师双盲阅片,以胞膜/胞质/胞核中出现黄色或黄褐色颗粒视为免疫组织化学染色阳性。免疫组化计分包括染色强度及阳性细胞比例确定。按染色强度分级:无染色或与背景一致的浅黄色为0分,黄色记1分,棕黄色记2分,黄褐色记3分。按阳性细胞比例分级:每片随机观察5个高倍镜视野(200×),计算染色阳性细胞所占比例:阳性细胞数<5%计0分,5%~25%计1分,26%~50%计2分,>50%计3分。每张切片得分由染色强度评分与阳性细胞比例评分相加所得,0~3分判定为阴性表达,4~6分判定为阳性表达。
1.5 随访
通过电话及门诊对患者进行随访,所有患者均随访至2019年7月或至患者死亡,所有患者随访资料完整。
1.6 统计学方法

2 结果
2.1 胃癌组织和癌旁正常胃组织中H.pylori感染及p-p65、Vimentin和E-cadherin的表达情况
p-p65主要表达于胞质和胞核,Vimentin主要表达于胞质,E-cadherin主要表达于胞质与胞膜。胃癌组织中H.pylori感染率(59.1%)和p-p65、Vimentin阳性表达率(60.0%、34.8%)明显高于癌旁正常组织(30.0%和35.0%、0.0%),而胃癌组织中E-cadherin阳性表达率(53.9%)明显低癌旁正常组织(100%),差异均具有统计学意义(均P<0.05);且p-p65和Vimentin在H.pylori感染阳性胃癌组织中的表达高于H.pylori感染阴性胃癌组织和癌旁正常组织,E-cadherin在H.pylori感染阳性胃癌组织中的表达低于H.pylori感染阴性胃癌组织和癌旁正常组织(图1、表1)。

图1p-p65、Vimentin和E-cadherin分别在H.pylori感染阳性胃癌组织、H.pylori感染阴性胃癌组织及癌旁正常组织中的表达(SP,×200) A、D、G分别为p-p65、Vimentin和E-cadherin在H.pylori感染阳性胃癌组织中的表达;B、E、H分别为p-p65、Vimentin和E-cadherin在H.pylori感染阴性胃癌组织中的表达;C、F、I分别为p-p65、Vimentin和E-cadherin在癌旁正常组织中的表达

表1胃癌和癌旁正常组织中H.pylori感染及p-p65、Vimentin和E-cadherin的表达
2.2 H.pylori感染及p-p65、Vimentin和E-cadherin的表达与胃癌患者临床病理参数的关系
胃癌组织中,H.pylori感染和p-p65的表达与TNM分期、浸润深度、淋巴结转移及远处转移密切相关(P<0.05),与患者性别、年龄、肿瘤大小、分化程度无相关性;Vimentin和E-cadherin的表达与肿瘤大小、TNM分期、浸润深度、淋巴结转移及远处转移密切相关(P<0.05),同时Vimentin的表达还与分化程度有关(P<0.05),与患者性别、年龄无明显相关性(表2)。

表2H.pylori感染及p-p65、Vimentin和E-cadherin在胃癌组织中的表达与临床病理参数的关系
2.3 胃癌组织中H.pylori感染与p-p65、Vimentin和E-cadherin表达的相关性
对115例胃癌组织中H.pylori感染与p-p65、Vimentin和E-cadherin的表达采用Spearman等级相关分析,结果显示:H.pylori感染与p-p65、Vimentin的表达呈显著正相关(rs=0.585,P=0.000、rs=0.260,P=0.005),而与E-cadherin的表达呈显著负相关(rs=-0.343,P=0.000),见表3。
2.4 胃癌组织中p-p65与Vimentin和E-cadherin表达的相关性
对115例胃癌组织中p-p65与Vimentin和E-cadherin的表达采用Spearman等级相关分析,结果显示:p-p65与Vimentin的表达呈显著正相关(rs=0.298,P=0.001),而与E-cadherin的表达呈显著负相关(rs=-0.292,P=0.002,表4)。

表3胃癌组织中H.pylori感染与p-p65、Vimentin和E-cadherin表达的相关性分析
2.5 胃癌组织中H.pylori感染、p-p65、Vimentin和E-cadherin的表达与患者预后的关系
115例患者随访36~60个月,均获得完整随访资料,通过Kaplan-Meier生存曲线及Log-rank检验比较胃癌患者中H.pylori感染、p-p65、Vimentin和E-cadherin的表达与患者预后的关系(图2)。分析显示:有H.pylori感染及p-p65和Vimentin阳性表达患者总生存率明显低于阴性表达患者(P=0.017、P=0.011、P=0.022),E-cadherin阴性表达患者总生存率明显低于阳性表达患者(P<0.001)。Cox多因素回归分析显示:TNM分期、淋巴结转移、远处转移、H.pylori感染及E-cadherin表达阴性是影响胃癌患者预后的独立危险因素(P<0.05),见表5。

表4p-p65与Vimentin和E-cadherin表达的相关性分析
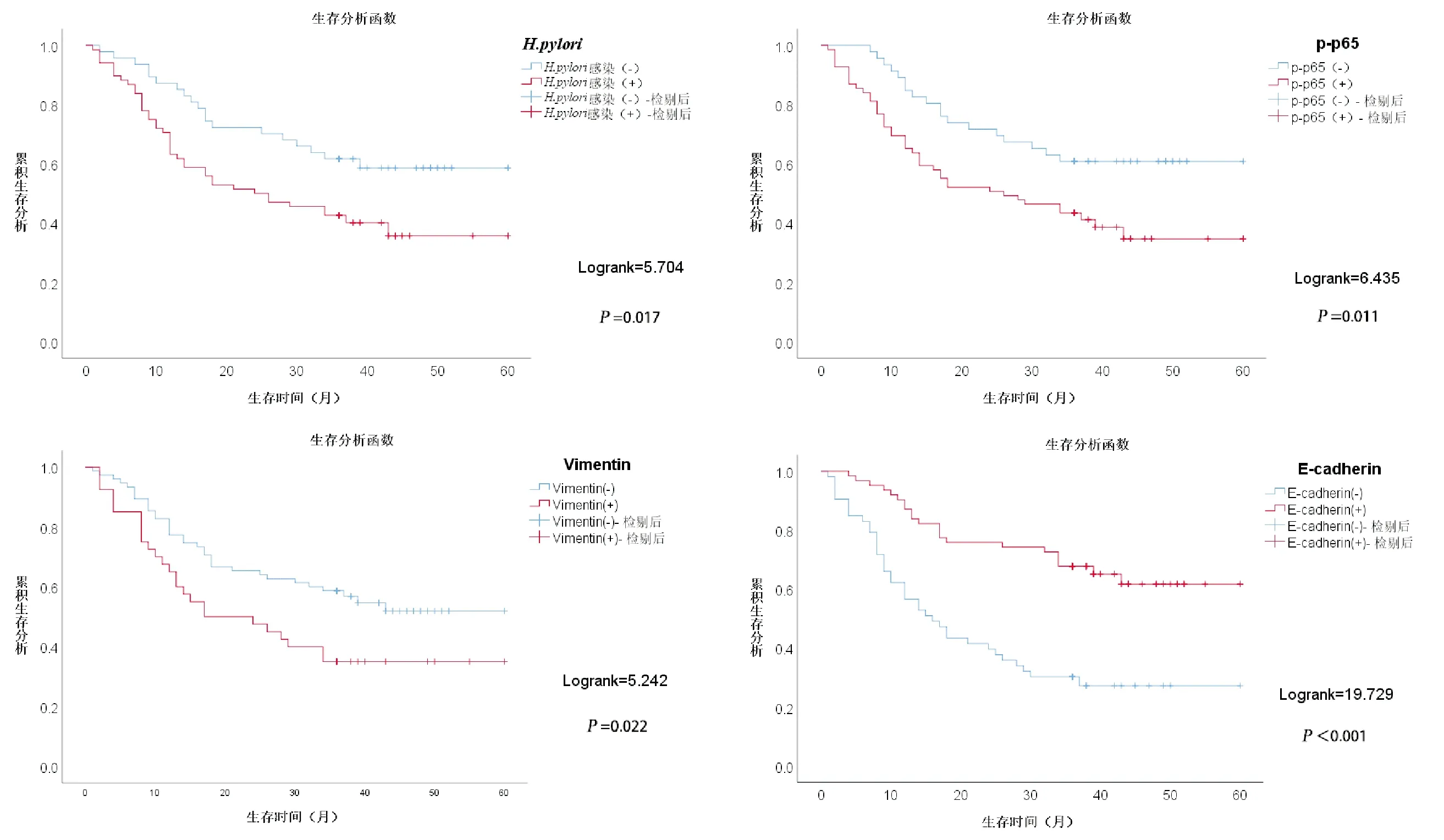
图2H.pylori感染、p-p65、Vimentin和E-cadherin的表达对胃癌患者生存期的影响
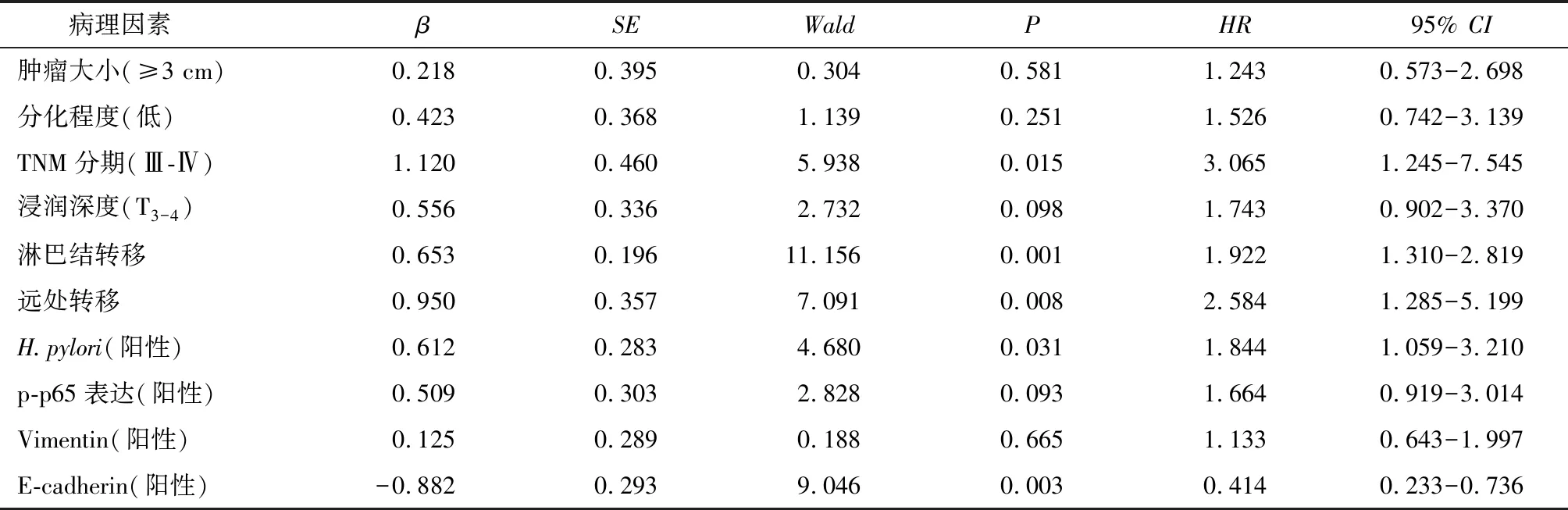
表5影响胃癌患者预后的Cox多因素回归分析
3 讨论
我国是胃癌大国,虽然近年来发病率有所下降,但其在各类恶性肿瘤发病率与死亡率仍高居第二位。大部分患者一经确诊便已是中晚期,丧失了手术根治的最佳时机,对患者的生命健康安全造成了严重影响。侵袭转移是影响胃癌预后的关键因素,是导致胃癌患者死亡的主要原因。
大量研究表明[6],EMT是肿瘤细胞侵袭转移的重要机制之一。EMT是指上皮细胞失去极性以及基膜连接等上皮表型,转化为具有间质表型的生物学过程。通过发生EMT,肿瘤细胞可以获得更好的运动、侵袭和抵抗凋亡刺激,并且EMT还可驱动肿瘤细胞获得干性潜能,从而实现自我更新、肿瘤起始和化疗抵抗等[7]。EMT的主要分子特征:上皮细胞标记物,如E-cadherin表达下调、β-catenin从胞膜到胞核易位表达;间质表型标记物,如波形蛋Vimentin、纤连蛋白Fibronectin等表达上调[8]。因此,可以通过检测这些标志物来鉴定EMT的发生。本研究发现,Vimentin在胃癌组织中的表达明显高于癌旁正常组织,而E-cadherin则正好相反。同时Vimentin与E-cadherin的表水平与肿瘤大小、浸润深度、TNM分期、淋巴结及远处转移有关,Vimentin与肿瘤分化程度亦有关性。生存分析提示Vimentin表达阳性患者的生存率明显低于Vimentin表达阴性患者,E-cadherin则正好相反;多因素Cox回归分析显示:E-cadherin表达阴性是影响胃癌患者预后的独立危险因素。由此可见,EMT在胃癌侵袭转移中发挥重要作用,且影响患者的预后。
NF-κB是炎症向肿瘤转变过程中的一个关键分子,己成为癌症的新标志,近来亦被认为是EMT重要的调节者[9]。在未受到刺激的正常细胞中,NF-κB亚基与I-κBα、β或γ结合,以非活性形式被阻滞在胞浆中,当受到TNF-α等炎症因子刺激后,激活I-κB激酶(IKK)复合物,使IKKβ磷酸化形成p-IKKβ,后者将NF-κB p65/p52二聚体中的p65的Ser536亚基磷酸化(即p-p65),进而启动核转录程序,p-p65进入细胞核内发挥相应的生物学作用,如促进炎症扩散、对抗细胞凋亡、促进细胞增殖、促进肿瘤侵袭转移,此为NF-κB信号通路的经典激活途径[10]。本研究发现,在胃癌组织中p-p65的表达明显高于癌旁正常组织,且其表达水平与TNM分期、浸润深度、淋巴结转移及远处转移有关,表明NF-κB信号通路在胃癌中异常活化,并影响其侵袭转移过程。
H.pylori通常定植于人胃黏膜,它的长期定植引起从慢性胃炎、胃萎缩、肠化生、不典型增生到最终胃癌发生的胃部疾病的渐变,被认为是胃癌发生的高危因素[11-12]。Martel等[13]报道,约有75%~90%的非贲门胃腺癌发病与幽门螺杆菌的感染有关。本研究显示,胃癌组织中H.pylori感染率明显高于癌旁正常组织,且在胃癌组织中H.pylori感染与TNM分期、浸润深度、淋巴结转移及远处转移有关,进一步证实胃癌发生与H.pylori感染密切相关。徐世琴等[14]发现,H.pylori感染可导致胃炎患者胃黏膜中核因子NF-кB表达水平升高,随着患者病情的不断进展NF-кB表达水平也呈现出升高趋势。许多研究表明,H.pylori合成分泌的毒力因子CagA可以引起PI3K和Akt的持续激活,从而导致NF-κB信号通路的活化和EMT相关蛋白表达的变化[15];此外,CagA与TNF受体相关因子6(TRAF6)和TGF-β活化激酶1(TAK1)相互作用以激活TAK1,TAK1磷酸化并激活IKKβ形成p-IKKβ,最终激活NF-κB信号通路[16]。NF-κB信号通路活化后可启动Slug、Twist家族bHLH转录因子1(TWIST1)、锌指转录因子(SNAIL)的转录,从而诱导EMT的发生[17]。总之,H.pylori感染细胞可以激活NF-κB信号通路,在诱导炎癌转变以及胃癌侵袭转移过程中起关键作用[18-19]。本研究表明,胃癌组织中H.pylori感染与p-p65的阳性表达呈显著正相关,提示胃癌中H.pylori感染与NF-κB信号通路的活化之间关系密切。同时,胃癌组织中H.pylori感染和p-p65的表达均与Vimentin的表达呈显著正相关,与E-cadherin的表达呈显著负相关,提示胃癌中H.pylori感染和NF-κB信号通路的活化与EMT的发生密切相关。此外,H.pylori感染与p-p65表达阳性的胃癌患者表现出更差的预后和更低的生存率,多因素分析提示H.pylori感染是影响胃癌患者预后的独立危险因素。基于文献报道及结合本研究结果,我们推测H.pylori感染可能导致NF-κB信号通路的异常活化而诱导EMT发生,从而促进胃癌的发生发展和侵袭转移,进而影响患者预后。但本研究结果表明p-p65的高表达并不能作为胃癌预后的独立危险因素,原因可能为EMT的发生还涉及TGF-β、Wnt、Hedgehog、Notch、FAK等多条信号转导通路[20],NF-κB信号通路可能与上述通路交互作用共同影响胃癌中EMT的进程,具体还需要进一步的研究和探讨。
综上所述,H.pylori感染与NF-κB信号通路的活化及EMT的发生密切相关,在胃癌的发生发展和侵袭转移过程中起重要作用。检测H.pylori感染、p-p65、Vimentin和E-cadherin的表达有助于胃癌患者临床特征及预后的判断,而H.pylori感染影响NF-κB信号通路激活与EMT发生的具体分子机制是我们后续研究重点。
