帕金森病认知功能损害的脑葡萄糖代谢研究
2019-12-13杨新玲
夏 欢,罗 琴,杨新玲
(新疆医科大学1附属肿瘤医院核医学科;2附属肿瘤医院呼吸神经内科,乌鲁木齐 830011;3第二附属医院神经内科,乌鲁木齐 830028)
认知功能障碍是帕金森病(PD)最常见的非运动症状之一[1],包括轻度认知功能障碍(PD-MCI)和痴呆(PDD),PD患者中20%~57%在3~5年发展为PD-MCI,最终80%以上的PD患者随着病情加重发生为PDD,是正常老年人的6倍[2]。认知障碍(CI)使PD患者丧失部分劳动能力,同时降低了PD患者健康相关的生活质量,甚至加重一系列经济和社会负担。因此,本文将运用蒙特利尔认知评估量表(MOCA)和日常生活能力测试表(ADL)评估患者的认知功能受损特点和日常生活能力受影响的程度,并结合PETCT脑18F-FDG代谢显像,重点分析PDD及PD-MCI患者认识域的变化与脑葡萄糖代谢的相关性。
1 资料与方法
1.1 研究对象选择2017年2月-2018年11月在新疆医科大学第二附属医院就诊的原发性PD患者42例,男性27例,女性15例,平均年龄(64.28±11.46)岁,诊断标准依据2015年发布的指南[3]和Hoehn-Yahr评分进行分级[4],并运用MOCA检测患者的认知功能[5]、ADL评估患者日常生活能力[6],最后结合PD轻度认知障碍(PD-MCI)诊断标准[7]及PD痴呆(PDD)诊断标准[8],将患者分为:无认知障碍(PD-NCI)组,MOCA评分>26分;PD-MCI组,MOCA评分21~26分;PDD组,MOCA评分<21分。健康对照组(NC组)33例,年龄和性别匹配,男性19例,女性14例,年龄(60.47±12.51)岁,神经内科体格检查及头部MRI检查均未见异常,MOCA评分>26分。
1.218F-FDG PETCT检查受检者按体质量静脉注射5.55 MBq/kg的18F-FDG后行PETCT显像,脑代谢检查PET显像采用荷兰飞利浦Vereos PETCT仪。18F-FDG由回旋加速器和化学合成系统自动合成,放化纯度>95%。PETCT扫描使用PHILIPS ingenuity TF PETCT扫描仪。检查前患者禁食4~6 h。常规检查血糖浓度,血糖浓度<11.0 mmol/L。静脉注射示踪剂后1 h进行采集,采集时间为25~30 min,图像采集方式为三维模式,先采集CT图像,后采集PET图像,经计算机重建全身横断,冠状及矢状断层图像。
1.3 图像处理PETCT图像采用飞利浦Syntegra软件三维行处理3D最大似然算法重建,并用CT数据对PET数据进行非均匀衰减校正。然后利用软件绘制工具测量大脑皮质SUVavg(Br),升主动脉根部SUVavg(Bl)分别作为衡量大脑皮质和血液本底代谢活度,大脑血液供应丰富,其SUV主要受血液本底活度的影响,因此参考刘国兵等[9]的研究方法进行感兴趣区SUV值进行校正,SUVavg(Br/Bl)=SUVavg(Br)/SUVavg(Bl)。
1.4 统计学处理采用SPSS 19.0软件处理数据,两组间计量数据比较采用t检验。多组间计量资料比较采用单因素方差分析,计量资料方差不齐,则采用秩和检验。计数资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组受检者临床基本资料的比较PDD组患者病程、Hoehn-Yahr分期、统一帕金森病评分量表(UPDRS)运动检查部分评分均大于PD-MCI和PD-NCI组(P<0.05)。认知功能方面,PDD组、PD-MCI组、PD-NCI组的MOCA评分逐渐升高,差异有统计学意义(F=7.38,P<0.05)。日常生活能力方面,PDD组、PD-MCI、PD-NCI组及健康对照组的ADL评分逐渐降低,各组间差异有统计学意义(F=9.15,P<0.05)。结果见表1。
2.2 PD各组的MOCA和ADL分项检查结果的比较MOCA评分方面,PDD组较PD-MCI、PD-NCI组及健康对照组在视空间与执行、注意、语言、延迟回忆、定向认知域、命名、抽象7个认知域评分均降低(F=10.64~13.73,P均<0.05);PD-MCI组较PD-NCI组比较,仅表现在视空间的认知领域评分下降(t=-2.961,P<0.05);而PD-NCI组与健康对照组在MOCA的各认知域评分均无统计学差异(P>0.05),结果见图1A。ADL评分方面,PDD组较PD-MCI、PD-NCI组及健康对照组在躯体生活自理能力和工具性日常生活能力方面评分均增高(F=7.24、9.22,P均<0.05);PD-MCI组和PD-NCI组比较,ADL两方面的评分PD-MCI组仍高于PD-NCI组(t=3.02、3.60,P均<0.05),而PD-NCI组与健康对照组比较,PD-NCI组工具性日常生活能力评分高于健康对照组(t=3.37,P<0.05),结果见图1B。

表1 各组间临床基本资料的比较

图1 各组的MOCA和ADL分项评分比较
2.3 PDD与PD-MCI及PD-NCI组与对照组18F-FDG脑代谢的比较PDD、PD-MCI、PD-NCI组及健康对照组的校正后SUVavg(Br/Bl)值分别为(2.39±0.73)、(3.83±0.97)、(5.44±1.95)、(5.38±2.37),见图2。与健康对照组相比,PDD组额叶、顶叶、枕叶、颞叶广泛性的皮质区18F-FDG代谢减低(t=-9.53~6.06,P均<0.05);PD-MCI组表现为额叶、颞叶等前皮质区为主的18F-FDG代谢下降(t=-6.63、-4.85,P均<0.05);PD-NCI组与健康对照组相比,两者间脑18F-FDG代谢未见明显差异(P>0.05)。与PD-MCI组相比,PDD组后皮质区顶叶和枕叶代谢低于PD-MCI组(t=-9.32、-7.03,P均<0.05),而额叶、颞叶及小脑代谢相仿(P>0.05);与PD-NCI组相比,PD-MCI组主要为额叶、颞叶代谢减低(t=-7.07、-2.99,P均<0.05),而顶叶及枕叶小脑部分代谢相仿(P>0.05),见图3。
2.4 PD组间脑代谢与MOCA及ADL评分的相关性PDD组顶叶、枕叶后皮质区的18F-FDG代谢减低与MOCA评分中的视空间能力下降呈正相关性(r=0.642、0.580,P<0.05),而PD-MCI、PD-NCI组PD患者脑代谢与MOCA评分无相关性(P>0.05);各组PD患者脑代谢与ADL评分无相关性(P>0.05)。

图2 各组不同脑皮质区域代谢值SUVavg(Br/Bl)比较
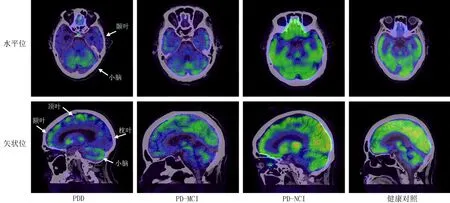
注:绿色区域表示该区存在18F-FDG脑代谢,代谢越高,绿色区域越深;蓝色区域表示该区18F-FDG脑代谢减低图3 各组间水平位及矢状位脑代谢比较
3 讨论
黑质多巴胺神经元的缺失是PD最主要的病理改变,随着PD研究的深入,其CI作为非运动性症状之一逐渐得到密切关注[10-11],越来越多的研究发现,尽管PDD患者新皮质(额叶、颞叶、顶叶、枕叶)多巴胺能神经元密度较PD-NCI患者减少得更加明显[12],但通常认为,PDD的病理生理学机制仍是非多巴胺能神经元功能异常,如胆碱能神经元和Meynert核神经元的缺失,与PDD严重程度显著相关[13],该结论也与本研究结果相吻合,PDD组额叶、顶叶、枕叶、颞叶广泛皮质区18F-FDG代谢下降,而认知损伤程度相对较轻的PD-MCI组则以额叶、颞叶等前皮质区为主的脑皮质葡萄糖代谢下降。在本研究中,相比于健康对照组,PDD组和PD-MCI组在额叶和颞叶有相仿的葡萄糖代谢下降区,这可能与PDD、PD-MCI有共同的病理基础有关,既往研究[14]发现,PD患者α突触核蛋白沉积引起上述多种神经元凋亡改变是存在一定的顺序进展的,从脑桥、脑干经过边缘系统,最后侵及大脑新皮质区,这些阶段性的进程可能是PD伴随着不同程度认知功能下降出现的主要机制。
一项长达10年的随访研究显示,平均31个月后21.7%的PD-NCI患者发展为PD-MCI且伴随着延迟回忆力、注意力、视空间与执行功能的下降,42.3%的PD-MCI患者发展为PDD且伴随着视空间与执行功能、注意力认知功能的进一步恶化[15]。在本研究中,PDD患者后皮质区的顶叶、枕叶18F-FDG代谢下降与MOCA中的视空间与执行功能评分降低呈正相关性。MOCA视空间与执行能力由空间转换相关的功能路径组成,包括联系基底节区、前额皮质区、顶叶皮质区及其它相关辅助运动区多种神经元,所以PDD在发生发展的过程中上述区域广泛的多巴胺能、乙酰胆碱能、Meynert等神经元程序性的死亡是其MOCA视空间与执行功能改变的主要原因[16-17]。因此,PD患者认知功能的进行性下降甚至痴呆均与PD导致的相关神经系统退行性变有关[18]。
由于PD各项认知领域的损害呈进行性恶化,最终发展为PDD,虽然PDD晚期可出现与阿尔茨海默病(AD)相类似的病理改变,如神经炎性斑和神经原纤维缠结等,但是PDD在临床表现和发病机制方面均与AD的痴呆存在明显差异[19],因此在临床的诊疗过程中容易被忽视。患者通常不主动向神经内科医师诉说其认知领域损害相对应的病史,且常见的临床检查亦不善于发现PD患者认知功能的损害,因此,应用更为灵敏的检测工具如PETCT脑葡萄糖功能显像对于指导临床具有重要的意义。
