复方浙贝颗粒联合顺铂对急性淋巴细胞白血病耐药细胞株移植瘤细胞耐药相关酶表达的影响
2019-12-12吕鹏赵欢石凤芹陈信义侯丽
吕鹏 赵欢 石凤芹 陈信义 侯丽
摘要:目的 觀察复方浙贝颗粒联合顺铂(CDDP)对急性淋巴细胞白血病耐药细胞株(L1210/CDDP)移植瘤细胞耐药相关酶表达的影响,探讨其抗急性淋巴细胞白血病的作用机制。方法 将急性淋巴细胞白血病多药耐药细胞株L1210/CDDP细胞接种于DBA/2小鼠腋前皮下构建多药耐药移植瘤模型,成模后按随机数字表法将移植瘤小鼠分为模型组、CDDP组、高剂量复方浙贝颗粒联合CDDP组、中剂量复方浙贝颗粒联合CDDP组、低剂量复方浙贝颗粒联合CDDP组、中剂量复方浙贝颗粒组,分组当日开始给药,隔日1次,共14 d;实验结束后处死小鼠,剥离肿瘤,将瘤块组织制成切片,免疫组化检测L1210/CDDP移植瘤细胞耐药相关酶谷胱甘肽S转移酶(GST)、拓扑异构酶Ⅱ(TopⅡ)的表达。结果 与模型组和CDDP组比较,各剂量复方浙贝颗粒联合CDDP组均能提高L1210/CDDP移植瘤的抑制率(P<0.05);各组生存期比较,高剂量复方浙贝颗粒联合CDDP组最优,平均53.7 d(P<0.05),最长74 d;与模型组比较,CDDP组和中、高剂量复方浙贝颗粒联合CDDP组GST表达均明显降低(P<0.05),CDDP组、中剂量复方浙贝颗粒组和各剂量复方浙贝颗粒联合CDDP组TopⅡ表达均明显升高(P<0.05);与CDDP组比较,中、高剂量复方浙贝颗粒联合CDDP组GST表达明显降低(P<0.05,P<0.01),复方浙贝颗粒高剂量联合CDDP组TopⅡ表达明显升高(P<0.05)。结论 复方浙贝颗粒联合顺铂能提高L1210/CDDP移植瘤的肿瘤抑制率,其机制可能是通过调节肿瘤多药耐药相关酶GST/TopⅡ通路逆转多药耐药性,从而增加肿瘤细胞对药物的敏感性。
关键词:复方浙贝颗粒;急性淋巴细胞白血病;细胞增殖;多药耐药;小鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)11-0052-05
Abstract: Objective To explore the anti-tumor effects of Compound Zhebei Granules combined with cisplatin (CDDP) on mice with acute lymphoblastic leukemia cell line (L1210/CDDP), and the expression of drug-resistant enzymes; To explore its mechanism of action against acute lymphoblastic leukemia. Methods Multidrug- resistant transplanted tumor model was established by inoculating acute lymphoblastic leukemia multidrug-resistant cell line L1210 CDDP subcutaneously in DBA/2 mice. The transplanted tumor mice were divided into model group, CDDP group, Compound Zhebei Granules high-dose combined with CDDP group, medium-dose combined with CDDP group, low-dose combined with CDDP group, and medium-dose Compound Zhebei Granules groups according to random number table method. Each group was given medication since the group were divided, every other day, for 14 d. The mice were sacrificed after the experiment, and the tumors were dissected into sections. The expression of drug resistance-related enzymes GST and TopⅡ in transplanted L1210 CDDP cell line was detected by immunohistochemistry. Results Compared with model group and CDDP group, Compound Zhebei Granulescombined with CDDP groups could increase the inhibition rate of transplanted L1210 CDDP cell line (P<0.05). The survival time of Compound Zhebei Granules high-dose combined with CDDP group was the best (P<0.05), with an average of 53.7 days and a maximum of 74 days. Compared with model group, GST of CDDP group and Compound Zhebei Granules high-dose combined with CDDP group, medium-dose combined with CDDP group decreased significantly (P<0.05); TopⅡ in CDDP group and medium-dose Compound Zhebei Granules and other Compound Zhebei Granules combined with CDDP groups increased significantly (P<0.05). Compared with CDDP group, the expression of GST in Compound Zhebei Granules high-dose and medium-dose group combined with CDDP group decreased significantly (P<0.05, P<0.01), the expression of TopⅡ in Compound Zhebei Granules high-dose combined with CDDP group increased significantly (P<0.05). Conclusion Compound Zhebei Granules combined with CDDP can improve the tumor inhibition rate of transplanted acute lymphoblastic leukemia drug-resistant cell lines. Its mechanism is to reverse multidrug resistance by regulating the GST/TopⅡ pathway of multidrug resistance-related enzymes, thereby increasing the sensitivity of cancer cells to drugs.
Keywords: Compound Zhebei Granules; acute lymphoblastic leukemia; cell proliferation; multidrug resistance; mice
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是造血系统常见的恶性肿瘤,以克隆性增殖异常分化的恶性细胞浸润骨髓、血液及其他组织为特点,化疗、造血干细胞移植及生物靶向治疗是其主要手段,白血病细胞对化疗药物耐药是ALL复发和难治的重要因素[1-2]。有研究表明,拓扑异构酶Ⅱ(topoisomerase Ⅱ,TopⅡ)表达降低导致的多药耐药是ALL独立的预后判断及耐药因素之一[3-4]。谷胱甘肽S转移酶(glutathione S-transferase,GST)可通过增加药物外排、直接参与细胞凋亡途径等多途径导致多药耐药,且TopⅡ与GST表达多呈负相关,抑制GST的活性及表达能逆转肿瘤细胞的耐药[5-7]。中医药在逆转白血病细胞多药耐药方面具有独到优势。复方浙贝颗粒是北京中医药大学东直门医院血液肿瘤科遵循难治性急性白血病“痰瘀互阻”的基本病机而研制的复方制剂,处方由浙贝母、川芎、汉防己(1∶1∶1)组成。前期研究显示,复方浙贝颗粒(Compound Zhebei Granule,CZBG)能通过多靶点多途径逆转急性髓系白血病细胞株动物模型小鼠对化疗药物的多药耐药性[8-11]。为进一步阐明该复方在难治性ALL中的效应机制,本研究以ALL多药耐药细胞株L1210/CDDP为靶细胞,建立小鼠移植瘤模型,在观察肿瘤抑制率基础上,从耐药相关酶表达差异探究CZBG抗ALL作用及逆转其多药耐药机制。
1 實验材料
1.1 动物
SPF级DBA/2小鼠150只,4周龄,雌雄各半,购于北京维通利华实验动物公司,动物许可证号SYXK(京)2016-0006。饲养于中国中医科学院中药研究所SPF级动物实验室,温度(24±2)℃,相对湿度(50±10)%,12 h/12 h明暗交替,自由摄食饮水。空气洁净度100级,氨浓度≤14 mg/m3,噪声≤60 dB,工作照度150~300 LX,动物照度100~200 LX。
1.2 细胞株
L1210/CDDP细胞株,购于上海美轩生物科技有限公司。
1.3 药物及制备
CZBG浸膏粉,6.579 g原药材/g,北京康仁堂药业有限公司提供;用纯净水配制CZBG浸膏粉,高剂量CZBG为61.56 mg/mL(相当于临床剂量18倍);中剂量CZBG为35.78 mg/mL(相当于临床剂量9倍);低剂量CZBG为17.89 mg/mL(相当于临床剂量4.5倍)。受试药物于实验当日配制,现用现配。注射用顺铂(CDDP)10 mg/支,齐鲁制药有限公司,批号20170802。
1.4 主要试剂与仪器
RPMI-1640培养基、青链霉素,美国Hyclone公司;胎牛血清(FBS),Gibco公司;细胞培养箱(240i),Thermo公司;显微镜(ckx53),日本Olympus公司;移液枪,美国Eppendorf公司;负压超净工作台(FCH-1300B),北京亚太科隆公司;电子天平(BSA3202S-CW),美国梅特勒-托利多公司。Anti-GST3/GST pi抗体[EPR8263](ab138491),Anti-Topoisomerase Ⅱ alpha抗体[EP1102Y](ab52934)。切片机(德国Leica公司,型号RM2016/1404014),烤片机(天津天利航空机电有限公司,型号KPJ-1A/11030574),摊片机(浙江省金华市科迪仪器设备有限公司,型号KD-P/51230),显微镜(NATIONAL,型号B2-220),高压锅、电磁炉、冰箱、隔水式恒温箱。
2 实验方法
2.1 造模
L1210/CDDP细胞用含0.2 μg/mL CDDP、10%FBS、1%双抗RPMI1640完全培养基培养,维持耐药。接种前2周置于不含CDDP完全培养基37 ℃、5%CO2饱和湿度培养箱内培养,2~3 d换液1次。
收集对数生长期细胞,1000 r/min离心5 min,无血清RPMI1640培养液稀成浓度为1×107个/mL的细胞悬液。于小鼠右前腋侧皮下注射1×106个细胞。
2.2 分组和给药
小鼠接种L1210/CDDP 6 d后,成瘤小鼠测量肿瘤最大径(a)和最小径(b),按公式V=ab2÷2计算肿瘤体积,剔除肿瘤体积过大及过小小鼠38只,余下96只小鼠肿瘤体积平均约220~230 mm3,按随机数字表法分为模型组、CDDP组、高剂量CZBG联合CDDP组、中剂量CZBG联合CDDP组、低剂量CZBG联合CDDP组、中剂量CZBG组,每组16只。分组当日开始给药,其中模型组小鼠给予生理盐水腹腔注射+纯净水灌胃1次/d(0.2 mL/10 g);CDDP组小鼠给予纯净水灌胃1次/d(0.2 mL/10 g)+CDDP 1 mg/kg腹腔注射[按临床化疗方案100 mg/(m2·d)成人用量换算(下同)],隔日1次;高剂量CZBG联合CDDP组小鼠给予CZBG灌胃10 g/(kg·d)+CDDP 1 mg/kg腹腔注射,隔日1次;中剂量CZBG联合CDDP组小鼠给予CZBG灌胃5 g/(kg·d)+CDDP 1 mg/kg腹腔注射,隔日1次;低剂量CZBG联合CDDP组给予CZBG灌胃2.5 g/(kg·d)+CDDP 1 mg/kg腹腔注射,隔日1次;中剂量CZBG组小鼠给予CZBG灌胃5 g/(kg·d),共干预14 d。通过人和动物间体表面积等效剂量比进行药量换算。
2.3 瘤重及抑瘤率测定
末次给药后12 h,脱颈处死每组10只小鼠(雌雄各半),称重后完整剥离小鼠移植瘤组织,测量小鼠瘤块体积并称重,根据瘤质量计算各实验组抑瘤率。抑瘤率(%)=(1-试验组瘤质量÷对照组瘤质量)×100%。
2.4 生存期测定
末次给药后12 h,脱颈处死每组10只小鼠(雌雄各半),各组余下6只小鼠(雌雄各半)用于观察生存期。
2.5 多药耐药相关酶免疫组化检测
将各实验组小鼠肿瘤组织进行石蜡包埋,切片,脱蜡脱水后,采用免疫组化SP二步法(实验操作步骤严格按试剂盒说明书进行)检测TopⅡ、GST。抗原热修复3 min,切片浸入0.01 mol/L PBS洗涤3次×2 min,滴加3%H2O2,10~15 min,0.01 mol/L PBS洗涤3次×2 min,滴加一抗(GST、TopⅡ抗体,l∶100稀释),37 ℃湿盒孵育90 min,0.01 mol/L PBS洗涤3次×2 min,滴加二抗(生物素标记辣根过氧化物酶标记抗鼠IgG抗体),37 ℃湿盒孵育90 min,0.01 mol/L PBS洗涤3次×2 min,DBA显色剂显色15 min,自来水冲洗,苏木精复染,中性树胶封固,用PBS代替一抗作阴性对照。TopⅡ及GST染色阳性物质主要定位于细胞浆及细胞核,呈棕黄色颗粒为阳性细胞,应用Image ProlPus 6.0免疫组化彩色图像分析系统对免疫组化染色结果进行定量分析,以对照组阳性点为基础,对视野统一测定参数,分析实验各组图片阳性点积分光密度与细胞分布区域面积之比(IOD/Area),反映免疫组化图片中目标蛋白平均表达量。
3 统计学方法
采用SPSS22.0和Grapad Prism 7.0統计软件进行分析。计量资料以±s表示,组间比较用t检验。P<0.05表示差异有统计学意义。
4 结果
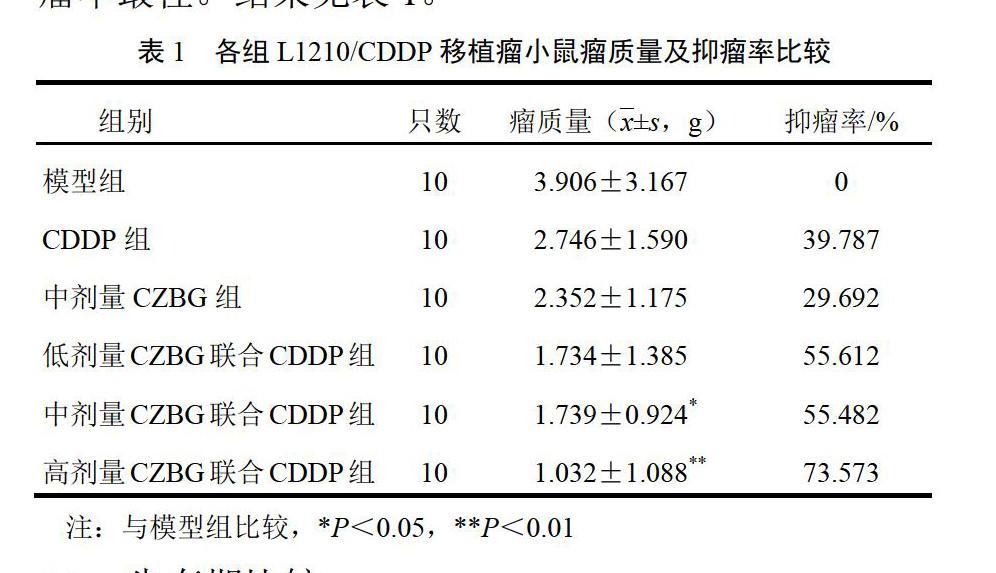
4.1 瘤质量和抑瘤率比较
与模型组比较,中剂量CZBG联合CDDP组、高剂量CZBG联合CDDP组小鼠瘤质量明显降低(P<0.05,P<0.01);CDDP组、中剂量CZBG组、低剂量CZBG联合CDDP组小鼠瘤质量较模型组无明显变化(P>0.05)。高剂量CZBG联合CDDP组小鼠抑瘤率最佳。结果见表1。
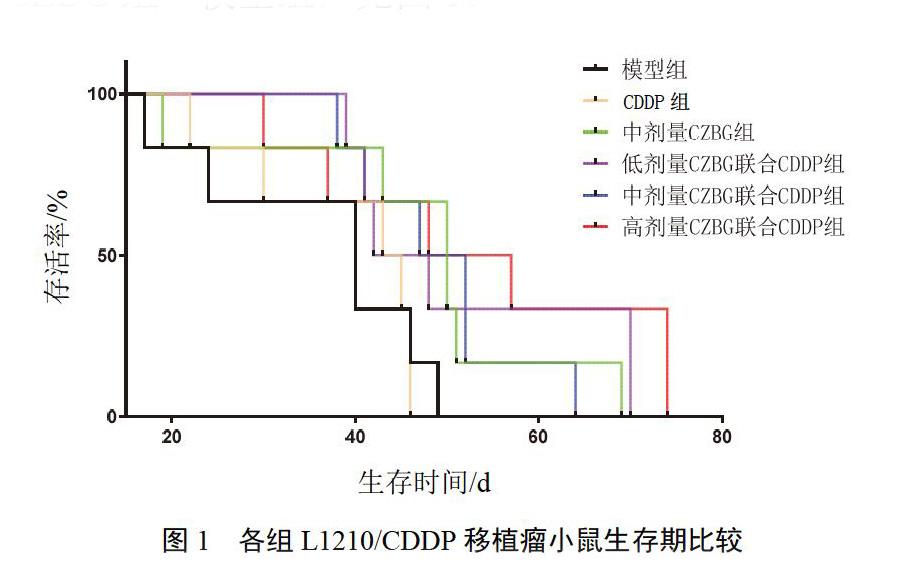
4.2 生存期比较
与模型组比较,高剂量CZBG联合CDDP组生存期差异有统计学意义(P<0.05),其余各组差异均无统计学意义(P>0.05);各组生存期比较:高剂量CZBG联合CDDP组>低剂量CZBG联合CDDP组>中剂量CZBG联合CDDP组>CDDP组>中剂量CZBG组>模型组,见图1。
4.3 复方浙贝颗粒联合顺铂对移植瘤细胞凋亡蛋白表达的影响
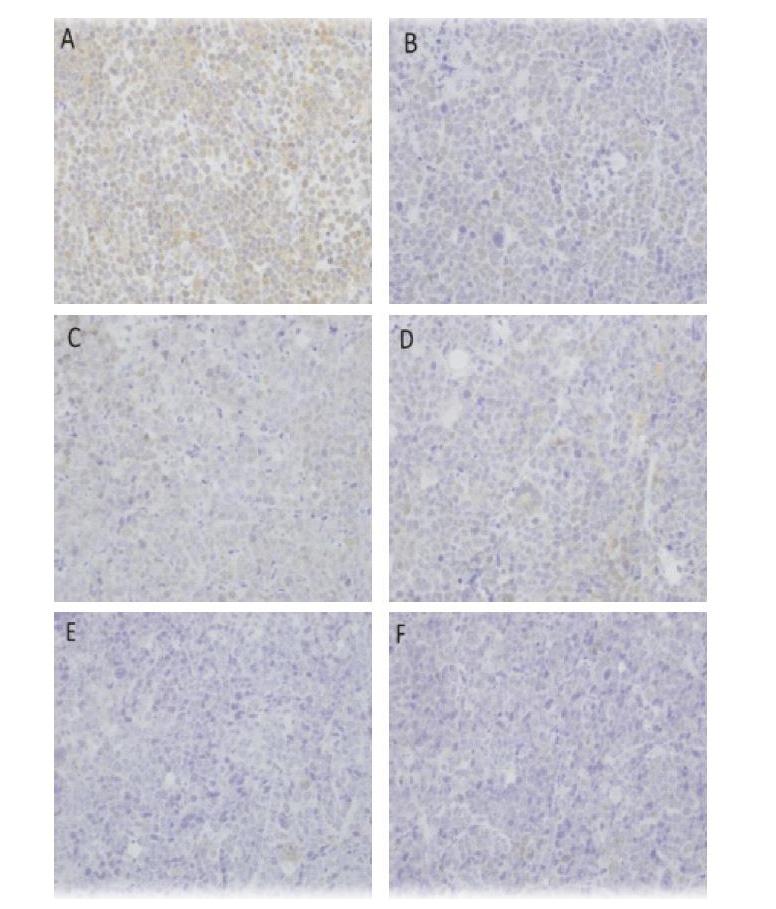
免疫组化标记的GST、TopⅡ呈棕黄色,主要存在于细胞浆及细胞核中。镜下显示,模型组可见较多GST表达细胞,CDDP组、中剂量CZBG组及各剂量CZBG联合CDDP组GST表达细胞减少,见图2;TopⅡ表达细胞在模型组中较少,中剂量CZBG组、CDDP组及各剂量CZBG联合CDDP组TopⅡ表达细胞增多,见图3。与模型组比较,CDDP组及中、高剂量CZBG联合CDDP组GST表达明显降低(P<0.05),CDDP组、中剂量CZBG组及各剂量CZBG联合CDDP组TopⅡ表达明显升高(P<0.05);与CDDP组比较,高剂量CZBG联合CDDP组TopⅡ表达明显升高(P<0.05),中、高剂量CZBG联合CDDP组GST表达明显降低(P<0.05,P<0.01),见表2。
5 讨论
恶性肿瘤多药耐药迄今研究多集中在多药耐药基因(MDR1)及其编码的糖蛋白(P-gp)、多药耐药相关蛋白(MRP1-6)方向。越来越多研究表明,多药耐药相关酶如GST、TopⅡ的表达异常在恶性肿瘤,特别是复发及难治性白血病细胞中具有重要作用[12-15]。研究表明,TopⅡ在复发的急性白血病中明显降低,TopⅡ介导的多药耐药常表现为耐药细胞酶转录水平和活性降低,同时伴有细胞内药物浓度下降,TopⅡ表达降低是ALL独立的预后判断及耐药因素之一[3-4]。TopⅡ与GST在恶性肿瘤中呈负相关;此外,GST可通过增加药物外排、直接参与细胞凋亡途径导致耐药及HNE等多途径导致多药耐药,抑制GST的活性及表达可逆转肿瘤细胞的耐药[5-7]。
中医药在逆转白血病细胞多药耐药方面具有独特优势[16],难治性急性白血病久治不愈,类似中医“顽痰”特征,淋巴结肿大符合中医学“痰核”“瘰疬”特点,皮肤瘀点、瘀斑等符合中医“血瘀”表现。司富春等[17]基于文献的证候要素分析显示,痰瘀互阻是白血病的主要病机。根据中医辨证论治原则,基于急性白血病痰瘀互阻的证候特点配伍的CZBG具有化痰散结、活血化瘀功效,方中浙贝母化痰散结,川芎行气活血化瘀,汉防己利湿消肿以截生痰之源,合用以消难治性AIL“顽痰”,行气活血以散“血瘀”。基础研究显示,CZBG可通过多靶点多途径逆转急性髓系白血病细胞株动物模型小鼠对化疗药物的多药耐药性[8-11]。
本研究结果显示,与模型组和CDDP组比较,各剂量CZBG联合CDDP组均能提高ALL耐药细胞株L1210/CDDP移植瘤的抑瘤率(P<0.05);各组生存期比较,高剂量CZBG联合CDDP组>低剂量CZBG联合CDDP组>中剂量CZBG联合CDDP组>CDDP组>中剂量CZBG组>模型组。其中,高剂量CZBG联合CDDP组能明显延长移植瘤小鼠生存期(P<0.05)。与模型组比较,CDDP组和中、高剂量CZBG联合CDDP组GST表达均有不同程度降低(P<0.05);与CDDP组比较,中、高剂量CZBG联合CDDP组GST表达也明显降低(P<0.01)。与模型组比较,CDDP组、中剂量CZBG组及各剂量CZBG联合CDDP组TopⅡ均有不同程度升高(P<0.05);与CDDP组比较,高剂量CZBG联合CDDP组TopⅡ表达明显升高(P<0.05)。与CDDP组比较,CZBG联合CDDP能提高ALL耐药细胞株移植瘤肿瘤抑制率,其机制为通过调节多药耐药相关酶GST/TopⅡ通路来逆转ALL细胞的多药耐药,从而增加白血病细胞对药物的敏感性。
急性白血病分为急性髓系白血病和ALL。结合前期基础研究基于急性髓系白血病多药耐药细胞株探索CZBG的抗白血病作用及逆转其多药耐药机制[8-11],本研究基于ALL多药耐药细胞株探索CZBG抗白血病作用及其机制,进一步丰富了临床验方CZBG在复发及难治性急性白血病中的作用探讨及机制研究。
参考文献:
[1] WIEDUWILT M J. How should we treat older adults with Ph+ adult ALL and what novel approaches are being investigated[J]. Best Pract Res Clin Haematol,2017,30(3):201-211.
[2] SHORT N J,KANTARJIAN H,JABBOUR E, et al. Which tyrosine kinase inhibitor should we use to treat Philadelphia chromosome-positive acute lymphoblastic leukemia[J]. Best Pract Res Clin Haematol, 2017,30(3):193-200.
[3] BECK J, HANDGRETINGER R, KLINGEBIEL T, et al. Expression of PKC isozyme and MDR-associated genes in primary and relapsed state AML[J]. Leukemia,1996,10(3):426-433.
[4] BECK J, HANDGRETINGER R, DOPFER R, et al. Expression of mdrl, MRP, topoisomerase Ⅱα/β and cyclinA in primary or relapsed states of acute lymphoblastic leukemias[J]. Br J Haematol,1995, 89(2):356-363.
[5] SINGH S. Cytoprotective and regulatory functions of glutathione S transferases in cancer cell proliferation and cell death[J]. Cancer Chemotherapy & Pharmacology,2015,75(1):1-15.
[6] ZHANG H, FORMAN H J. 4-hydroxynonenal-mediated signaling and aging[J]. Free Radical Biology & Medicine,2017,111:219-225.
[7] MOHANA K, ACHARY A. Human cytosolic glutathione-S-transferases:Quantitative analysis of expression, comparative analysis of structures and inhibition strategies of isozymes involved in drug resistance[J]. Drug Metabolism Reviews,2017,49(3):318-337.
[8] WANG J, LAI Z L, CHEN X Y, et al. Effect of compound Zhe Bei Granule (CZBG) combined with chemotherapy on surface markers of leukemia stem cell in patients with acute myeloid leukemia[J]. Chinese Journal of Integrative Medicine,2016,22(6):438-444.
[9] 鄭智,侯丽,许亚梅,等.复方浙贝颗粒联合阿霉素影响K562/A02移植瘤细胞耐药相关酶表达研究[J].医学研究杂志,2009,38(12):29-31.
[10] 郑智,李冬云,陈信义.复方浙贝药物血清影响K562/A02细胞积聚外排功能和细胞凋亡研究[J].中国中西医结合杂志,2010,30(2):167- 169.
[11] 郑智,陈菊,李冬云,等.复方浙贝颗粒联合阿霉素对K562/A02移植瘤mdr-1基因表达的影响[J].中西医结合学报,2009,7(8):758-762.
[12] 向丽.P-gp、MRP1、LRP、Topo-Ⅱ和GST-π在常见儿童实体肿瘤的表达及临床意义研究[D].重庆:重庆医科大学,2006.
[13] 李斯文,王珊,杨超,等.药物相关性分子靶标检测在儿童恶性实体肿瘤个体化治疗中的初步研究[J].临床小儿外科杂志,2017,16(4):35-40.
[14] EBEED S A, SADEK N A, ZAHER E R, et al. Role of MRP-1 and GST-Pi in MDR and their inhibition by indomethacin in AML[J]. Alexandria Journal of Medicine,2016,53(3):251-259.
[15] 张海英,张京,吴涛,等.谷胱甘肽S-转移酶基因多态性与儿童急性淋巴细胞白血病遗传易感性的meta分析[J].中国实验血液学杂志,2017, 25(1):16-23.
[16] 吕鹏,张雅月,李蕊白,等.中医药在急性髓系白血病(非M3)围诱导化疗期的应用与研究进展[J].北京中医药,2017,36(10):955-959.
[17] 司富春,王振旭.白血病中医证型与方药分析[J].中华中医药杂志, 2013,28(7):1971-1976.
(收稿日期:2019-05-29)
(修回日期:2019-06-17;编辑:华强)
