干扰素α-2b椎旁神经阻滞治疗肿瘤脊柱转移神经痛的疗效观察
2019-12-12薛朝霞
李 珊 薛朝霞
(1 山西医科大学麻醉学系,太原市 030001,电子邮箱:1539245114@qq.com; 2 山西医科大学第一医院疼痛科,太原市 030001)
肿瘤严重威胁人类生命健康,发展到晚期常引起难以忍受的疼痛,严重影响患者的生活质量。脊柱是全身恶性肿瘤骨转移最常见的部位,肿瘤脊柱转移患者可伴有剧烈疼痛、神经功能受损,或者二者兼有[1]。一旦肿瘤发生骨转移,则无法治愈,其治疗方式主要是姑息治疗,以减轻疼痛、防止病理性骨折并提高肢体的活动能力和功能为主[2]。椎旁神经阻滞是将局麻药物注射在椎间孔外口,阻滞附近的脊神经根,从而阻滞该侧的运动、感觉和交感神经的一种方法[3],主要用于慢性疼痛治疗、胸部手术麻醉及术后镇痛。研究发现干扰素除了抗病毒、抗肿瘤作用外,还具有镇痛效果[4],且有研究证实蛛网膜下腔注射干扰素安全可靠[5]。本研究探讨干扰素α-2b用于椎旁神经阻滞对肿瘤脊柱转移癌痛患者的临床疗效,现报告如下。
1 资料与方法
1.1 临床资料 选取2017年1月至2018年3月在山西医科大学第一医院进行治疗的60例肿瘤脊柱转移癌痛患者为研究对象。纳入标准:(1)经磁共振等影像学检查确诊为脊柱转移性肿瘤且伴有脊柱相关症状;(2)疼痛视觉模拟评分法(Visual Analogue Scale,VAS)评分>7分[6],口服止痛药物效果差或不耐受;(3)拟穿刺部位皮肤无感染;(4)预估生存时间>3个月。排除标准:(1)合并严重心、肝、肾等功能衰竭者;(2)对干扰素α-2b 及注射用甲泼尼龙琥珀酸钠过敏者;(3)凝血功能严重障碍者;(4)神志异常,语言交流障碍的患者。采用随机数字表法将患者分为干扰素组和对照组,每组30例。两组患者的年龄、性别、累及椎体个数以及原发病等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。所有患者均对本研究知情,并签署知情同意书。

表1 两组患者的临床资料比较
1.2 治疗方法 两组患者均给予椎旁神经阻滞治疗,均经同一术者在B超引导下进行穿刺操作。具体给药方法如下:对照组患者给予2%利多卡因(山东华鲁制药有限公司,批号:C1811085)100 mg、腺苷钴胺注射液(重庆药友制药有限责任公司,批号:H20066850)1.5 mg、注射用甲泼尼龙琥珀酸钠(重庆华邦制药有限公司,批号:H20143136)40 mg混合后,加0.9%生理盐水稀释按椎旁每节段5 mL配置;干扰素组患者在对照组的基础上加用重组人干扰素α-2b[安徽安科生物工程(集团)股份有限公司,批号:S20000013]300万U。注射总量不超过20 mL,阻滞治疗间隔1天,3次为一个疗程。
1.3 观察指标
1.3.1 VAS评分及疼痛缓解情况:分别于治疗前及治疗后1周、2周、4周采用VAS评分[7]评价患者疼痛程度,用0~10的数字代表不同程度的疼痛,0为无痛,10为剧痛。治疗4周后VAS评分较治疗前降低≥75%为缓解;降低50%~75%,为部分缓解;降低<50%,为未缓解。总缓解率=(缓解+部分缓解)例数/总例数×100%。
1.3.2 匹兹堡睡眠质量指数问卷:分别于治疗前及治疗后1周、2周、4周使用匹兹堡睡眠质量指数(Pittsburgh Sleep Quality Index,PSQI)问卷评分[8]评价患者睡眠质量,内容包括睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物和日间功能7项指标,每项指标按0~3分进行评分,各项指标评分的累积分数为PSQI总分,得分越高表示睡眠越差。
1.3.3 不良反应发生情况:记录患者治疗期间的不良反应发生情况,包括恶心、呕吐、嗜睡、便秘、尿潴留等。
1.4 统计学分析 本研究采用SPSS 22.0进行统计分析。计量资料用(x±s)表示,两两比较采用t检验,重复测量的计量资料采用重复测量方差分析,计数资料以例数或百分比表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后VAS评分及疼痛缓解情况的比较 两组的VAS评分比较,差异有统计学意义(F组间=14.256,P组间<0.001),其中在治疗后1周、2周、4周干扰素组的VAS评分均低于对照组(均P<0.05);两组的VAS评分均有随时间变化的趋势(F时间=267.757,P时间<0.001);分组与时间存在交互作用(F交互=5.017,P交互=0.008)。见表2。治疗4周后,干扰素组缓解18例,部分缓解9例,未缓解3例,总缓解率为90.0%;对照组缓解9例,部分缓解8例,未缓解13例,总缓解率为56.7%;干扰素组总缓解率高于对照组(χ2=8.523,P=0.004)。

表2 两组VAS评分的比较(x±s,分)
2.2 两组患者治疗前后PSQI评分比较 两组的PSQI评分比较,差异有统计学意义(F组间=14.187,P时间<0.001),其中在治疗后1周、2周、4周干扰素组的PSQI评分均低于对照组(均P<0.05);两组的PSQI评分均有随时间变化的趋势(F组间=1 111.269,P组间<0.001);分组与时间存在交互作用(F交互=19.113,P交互<0.001)。见表3。
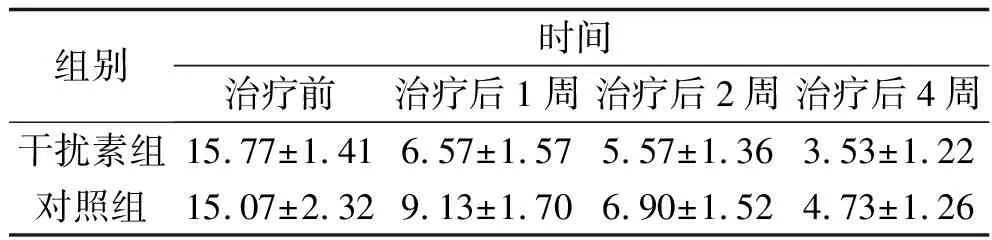
表3 两组PSQI评分的比较(x±s,分)
2.3 两组患者不良反应发生情况比较 对照组治疗期间发生恶心4例,嗜睡2例,便秘6例,尿潴留1例,呕吐1例,不良反应发生率为46.7%(14/30);干扰素组治疗期间发生恶心4例,嗜睡4例,便秘12例,尿潴留3例,呕吐1例,不良反应发生率为80.0%(24/30)。干扰素组不良反应发生率低于对照组(χ2=5.711,P=0.017)。
3 讨 论
脊柱是肿瘤骨转移最常见的部位,据统计恶性肿瘤转移至脊椎的发生率仅次于肺和肝脏,乳腺癌、肺癌和前列腺癌等恶性肿瘤最容易发生脊柱转移[9]。脊柱转移瘤引起的骨痛、病理性骨折、脊髓受压等症状,严重影响肿瘤患者的生存质量。
恶性肿瘤所导致的疼痛又称为癌性神经病理性疼痛,其治疗目前仍是临床工作中的一道难题。对于癌痛患者,提高生存质量是治疗的核心问题,首要任务是减轻疼痛。研究显示,系统应用镇痛药物及进行其他辅助治疗后,约80%的癌痛患者可大幅度缓解疼痛,而约20%的患者对镇痛药物不敏感或不耐受,且容易产生副作用[10]。有专家提出,可以将神经阻滞和神经毁损作为癌痛治疗的一种有效的微创介入手段[11]。对于晚期癌痛患者,尤其是合并全身系统疾病的患者来说,椎旁神经阻滞被认为是一种安全有效的镇痛手段[12]。有学者将椎旁神经阻滞运用到晚期顽固性癌痛患者的治疗中,发现椎旁神经阻滞与吗啡静脉自控镇痛联合应用显著提高了患者的镇痛效果[13]。还有研究发现椎旁神经阻滞对于镇痛药物治疗效果欠佳或者不耐受的难治性癌痛患者具有良好的效果[14]。
干扰素α是一种由免疫细胞、神经胶质细胞及神经元等合成分泌的具有广谱抗病毒、抗肿瘤、免疫调节作用的蛋白质,临床上多用于抗病毒、抗肿瘤治疗,关于其在疼痛性疾病治疗方面的相关报道很少,但近年来越来越多的研究证实了干扰素的镇痛效果。有学者研究发现干扰素α作用于阿片受体发挥镇痛效应[15-16]。Lee等[17]发现干扰素α和β-内啡肽有协同镇痛作用,并可被μ阿片受体拮抗剂阻断。Liu等[4]研究结果显示,用干扰素α灌注脊髓切片显著地降低了伤害性神经元中的自发性突触后电位,并认为干扰素α通过抑制突触前末端谷氨酸的释放来抑制兴奋性突触传递。与吗啡等μ受体激动剂比较,干扰素α对神经病理性疼痛的治疗,不仅是通过激动μ受体起镇痛作用,而且其抗肿瘤和免疫调节作用也有助于癌性神经病理痛的治疗。
靶向给药途径是目前药物研究领域的一大热点,一方面增大靶区部位药物浓度,提高疗效,另一方面减少非靶区组织的药物浓度,减少药物不良反应[18]。干扰素目前以皮下或肌肉注射为主要给药途径,因其属于全身用药,所需剂量大,会相应增加不良反应发生概率。局部用药的优点是简便、快速,较小的剂量即可达到较高的局部浓度,应用介入手段将干扰素α靶向注射到相关神经节附近,所需剂量将大大降低,不良反应发生概率小,安全性得到极大提高;加之背根神经节及脊髓背角是干扰素α受体所在部位,精准注射可极大提高临床疗效。研究显示,将干扰素α-2b用于椎旁阻滞靶向注射至背根神经节周围治疗急性期带状疱疹及神经痛具有良好的疗效[19]。
本研究结果显示,干扰素组患者在治疗后1周、2周、4周的VAS评分、PSQI评分均低于对照组(均P<0.05),总缓解率高于对照组,而不良反应发生率低于对照组(均P<0.05),说明干扰素α-2b椎旁神经阻滞治疗癌性神经病理痛可以提高镇痛效果,且安全性较高。分析其原因可能为干扰素α是一种内源性疼痛抑制因子,通过抑制谷氨酸和P物质的释放从而抑制脊髓中的疼痛传递,鞘内注射干扰素α可起镇痛作用[20]。干扰素α通过阿片受体发挥镇痛效应目前认为存在两种可能机制:一种是干扰素α首先通过与细胞表面的干扰素α特异性受体结合并刺激细胞活化,活化后的免疫细胞可迅速合成并释放大量的内源性阿片肽,后者再通过结合阿片受体发挥镇痛作用;另一种是干扰素α直接与阿片受体结合发挥镇痛作用。这两种受体之间介导干扰素α的镇痛机制的交联性仍有待研究。
综上所述,干扰素α-2b用于椎旁神经阻滞治疗肿瘤脊柱转移神经痛,能有效地减轻患者疼痛,改善患者睡眠质量,且安全性较高。但是本研究样本例数较少,如何更科学、客观地证实干扰素α-2b 用于椎旁神经阻滞对癌痛患者的效果,仍有待进一步研究。
