青年2型糖尿病患者血清25-羟维生素D3水平与糖尿病周围神经病变的关系
2019-12-12文海清雷晓珍郜晓彬
文海清 郭 娟 雷晓珍 张 萍 郜晓彬
(1 青海省西宁市第二人民医院内分泌科,西宁市 810003,电子邮箱:lemon55002@126.com;2 中国人民解放军总医院第一附属医院糖尿病科,北京市 100048)
截至2016年,全球2型糖尿病(type 2 diabetes mellitus,T2DM)患者超过4亿,预计未来20年患病数将再翻一倍[1]。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病患者常见的并发症之一[2],是继发足部感染、溃疡、糖尿病足,最终导致截肢的主要原因。DPN的发病机制较为复杂,至今尚未完全阐明[3],但有研究显示血糖控制不佳是其最大的危险因素,维生素D缺乏与DPN的发生、发展密切相关[4]。在亚洲,糖尿病患者中维生素D缺乏者发生DPN的风险是维生素D水平正常者的1.22倍,因此认为维生素D缺乏是DPN的独立危险因子[5-6]。维生素D是一种脂溶性维生素,25-羟维生素D3[25-(OH)D3]是维生素D在体内的主要活性形式。近年来,维生素D水平作为影响DPN的危险因素已成为研究热点,虽然T2DM的发病人群趋于年轻化,但国内鲜有报道血清25-(OH)D3水平与青年DPN的相关研究,而目前针对DPN的治疗方法有限且不能根治,因此亟须寻找能够预防和延缓DPN发生发展的方法。本研究探讨血清25-(OH)D3水平与青年DPN的相关性,为预防和治疗青年DPN提供参考。
1 资料与方法
1.1 临床资料 采用系统抽样法选取2016年6月~2017年6月于青海省西宁市第二人民医院就诊的178例T2DM患者作为研究对象。纳入标准:(1)年龄24~44岁;(2)均符合1999年世界卫生组织关于T2DM的诊断标准[7];(3)均给予口服降糖药和(或)胰岛素治疗。排除标准:(1)Ⅰ型糖尿病,合并其他内分泌疾病,恶性肿瘤,严重感染,严重的心、肝、肾功能不全者;(2)严重周围神经血管病变者;(3)合并高血压、冠心病的T2DM患者;(4)其他疾病引起的周围神经病变患者,如脑血管疾病、颈椎病、椎管狭窄等;(5)近期服用维生素D、骨化三醇等影响25-(OH) D3水平的药物。神经传导速度检查是诊断DPN的金标准[7],根据该标准,将本研究178例患者中神经传导速度异常的107例患者作为DPN组,其中男性64例、女性43例,年龄(37.62±6.03)岁;将神经传导速度正常的71例患者作为非DPN组,其中男性42例、女性29例,年龄(38.14±5.46)岁。同时选取同期在青海省西宁市第二人民医院体检中心体检的50例健康人群作为对照组,其中男性29例、女性21例,年龄24~44(35.52±7.14)岁。三组研究对象的年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究获得青海省西宁市第二人民医院伦理委员会批准,所有患者均自愿参加本研究。
1.2 方法
1.2.1 收集所有研究对象的一般信息,包括年龄、性别、糖尿病病程。
1.2.2 血清学指标检测:所有研究对象均于抽血前禁食8~12 h,采集早晨空腹肘静脉血5 mL。采用Olympus AU2700型全自动分析仪(日本Olympus公司)测定总胆固醇、三酰甘油、HDL-C、LDL-C,采用Bio-Rad D10全自动糖化血红蛋白仪(美国伯乐Bio-Rad公司)检测糖化血红蛋白(hemoglobin A1c,HbA1c);采用己糖激酶法测定空腹血糖(葡萄糖测定试剂盒购自Shino-Test Corporation公司);采用电化学发光免疫分析法测定血清25-(OH)D3水平,根据2011年美国内分泌学会《维生素D缺乏治疗和预防临床指南》[8]中的相关标准,将血清25-(OH)D3水平划分为三个等级:25-(OH)D3≥30 ng/mL为维生素D3正常;20 ng/mL≤25-(OH)D3<30 ng/mL为维生素 D3不足;25-(OH)D3<20 ng/mL为维生素D3缺乏。其中维生素D3缺乏率=维生素D3缺乏例数/总例数×100%。
1.3 统计学分析 采用SPSS 20.0软件进行统计分析。计数资料以例数(百分比)表示,比较采用χ2检验;计量资料以 (x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用Bonferroni法。相关关系采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 三组病程及血清学指标比较 DPN组与非DPN组病程差异有统计学意义(P<0.05)。与对照组比较,DPN组和非DPN组的HbA1c和空腹血糖均升高,25-(OH)D3均降低(均P<0.05),而三组间的总胆固醇、三酰甘油、HDL-C、LDL-C比较,差异均无统计学意义(均P>0.05)。见表1。
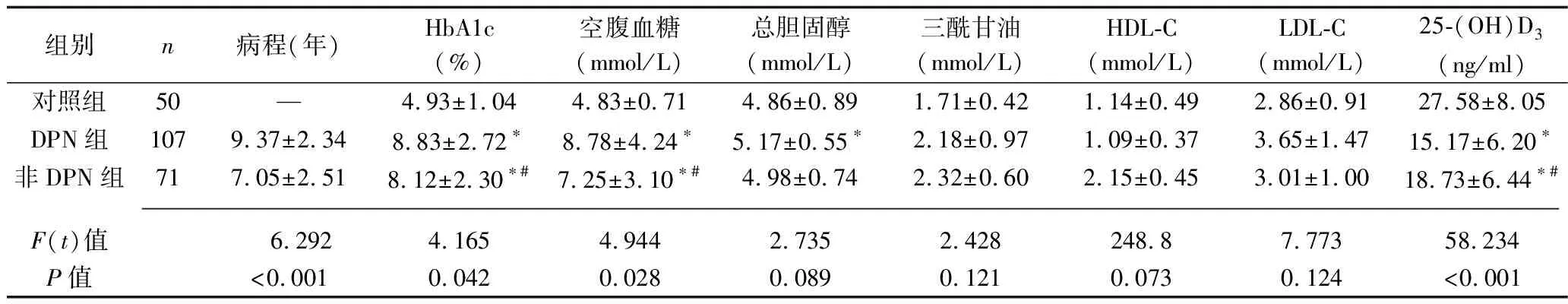
表1 三组病程及生化代谢指标比较(x±s)
注:与对照组比较,*P<0.05;与DPN组比较,#P<0.05。
2.2 三组25-(OH)D3缺乏情况比较 三组25-(OH)D3缺乏情况比较,差异有统计学意义(χ2=89.886,P<0.001),25-(OH)D3缺乏率DPN组>非DPN组>对照组(均P<0.05)。见表2。

表2 三组25-(OH)D3缺乏情况比较[n(%)]
注:与对照组比较,*P<0.05;与非DPN组比较,#P<0.05。
2.3 血清25-(OH)D3与年龄、病程及生化代谢指标的相关性分析 血清25-(OH)D3水平与HDL-C、空腹血糖水平呈正相关,与HbA1c、病程呈负相关(均P<0.05),与年龄、LDL-C、总胆固醇、三酰甘油均无相关性(均P>0.05)。见表3。
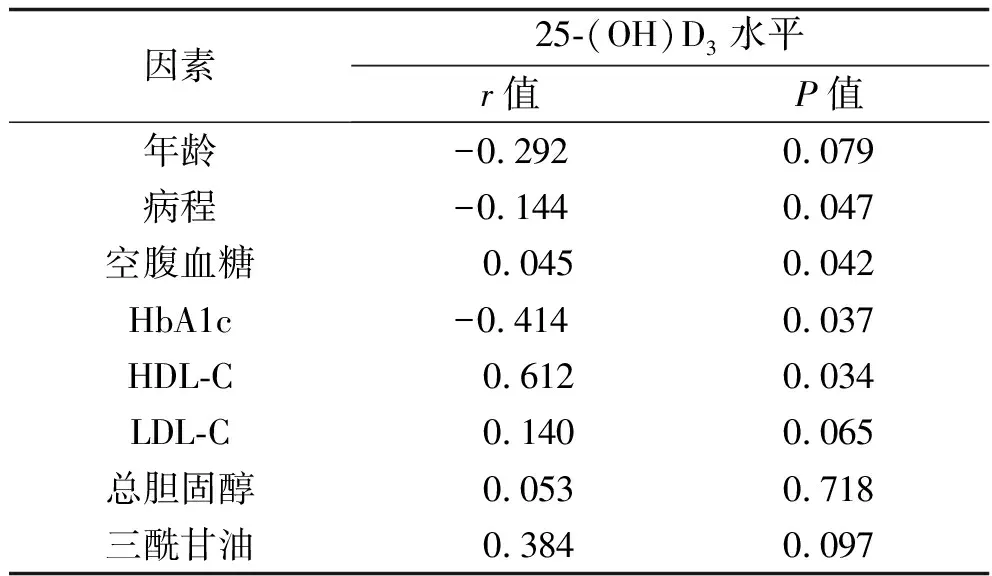
表3 血清25-(OH)D3与年龄、病程及生化代谢指标的相关性
3 讨 论
DPN是T2DM患者发生四肢感觉神经障碍、运动神经异常、糖尿病足的重要危险因素,最终可致残,严重影响患者生活质量[9-10]。引起DPN的因素有高血糖、微血管病变、脂质代谢紊乱、氧化应激损伤、自身免疫损伤以及神经营养障碍等[11]。维生素D是一种脂溶性类固醇激素,其中维生素D3无生物活性,必须转化为25-(OH)D3及1,25-(OH)2D3才能发挥作用[12]。研究证实,维生素D不仅参与钙磷调节,还与多种自发性免疫疾病有关,可促进T2DM患者胰岛β细胞分泌胰岛素,增强胰岛素的敏感性,从而控制血糖[13-14]。
本研究结果显示,DPN组和非DPN组患者的三酰甘油、总胆固醇、HDL-C和LDL-C水平差异无统计学意义(均P>0.05),但病程、空腹血糖和HbA1c水平差异有统计学意义(均P<0.05)。这提示三酰甘油、总胆固醇、HDL-C和LDL-C可能不参与DPN的发生发展过程,而本研究限制研究对象的年龄范围比较小,因而体现不出差异性。但与血糖控制情况相关的病程越长、空腹血糖和HbA1c越高,越容易发生DPN。孙斯雯等[3]认为,长期高血糖是导致DPN发病的主要因素之一,与本研究结果相似。本研究中,DPN组的25-(OH)D3缺乏率高达87.9%,高于对照组和非DPN(均P<0.05),与其他学者[15-16]研究结果一致。有研究显示,25-(OH)D3含量降低是DPN发生的独立危险因素,其原因为25-(OH)D3含量降低,可刺激氧化应激损伤和(或)影响微血管内皮,进而导致DPN的发生和发展[17-18]。本研究结果显示,血清25-(OH)D3水平与病程、HbA1c呈负性相关,与HDL-C和空腹血糖呈正性相关,与王倩等[15]的研究结果一致。但HDL-C和空腹血糖是否为DPN的危险因素还有待进一步研究验证。
综上所述,血清中25-(OH)D3水平与糖尿病病程、空腹血糖HbA1c和HDL-C相关,25-(OH)D3缺乏是DPN的独立危险因素。在临床中,适当补充25-(OH)D3可能有助于预防和延缓DPN的发生发展。但由于本研究样本量有限,今后仍需扩大样本量进一步研究验证。
