桃色顶孢霉获得及其发酵液对马铃薯疮痂病菌的抑制作用
2019-12-11马东梅李双台莲梅刘昕旸刘振华孙冬梅
马东梅 李双 台莲梅 刘昕旸 刘振华 孙冬梅
摘要:从土壤中分离得菌株,利用形态学及18S rDNA测序确定所得菌株为桃色顶孢霉(Acremonium persicinum)。测定该菌株发酵液不同浓度、不同酸碱度、高温处理和较长保存时间条件下,对马铃薯疮痂病菌(Streptomyces scabies)的抑菌作用。结果表明,不同浓度的发酵液对疮痂病菌均有明显抑制作用,浓度为75%时抑菌圈半径最大,为17.1 mm;发酵液经121 ℃ 20 min处理后,抑菌作用与不处理的相近;室温保存9个月的发酵液仍有抑菌效果,但抑菌活性比保存1个月下降了26.43%;发酵液pH调整为3~8时,抑菌效果良好,且中性、偏碱性比酸性发酵液抑菌效果好。该菌株发酵液有较好抑菌效果且稳定性良好,有较好的应用前景。
关键词:马铃薯疮痂病菌(Streptomyces scabies);桃色顶孢霉(Acremonium persicinum);发酵液;抑菌效果
中图分类号:S432.4+2 文献标识码:A
文章编号:0439-8114(2019)20-0084-04
DOI:10.14088/j.cnki.issn0439-8114.2019.20.018 开放科学(资源服务)标识码(OSID):
Obtain of Acremonium persicinum and inhibition of its
fermentation on Streptomyces scabies
MA Dong-mei,LI Shuang,TAI Lian-mei,LIU Xin-yang,LIU Zhen-hua,SUN Dong-mei
(Heilongjiang Bayi Agricultural University,Daqing 163319,Helongjiang,China)
Abstract: Antagonistic fungi was obtained by soil separation, and the strain was identified as Acremonium persicinum by morphology and 18S rDNA sequencing. The effects of its fermentation on Streptomyces scabies were determined by changing the concentration, pH, temperature and preservation time. Results showed that the inhibition ability of different concentrations were obviously, and the maximum inhibition zone was 17.1 mm of 75% concentration. After the fermentation liquid was treated at 121 ℃ for 20 min, the antibacterial activity was similar to that of the non-treatment. The fermentation liquid kept at room temperature for 9 months still had an antimicrobial effect, but the antibacterial activity decreased by 26.43%, which was lower than one month after preservation. When pH of fermentation liquid was adjusted to 3~8, the inhibition ability was sitll good. Neutral, alkaline fermentation liquid has better antimicrobial effects than acid fermentation liquid. The fermentation liquid of the strain has good antibacterial effect and stability, and has a good application prospect.
Key words: Acremonium persicinum; Streptomyces scabies; fermentation liquid; inhibition ability
馬铃薯疮痂病是一种常见的马铃薯土传病害,在日本、韩国、芬兰、加拿大、美国、中国等马铃薯栽培区均有发生[1]。马铃薯疮痂病的病原菌是疮痂链霉菌(Streptomyces scabies),该菌主要危害马铃薯表皮,致使薯块表皮产生褐色痂状硬斑,严重时病斑布满马铃薯表面[2]。在中国,马铃薯疮痂病在东北、华北、西南等主要马铃薯生产地区发生。该病发生后,对马铃薯的外观和品质影响严重,导致其经济价值降低,造成严重的经济损失,制约马铃薯产业的发展[3]。该病主要防治手段为化学防治,存在农药残留、环境污染、抗药性增加等一系列问题[4,5]。鉴于绿色环保理念,利用拮抗微生物抑制病原菌的增长繁殖不失为一种有效的生物防治手段。
生物防治是利用对植物无害或有益的生物来影响或抑制病原物的生存和活动,从而减少病害的发生或降低病害的发展速率[6]。在土壤中尤其是在植物根际存在着大量具有生防潜力的有益微生物,其种类多、数量大、繁殖快,不仅可以对病原菌进行有效的拮抗抑制而且还有促进植物生长和增产的作用,利用土壤有益微生物防治植物病害具有巨大的应用潜力[7]。土壤中存在的有益微生物种类繁多,在生产上广泛应用的大体可分为3种,细菌、真菌和放线菌。其中真菌主要有木霉(Trichoderma spp.)、毛壳菌(Chaetomium spp.)、淡紫拟青霉(Paecilomyces lilacinus)、厚壁孢子轮枝菌(Verticillium chlamydosporium)、小盾壳霉(Coniothyrium minitans)和多种菌根真菌等。
本研究主要探讨不同浓度的桃色顶孢霉(Acremonium persicinum)发酵液的拮抗能力,以及不同pH、温度条件下发酵液对抑菌效果及其抑菌稳定性的影响,为将其作为生防菌应用于马铃薯疮痂病的生物防治提供依据。
1 材料与方法
1.1 材料
1.1.1 供试土壤 土壤采自黑龙江八一农垦大学校园内。
1.1.2 供试菌 病原菌马铃薯疮痂链霉菌,由黑龙江八一农垦大学生命学院刘权老师赠予。
1.1.3 培养基 查氏培养基:NaNO3 2.00 g,K2HPO4 1.00 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4 0.01 g,蔗糖30.0 g,琼脂15.0 g,去离子水1 000 mL,pH自然。
PDA培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂15 g,去离子水1 000 mL,pH自然。
高氏培养基:淀粉20 g,KNO3 1 g,NaCl 0.5 g,K2HPO4 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,琼脂 20 g,去离子水1 000 mL,pH 7.2~7.4,煮沸,121 ℃灭菌25 min。
改良查氏培养基:NaNO3 2 g,K2HPO4 1 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4 0.01 g,蔗糖30 g,酵母30 g,去离子水1 000 mL,pH自然,121 ℃灭菌25 min。用于桃色顶孢霉的液体培养。
1.1.4 仪器 高性能无菌操作台(DJ-CJ-ZN型,哈尔滨东联电子技术开发有限公司);空气浴振荡器(HZQ-C型,哈尔滨东联电子技术开发有限公司);电热恒温箱(DRP-9162型,上海森信实验仪器有限公司);压力蒸汽灭菌锅(上海申安医疗器械厂);光学显微镜(XSJ-2型,重庆光学仪器);pH计(FE28-Standard型,梅特勒托利多集团)。
1.2 方法
1.2.1 土壤内真菌的分离与鉴定 选取校园内山坡上具有代表性的地点,用铁锹挖取土壤深度约4~10 cm的土样,去除较大颗粒,装入取样纸袋,将纸袋标记好并带回实验室。
称取5 g阴干的土样,放入已灭菌的研钵里进行研磨后,用无菌水将土样稀释成10-1、10-2、10-3、10-4、10-5倍的土壤悬液,吸取不同稀释度的土壤悬液约0.1 mL涂布在PDA培养基上,每组设3个重复,28 ℃恒温箱暗培养。待菌落长出后,挑取大小、形态、色泽不同的单菌落在查氏培养基平板上重新培养纯化。观察纯化后的菌落形态以及显微形态特征,包括有无分生孢子、形状以及弯曲度、产孢细胞的着生方式、有无菌核等,鉴定其种类,获得桃色顶孢霉菌,并将其接入试管斜面保藏。
1.2.2 桃色顶孢霉发酵液制备 将试管斜面保存的桃色顶孢霉菌接种到新鲜的查氏培养基上活化7 d,加无菌水10 mL,用接种环将桃色顶孢霉的孢子刮下,在装有200 mL查氏液体培养基的500 mL三角瓶中加入孢子悬液10 mL,28 ℃ 130 r/min摇床培养6~12 d,将发酵液于5 000 r/min离心5 min,上清液经0.22 μm無菌微孔滤膜过滤,获得拮抗菌株无菌发酵液。4 ℃保存备用。
1.2.3 桃色顶孢霉发酵液拮抗能力测定 将疮痂链霉菌在高氏一号平斜面上32 ℃培养4~6 d,用无菌水洗下,用移液枪吸取200 μL至高氏一号平板上,用涂布棒涂布均匀。用镊子将无菌牛津杯放置于上述平板中央,用移液枪吸取200 μL桃色顶孢霉发酵液加至牛津杯中,于32 ℃培养箱中培养2~3 d,观察病原菌生长情况,测量抑菌圈半径。重复3次。
1.2.4 不同浓度发酵液抑菌能力测定 将发酵液经0.22 μm微孔滤膜过滤后,分装到5个试管中,加入无菌水调节发酵液浓度分别为5%,25%,50%,75%,100%,参照“1.2.3”方法检测滤液抗菌活性,以无菌水为对照。测量抑菌圈半径。每个处理重复3次。
1.2.5 发酵液抑菌稳定性测定
1)热稳定性测定。按“1.2.2”方法制备拮抗菌株无菌发酵液,在121 ℃条件下高温灭菌20 min。冷却后用0.22 μm无菌微孔滤膜进行过滤,参照“1.2.3”方法检测滤液抗菌活性,以原始无菌发酵液作为对照。重复3次。
2)酸碱度稳定性测定。按照“1.2.2”方法制备拮抗菌株无菌发酵液,分别取21 mL分装于7支小试管中,用磷酸缓冲液调节pH为3~8,然后用0.22 μm无菌微孔滤膜进行过滤,以原始发酵液作为对照。每个处理重复3次。
3)发酵液有效保存时间测定。按“1.2.2”方法得到发酵液,分别保存1、3、6、12个月,参照“1.2.3”方法进行抑菌试验。
1.2.6 数据统计与分析 用DPS和Excel进行数据分析
2 结果与分析
2.1 真菌的分离与鉴定
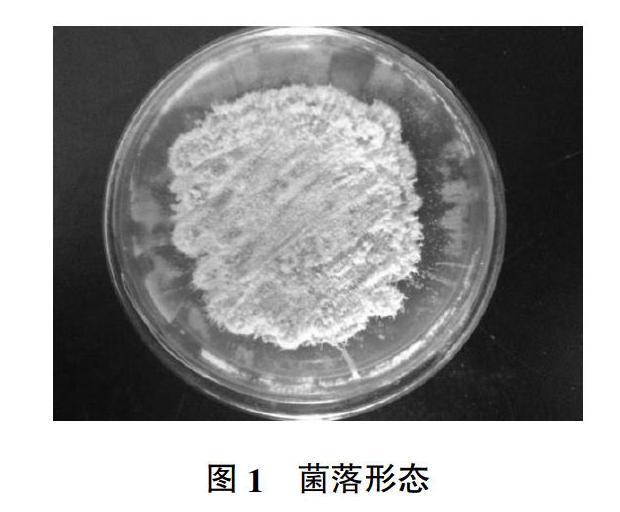
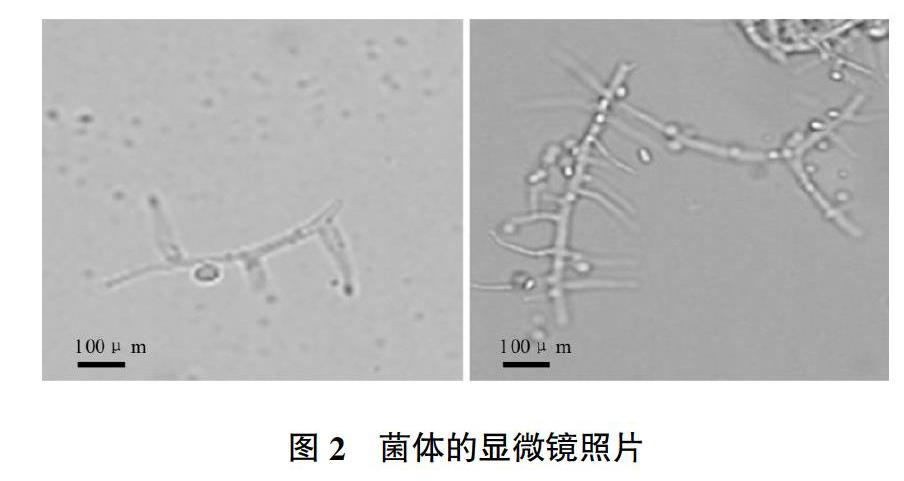
从土壤中分离获得了1株菌落形态不同于木霉的真菌,该真菌查氏固体平板培养基中的菌落为绒毡状,菌落表面为淡粉色(图1);利用显微镜进行形态学观察显示,该菌株的产孢结构为瓶梗,且瓶梗底部膨大,互生,孢子着生在瓶梗顶端(图2),形态学初步鉴定为顶孢霉属。
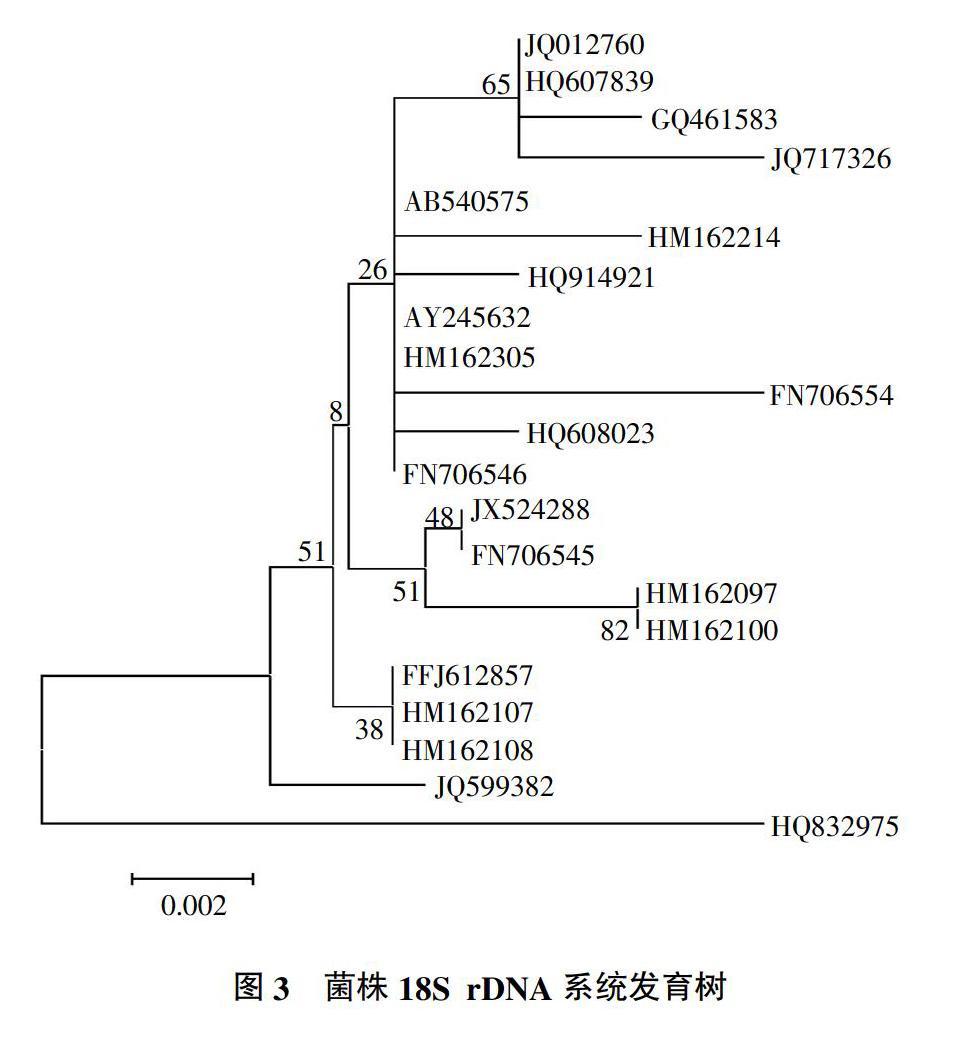
利用ITS4与ITS5一对通用真菌序列引物,对DNA克隆与扩增,转化到大肠杆菌DH5α菌株,送测序公司检测18S rDNA序列。在GenBank中选取与18S rDNA序列相似性大于99%的20株菌株,用Clustalx软件进行比较,主要集中在顶孢霉属(Acremonium);用MEGA4程序中Neighbor Joining方法建立系统发育树(图3)。结果表明,该菌与Acremoniumpersicinum FN706545的亲缘关系近,结合形态学结果,鉴定该菌株为桃色顶孢霉(Acremonium persicinum)。
2.2 不同浓度发酵液对马铃薯疮痂病菌的抑制效果
牛津杯试验结果表明,桃色顶孢霉发酵液对马铃薯疮痂病菌有较强的抑制作用;各处理浓度的桃色顶孢霉发酵液对马铃薯疮痂病菌有抑菌效果,但抑制效果不同。在一定范围内,抑菌圈半径随着发酵液浓度的增加而增大,浓度为25%以上时即可很好发挥抑制作用,当发酵液浓度为75%时抑菌圈最大,略大于发酵液浓度为100%时的抑菌圈半径,而对照组无抑菌作用(图4)。
2.3 发酵液抑菌的稳定性
2.3.1 发酵液抑菌热稳定性 在121 ℃灭菌20 min后,顶孢霉发酵液对疮痂病菌的抑制作用仍然明显(图5),且与不经高温处理的相比变化不大。这证明了顶孢霉发酵液中的抑菌活性成分具有较好的热稳定性。
2.3.2 发酵液抑菌酸碱稳定性 利用磷酸缓冲液分别调节发酵液pH为3、4、5、6、7、8,抑菌试验表明,不同酸碱度的发酵液抑菌效果仍然较明显。在中性、碱性条件下发酵液抑菌效果明显要优于酸性条件,在pH为7时,抑菌效果最佳,抑菌圈半径最大,达到17.1 mm(图6)。
2.3.3 发酵液有效保存时间 保存时间为1、3、5、7、9个月的发酵液抑菌试验表明,抑菌活性在前3个月时无明显变化,到第5个月时略有下降,直至第9个月时发酵液的抑菌活性仍然存在,抑菌活性比第一个月下降了26.43%,即该菌株发酵液抑菌活性可维持时间较长(图7)。
3 小结与讨论
生物防治在土传病害防治方面具有独特的优势,不仅能够减轻病害发生, 而且对环境安全、无污染[8]。筛选生防菌用于马铃薯疮痂病的治疗,对于环保有着较大的意义。徐红艳等[9]用平板纸片法从刺五加内生放线菌中筛选出对马铃薯疮痂病菌有拮抗作用的16株活性较强且稳定的拮抗菌,其中“13-180”菌株的抑菌圈半径达到了20.165 mm。高同国等[10]鉴定发现解淀粉芽孢杆菌(“12-82”)对马铃薯疮痂病有高效拮抗作用,抑菌圈半径达13.1 mm。郭凤柳等[11]研究发现枯草芽孢杆菌对马铃薯疮痂链霉菌同样有抑制作用,抑菌圈最大半径达到7.165 mm。林志伟等[12]发现桃色顶孢霉发酵液对绿豆白粉病有抑制作用。张雨竹等[13]发现顶孢霉发酵液对镰刀菌的菌丝生长有着明显的抑制作用,菌丝明显变稀疏。
本研究结果表明,桃色顶孢霉发酵液稀释至75%时,其抑菌圈半径最大,达17.1 mm。桃色顶孢霉发酵液不仅具有明显的抑菌效果,且其热稳定性及酸碱稳定性较好,121 ℃高温处理20 min、在pH为3~8条件下,抑菌效果仍然明显;在发酵液保存时间长达9个月时,其抑菌效果仍然存在。证明了桃色顶孢霉发酵液具有较好抑菌作用,同时其稳定性良好,具备作为微生物制剂工业化生产的潜力。
参考文献:
[1] 孙 静.不同防治方法对马铃薯疮痂病防效及农艺性状影响的研究[D].大庆:黑龙江八一农垦大学,2015.
[2] 郭凤柳,张海颖,赵伟全,等.马铃薯疮痂病菌分子检测探针的筛选[A].郭泽建,李宝笃.中国植物病理学会学术年会论文集[M].北京:中国农业科学技术出版社,2012.
[3] 张海颖.我国北方马铃薯疮痂病菌组成分析与致病菌株分子检测[D].石家庄:河北农业大学,2014.
[4] 李洪浩,丁 凡,余韩开宗,等.马铃薯疮痂病的发生及防治措施[J].四川农业科技,2017(2):25-26.
[5] 李兴龙,李彦忠.土传病害生物防治研究进展[J].草业学报,2015,24(3):204-212.
[6] 胡燕梅,楊 龙.利用微生物防治植物病害的研究进展[J].中国生物防治,2006(S1):190-193.
[7] 马成涛,胡 青,杨德奎.土壤有益微生物防治植物病害的研究进展[J].山东科学,2007,20(6):61-67.
[8] 徐 娅,谢成建,杨星勇.棉花黄萎病生物防治研究进展[J].安徽农业科学,2019,47(2):18-22.
[9] 徐红艳,王 卫,王 彬,等.刺五加内生放线菌对马铃薯疮痂病菌拮抗作用初探[J].西北农业学报,2016,25(11):1742-1748.
[10] 高同国,姜军坡,郭晓军,等.马铃薯疮痂病高效拮抗菌的筛选及鉴定[J].江苏农业科学,2016,44(12):157-159.
[11] 郭凤柳,张海颖,李 勇,等.马铃薯疮痂病拮抗菌株B1的鉴定及防效测定[J].江苏农业科学,2013,41(5):90-93.
[12] 林志伟,张 新,肖亚静,等.桃色顶孢霉代谢产物对绿豆白粉病的防治作用[J].天然产物研究与开发,2016(6):934-937.
[13] 张雨竹,董雪梅,郭春兰,等.桃色顶孢霉发酵液对大豆的促生及对抗氧化酶活性的影响[J].中国油料作物学报,2014,36(4):519-523.
