芽孢杆菌与植物生长调节剂在苔藓结皮种源扩繁中的作用
2019-12-11王清玄鞠孟辰卜崇峰1
王清玄,鞠孟辰,卜崇峰1,
(1.中国科学院 水利部 水土保持研究所,陕西 杨凌712100;2.中国科学院大学,北京100049;3.西北农林科技大学 水土保持研究所 陕西 杨凌712100)
生物结皮是由苔藓植物、地衣、藻类、真菌和细菌等与土壤颗粒形成的复合体,广泛分布于干旱、炎热和贫瘠的环境中[1]。作为生物结皮的一种主要形式,苔藓结皮有着多种水土保持功能与生态功能[2-4],对植被恢复与重建具有积极意义[5],应用前景十分广阔。研究表明,通过一定的技术措施实现野外人工快速恢复苔藓结皮是完全可行的[6-7],然而,工程化推广时遇到了生物结皮种源需求难以满足的瓶颈问题。初步的种源扩繁试验显示,营造适宜的环境条件、采取适合的培养基(培养液),能够实现生物结皮种源的快速扩繁[8-9]。不过,由于目前进行种源扩繁的实践中存在培育周期长、株高度低于自然发育的苔藓、培育后期易发生衰败和退化等问题,严重阻碍了扩繁的速度与有效性,使得生物结皮的种源供给不足成为限制这一技术推广应用的瓶颈。
土壤微生物是苔藓结皮的重要组分,通过改善表土结构、提高表土养分提供适宜苔藓植物生长的表土微环境[10]。芽孢杆菌是一类可促进多种植物生长发育的微生物[11],在荒漠地区约占土壤微生物的50%,是促进生物结皮形成与发育的重要微生物[12]。将其引入苔藓结皮的种源扩繁过程中,可能会对其生长发育有一定的促进作用。苔藓植物茎叶碎片有很强的繁殖能力,在环境适宜时,其茎叶碎片细胞经分裂和分化形成小植物体,进而产生大量的新植物体[13]。研究表明,多种植物生长调节剂能通过诱导植物愈伤组织及增强光合作用等方式促进苔藓结皮的生长发育[14-15]。目前,苔藓结皮种源扩繁的研究仍主要集中在对环境因子与营养物质等方面。对生长调节剂的应用虽有大量研究,但主要集中在组织培养与高度可控的培养箱环境下,温室环境下的培育研究还有待进一步加强。
本研究在温室培育实验中引入芽孢杆菌、生长调节剂两种因子,观测不同处理作用下苔藓结皮的覆盖度、株高度和株密度的变化,探讨两种因子对温室苔藓种源扩繁的影响,以期为苔藓种源室内快速扩繁提供技术支持。
1 材料与方法
1.1 种源采集与制备
苔藓结皮样品于2018年6月17日采自陕西省延 安 市 砖 窑 湾 镇 贾 居 沟(109°08′—109°14′E,36°42′—36°48′N,海拔1 003~1 203 m)深处人为干扰较少地区,优势苔藓种为土生对齿藓(Didymodon vineɑlis),伴生有丛生真藓(Bryum cɑespiticium)等。用小铲取上部1 cm 较为完整、株高度大于5 mm 的发育良好的苔藓结皮。将采集好的结皮置于干燥阴暗处晾干。剔除杂质后用粉碎机粉碎至长度分布在0.01~2 mm 的茎叶碎片,即为扩繁试验所用种源。
1.2 扩繁培育环境
使用西北农林科技大学的科研温室。试验开始前,在温室的顶部加装反光膜,南北向挂搭遮光布,并定时开启湿帘、定期洒水,调节温室内温度与光照强度到适合苔藓生长发育的水平。控制基质含水率在15%~30%(由于基质较薄,体积含水量日动态变化以浇水后达到约100%的峰值,后随水分蒸发逐渐降低至10%~30%间时,需要再次补水)。使用角铁搭建多层支架,下铺吊顶板,保证层间受光均匀,架高2 m,长2.4 m,宽1.2 m。经测定,整个培育周期内温度最大值为35 ℃,光照最大值2.60×104lux。
1.3 试验设计与布置
本试验考虑芽孢杆菌(巨大芽孢杆菌Bɑcillus megɑterium,BMe;胶质芽孢杆菌Bɑcillus mucilɑginosus,BMu)和生长调节剂(TDZ)两个因素。设计完全试验,共6 个处理,重复4 次,共计24 个样品。使用下部带孔的方形30 cm×30 cm×2 cm 接种盘,将土工布垫于接种盘底部,其上按照处理均匀覆盖添加了胶质芽孢杆菌(1 g/kg基质)或巨大芽孢杆菌(1 g/kg基质)的泥炭土基质3~4 mm,使用高雾化度的喷头喷水浸湿。按300 g/m2将等量长度为0.01~2 mm茎叶碎片均匀撒播在基质表面,并在相应处理均匀喷洒生长调节剂TDZ(1 mg/L)稀释液200 ml。播种后于培养环境内随机摆放。每15 d喷洒Hoagland营养液(2.1 L/m2)一次,并记录当日苔藓覆盖度、株高度和株密度。试验于2018 年8 月17 日启动,2018年10月17日结束,历时两个月。
1.4 观测指标与方法
1.4.1 苔藓覆盖度 按照五点取样法在接种盘内选5个点。参考专利隐花植物盖度野外测定样框[16],自制10 cm×10 cm 正方形网格板,网格尺寸2.5 cm×2.5 cm,共计16个网格。观测每个网格下苔藓覆盖度,求和后除以网格板面积,即为该样框下苔藓覆盖度。
1.4.2 苔藓株高度 用电子游标卡尺随机测量接种盘内15株苔藓,每株重复测量3次。
1.4.3 苔藓株密度 按照五点取样法在接种盘内选5个点,使用1.3.1中自制网格板,观测每个网格下苔藓株数,求和后除以网格板面积,即为该样框下苔藓株密度。
1.5 数据处理
使用Excel 2016对数据进行预处理,使用R 3.4.1进行巴特莱特方差齐性检验,并使用SPSS 20.0进行数据的方差分析与Tukey HSD 多重比较。
2 结果与分析
2.1 不同添加物对苔藓覆盖度的影响
图1为不同处理在60 d内苔藓覆盖度的变化情况。可以看到,在整个培育期内,苔藓覆盖度增长速度先慢后快,第15 d与第30 d所测数据差异很小,平均增幅仅为2.09%。此后苔藓覆盖度增速明显变快,不同处理间差异更加明显。此外,TDZ,BMe+TDZ两种处理的差异在4次观测中盖度均较为接近;添加巨大芽孢杆菌与空白对照两种处理的盖度差异不大。
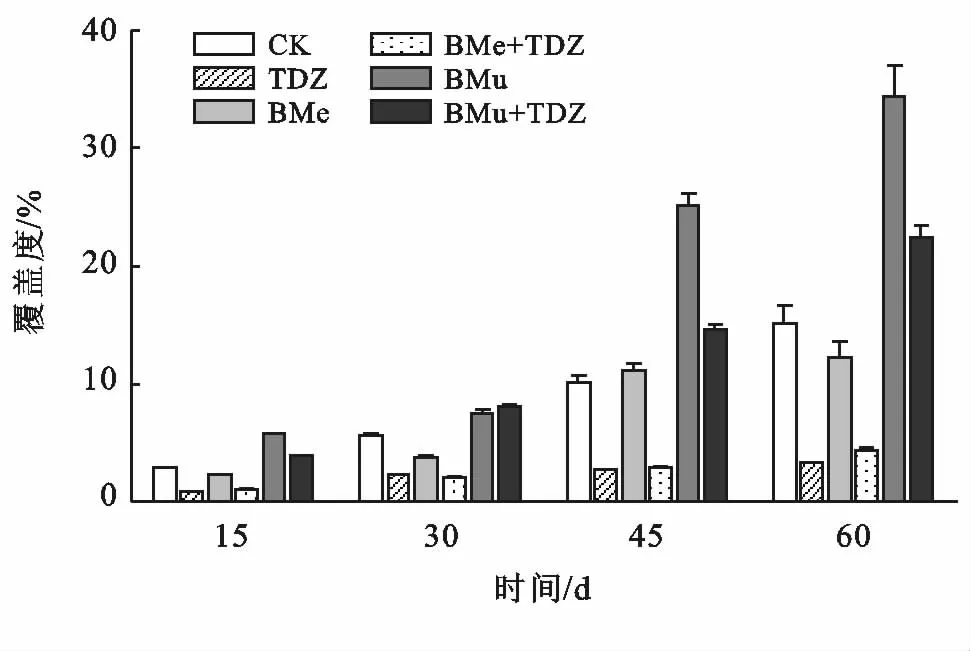
图1 苔藓结皮覆盖度变化情况
对苔藓覆盖度数据进行正态性检验与方差齐性检验,结果均不显著(p>0.05),表明该组数据满足方差分析的前提假设。60 d结皮盖度方差分析结果(见表1)显示,芽孢杆菌、生长调节剂对覆盖度均有显著的影响(p<0.05)。其中芽孢杆菌的F 值(21.32)大于生长调节剂(13.76),表明前者解释了更多部分的差异,对生物结皮盖度的影响大于后者。
多重比较结果显示不同处理的苔藓覆盖度由小到大分别为:TDZ(3.33%)=BMe +TDZ(4.33%)<BMe(12.22%)=CK(15.11%)<BMu +TDZ(22.44%)<BMu(34.44%)。1 mg/L的TDZ对苔藓覆盖度有显著地负效应,相比于空白对照,盖度减少了11.8%。BMu 处理与CK 相比盖度提高了127.93%,但BMe处理与CK 无明显差异。

表1 苔藓结皮覆盖度的方差分析
2.2 不同添加物对苔藓株高度的影响
图2为不同处理在60 d内苔藓株高度的变化情况。在整个培育期内,不同处理下苔藓株高度的变化呈现出多种模式。第一个15 d内BMu处理株高度最大,达到0.89 mm。第二个15 d内BMu处理株高度几乎没有变化,此时CK 处理株高度增长幅度最大,达到1.90 mm。此后的两个15 d各处理株高度均有大幅增长,其中TDZ与BMe+TDZ处理株高度远小于其他处理。
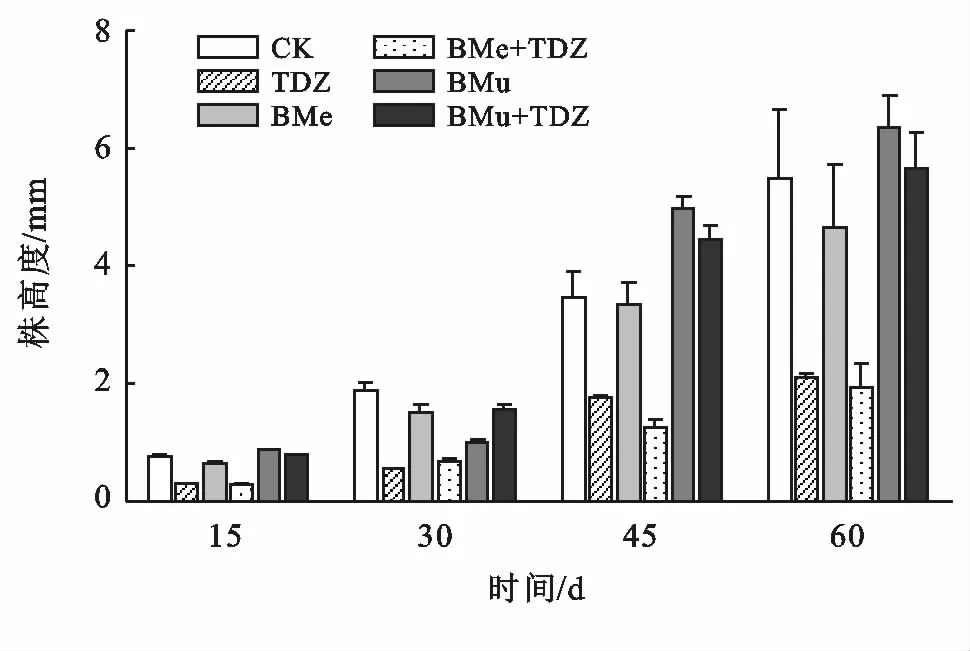
图2 苔藓株高度变化情况
对苔藓株高度数据进行巴特莱特方差齐性检验,p=0.6,表明各处理苔藓株高的主要差异来自处理。60 d苔藓株高度的方差分析结果(见表2)显示:功能性微生物、生长调节剂对覆盖度均有显著的影响(p<0.05)。其中芽孢杆菌的F 值(5.70)小于生长调节剂(10.57),表明两种因素中生长调节剂对苔藓株高度的影响更大。
培育60 d后,不同处理间苔藓株高度由小到大分别为:BMe+TDZ(1.94 mm)<TDZ(2.12 mm)<BMe(4.67 mm)<CK(5.48 mm)<BMu+TDZ(5.66 mm)=BMu(6.33 mm)。1 mg/L生长调节剂TDZ对苔藓株高度有显著的负效应,与CK 相比TDZ处理的株高度降低了61.26%。BMe与CK 处理无显著差异。BMu处理的株高度最高,达到了6.33 mm,比最低的BMe+TDZ处理多生长4.39 mm。
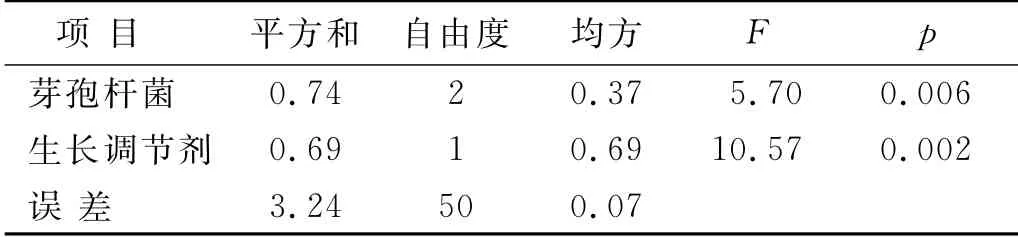
表2 苔藓株高度的方差分析
2.3 不同添加物对苔藓株密度的影响
图3为不同处理在60 d内苔藓株密度的变化情况。BMu处理在第15 d 观测时株密度最大(2.44株/cm2),CK 最小(0.28 株/cm2)。至培育第30 d,BMe+DZ 处理株密度最大,达到4.60 株/cm2,而CK 与TDZ处理几乎无变化。第30 d至第45 d期间,BMu处理株密度由2.90株/cm2增至14.95株/cm2,远高于其他处理。此外,BMe处理株密度小于BMu处理,但添加TDZ 后二者大小关系相反,表明TDZ与BMe间存在一定的相互作用。

图3 苔藓结皮株密度变化情况
巴特莱特齐性检验p 值为0.20,满足方差分析的前提假设。方差分析结果表明(见表3),芽孢杆菌及二者交互作用均对苔藓结皮株密度有极显著(p<0.001)的影响,其F 值分别为16.90和10.30。生长调节剂的影响不显著(F=2.67,p=0.11)。
培育60 d 后,各处理株密度由小到大分别为:CK(1.61 株/cm2)=TDZ(2.19 株/cm2)<BMu+TDZ(5.91株/cm2)=BMe(7.37 株/cm2)<BMe+TDZ(11.04 株/cm2)<BMu(17.05 株/cm2)。可以发现,除TDZ处理外其他4种处理株密度均显著大于CK 组。相比BMu处理,BMu+TDZ的株密度减少了65.34%,差异达到极显著水平,表明1 mg/L浓度TDZ会减弱BMu的正效应。与之相反,BMe+TDZ处理较BMe处理株密度增加49.73%,表明施加TDZ强化了BMe对苔藓株密度生长的促进作用。而BMe+TDZ与BMu+TDZ处理株密度均显著高于TDZ处理,表明芽孢杆菌能促进TDZ在苔藓株密度方面的增长。

表3 苔藓结皮株密度的方差分析
3 讨论
3.1 芽孢杆菌对苔藓结皮的影响
芽孢杆菌显著地促进了温室苔藓结皮的生长发育。具体表现为:胶质芽孢杆菌和巨大芽孢杆菌都能显著提高苔藓株密度,前者还能促进苔藓覆盖度、株高度的发育。这可能与芽孢杆菌自身特性及适宜的培育方式有关。在培养期内定期喷洒Hoagland 营养液势必会使添加的芽孢杆菌大量繁殖,其解体后自身累积的营养元素通常以可溶性的阳离子状态存在[17],而本次培育过程中定期补水也有利于这些离子持续溶解,延长了苔藓植物可吸收的时间。此外,本试验所使用的培育基质泥炭土富含大量的营养元素,而芽孢杆菌作为根际微生物的一种,被证实够通过其在生命活动时产生的多种代谢物质将土壤中的矿物钾、固定钾溶解为植物可直接吸收利用的形态[18]。因此推断可能是施加的芽孢杆菌将泥炭土中的营养元素活化,转化为可供苔藓植物直接吸收的形态。
本试验中,巨大芽孢杆菌对苔藓结皮的影响并不全都是积极的:其显著地降低了苔藓的株高度,对盖度的影响也不显著。这与胶质芽孢杆菌的效应截然不同,具体原因可能由以下两方面所致。首先,两种微生物的特性有所差异。胶质芽孢杆菌能够通过分泌胞外代谢物、固氮作用来促进作物生长与抗病抗旱能力[19],而巨大芽孢杆菌的研究中未有类似的结论。丁玲等[20]研究胶质/巨大芽孢杆菌对印度芥菜生长的影响,其结果与本研究一致:相同浓度下胶质芽孢杆菌对印度芥菜生长的促进作用显著优于巨大芽孢杆菌。其次,高浓度施用微生物会对植物起抑制作用。柳艳艳等[21]研究表明,0.1 g/kg 浓度巨大芽孢杆菌对油菜产量和根系生长有显著促进作用,但1 g/kg浓度时会抑制油菜生长。这与本研究结果一致:施用1 g/kg巨大芽孢杆菌后,苔藓的株高度显著小于未施用巨大芽孢杆菌处理。这种微生物固有属性的差异和施用量的不同可能是添加胶质芽孢杆菌的处理在苔藓覆盖度、株高度方面优于添加巨大芽孢杆菌处理的原因。
3.2 生长调节剂对苔藓结皮的影响
本试验所选择的生长调节剂TDZ对苔藓结皮表现出显著的负效应:除与巨大芽孢杆菌共同添加能显著增大苔藓株密度外,其余含TDZ 的处理均显著减小了苔藓的盖度、株高度与株密度。这与Yang等[22]的结论相反,该研究同样施用1mg/L 的TDZ,培育结束后显著增大了苔藓的覆盖度、株高度、株密度及生物量。这可能与TDZ的施用浓度有关。生长调节剂能对苔藓结皮生长发育有显著的影响[23],但生长调节剂的施用浓度会显著改变其对苔藓的效应。研究表明,4-D,KT,IBA,NAA,TDZ和6BA 这4种植物生长调节剂随着施用浓度的提高对苔藓结皮生长发育的影响均表现出由促进转为抑制的趋势[15]。骆华容等[24]研究有类似的结果,发现施用不同浓度的植物激素对苔藓生长的影响有显著不同,高浓度可能会抑制苔藓正常生长发育。其他植物的研究中也有类似的结论:0.02 mg/L 的TDZ施用量对毛萼紫薇种子出苗率提高最大,但随着浓度升高反而会降低种子出苗率[25]。
此外,环境条件可能会间接改变TDZ对苔藓结皮影响的效果。TDZ在一定情况下会造成植物体内矿物质或其他代谢物质的积累超过正常水平,使植物进入了逆境胁迫状态导致生长发育受阻[26]。本研究的培养期处在在8—9月,温室环境温度高,水分蒸发速度很快快,还进行定期补水。这种干湿交替可能造成接种盘内TDZ浓度期性的上升与下降,若此过程中TDZ浓度超过苔藓的适用范围,则可能导致上述研究中的逆境胁迫现象,造成施加TDZ的处理其生长状况显著低于未施加的处理。因此,本研究的结果仅适用于夏季温室特定的光温水条件,在其他培养环境下植物生长调节剂对苔藓生长发育的影响程度尚需更多针对性的研究。
3.3 苔藓结皮种源扩繁技术的优化
本研究验证了芽孢杆菌以及芽孢杆菌+TDZ对黄土区优势苔藓种培育有明显的促进作用,但有关芽孢杆菌与生长调节剂的水平设置存在不足。今后尚需从不同浓度、不同菌种等方面做进一步设计,观测相关的生理化学指标,探讨相关作用的机理机制,最终形成一套完善的种源扩繁的生物添加技术。
杨永胜等[27]在人工气候室培育苔藓结皮,各处理培育60 d后苔藓覆盖度、株高度普遍高于本试验,这种差异可能与培育期间的温度有关。适宜苔藓生长的大致温度范围在15 ℃~30 ℃[28-29]。本试验培育期为8—9月,当地室外温度长期处于30 ℃以上,尽管采取了遮荫与开启湿帘等方法,但由于所使用温室面积较小(28.8 m2),湿帘的调控能力有限,温室内温度在正午仍长期处于30~35 ℃,水分蒸发极为迅速。而杨永胜试验设置温度为20/10℃(昼/夜)。在高温环境下进行定期的补水与施加营养液,可能会导致苔藓发育过程中频繁发生失水—复水过程,阻碍其正常生理活动的持续有效进行[30]。因此,后续研究应避开高温强光照的夏季,并选择更大面积的温室,确保培育环境均质且稳定。
4 结论
本研究表明,在温室条件下,胶质芽孢杆菌显著促进了苔藓结皮覆盖度、株高度与株密度的增长,巨大芽孢杆菌显著促进了苔藓结皮株密度的增长,而1 g/kg浓度生长调节剂TDZ 则表现出显著的负作用。我们认为,构建稳定、适生的环境条件,并适量添加芽孢杆菌与生长调节剂,能够实现苔藓结皮种源的快速扩繁。
