康士得用于早期老年前列腺癌根治术后的治疗效果
2019-12-10何江
何江
(郑州大学第五附属医院泌尿外科 河南郑州450052)
前列腺癌是发生于前列腺的上皮性恶性肿瘤。至2012年,我国前列腺癌发病率已高达9.92/10万,列男性恶性肿瘤第6位[1]。有研究指出,前列腺癌发病率与年龄呈正相关,好发于老年人群,同时遗传因素也为其高危因素,性生活、饮食等因素也可对其发病率造成影响[2]。前列腺癌具有潜伏期长的特点,其早期往往无明显症状,随着肿瘤的增大,可出现压迫症状,如排尿困难、尿线细、射程短等,较严重者还可出现转移症状,侵及膀胱引起血尿,转移至骨引起骨痛、病理性骨折等,严重影响患者的生活质量[3]。早期前列腺癌局限于前列腺内,尚未侵犯包膜,治疗意义较大[4~6]。腹腔镜下根治术是针对早期前列腺癌的有效治疗手段,得到临床认可。但是对于老年患者,单纯行腹腔镜下根治术治疗后其控尿功能恢复并不完全,需术后加以积极有效的药物干预,常规方法为黄体生成素释放激素类似物去势治疗,然而效果不佳。目前,抗雄激素治疗被应用于腹腔镜下早期老年前列腺癌根治术后,但我国关于这方面的研究并不多见。本研究将康士得应用于腹腔镜下早期老年前列腺癌根治术后,取得了较好的治疗效果。现报道如下:
1 资料与方法
1.1 一般资料 研究对象选取泌尿外科2016年1月~2018年1月收治的早期老年前列腺癌患者100例,均进行腹腔镜下根治术,将其随机分为对照组和观察组,各50例。对照组年龄60~80岁,平均年龄(74.9±11.8) 岁;身高 153~172 cm,平均身高(161.34±8.65)cm;体质量55~75 kg,平均体质量(65.32±10.21)kg;病理类型:腺癌 39例,鳞癌 10例,未分化癌1例。观察组年龄61~80岁,平均年龄(75.2±11.1) 岁;身高 154~172 cm,平均身高(161.31±8.36)cm;体质量54~76 kg,平均体质量(65.01±10.31)kg;病理类型:腺癌40例,鳞癌10例,未分化癌0例。两组一般资料比较无统计学差异(P>0.05),具有可比性。
1.2 纳入标准 经影像学检查、病理学检查确诊为早期前列腺癌;年龄≥60岁;符合腹腔镜下根治术手术指征,即前列腺特异抗原(PSA)<10~20 ng/ml,Gleason评分≤7分,TNM分期T1~T2c[7],预期生存期≥10年;具有一定的语言表达能力;患者及其家属签署知情同意书。
1.3 排除标准 合并严重心、肺疾病者;无长时间气腹压力耐受能力者;合并精神障碍、认知障碍者;术后血清PSA明显升高,不得不再次使用诺雷得、康士得等雄激素阻断药物者。
1.4 治疗方法 两组行常规术前准备,采用气管插管静脉复合全身麻醉,在耻骨联合上方与肚脐之间作下腹正中腹膜外切口。首先对患者盆腔淋巴结进行清扫并送检,再切断耻骨前列腺韧带和缝合结扎完毕的背深静脉浅支,结扎切断输精管游离精囊,摘除前列腺及附近的结缔组织,最后留置盆腔引流管引流。术后对患者行抗感染、止痛等对症处理,保持引流管和导尿管畅通。对照组术后予以黄体生成素释放激素类似物亮丙瑞林缓释注射剂(国药准字H20093809) 皮下注射,3.75 mg/次,1 次 /4 周,3 个月为1个疗程,连续干预3个疗程。观察组术后予以非甾体类抗雄激素药物康士得(国药准字J20100125)口服,50 mg/次,1次 /d,3个月为 1个疗程,连续干预3个疗程。
1.5 观察指标 (1)比较两组患者拔管时、术后半年、术后1年的完全控尿率。(2)比较两组患者治疗前后的血清游离前列腺特异性抗原(f-PSA)、总前列腺特异性抗原(t-PSA)、f-PSA/t-PSA水平。治疗前后,于清晨患者空腹状态下抽取其静脉血5 ml,离心取血清,采用酶联免疫吸附实验(ELISA)进行检测。
1.6 统计学方法 数据处理采用SPSS21.0统计学软件,计量资料以(表示,采用t检验,计数资料用率表示,采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组拔管时、术后半年、术后1年的完全控尿率比较 两组拔管时完全控尿平比较无明显差异(P>0.05);观察组术后半年、术后1年的完全控尿率均明显高于对照组(P<0.05)。见表1。
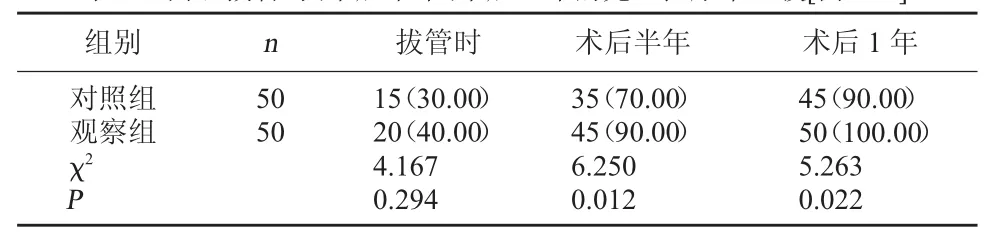
表1 两组拔管时、术后半年、术后1年的完全控尿率比较[例(%)]
2.2 两组治疗前后血清f-PSA、t-PSA、f-PSA/t-PSA水平比较 两组治疗前血清 f-PSA、t-PSA、f-PSA/t-PSA水平比较无显著性差异(P>0.05);观察组治疗后血清f-PSA、t-PSA明显低于对照组,f-PSA/t-PSA明显高于对照组,差异有统计学意义(P<0.05)。见表 2。
表2 两组治疗前后血清f-PSA、t-PSA、f-PSA/t-PSA水平比较
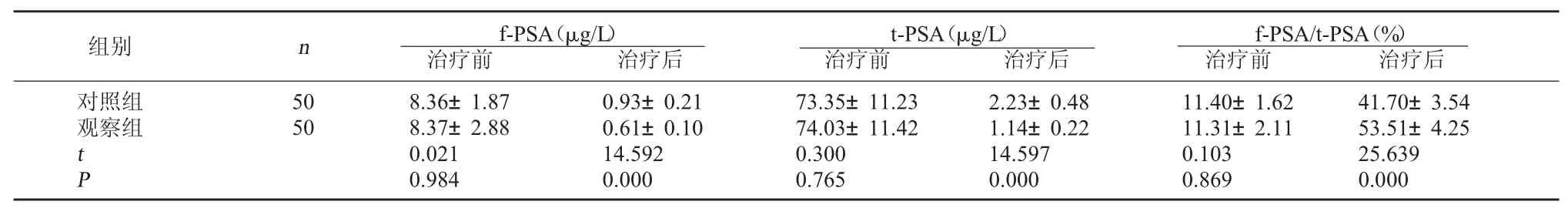
表2 两组治疗前后血清f-PSA、t-PSA、f-PSA/t-PSA水平比较
f-PSA/t-PSA(%)治疗前 治疗后对照组观察组组别 n f-PSA(μg/L)治疗前 治疗后t-PSA(μg/L)治疗前 治疗后50 50 tP 8.36±1.87 8.37±2.88 0.021 0.984 0.93±0.21 0.61±0.10 14.592 0.000 73.35±11.23 74.03±11.42 0.300 0.765 2.23±0.48 1.14±0.22 14.597 0.000 11.40±1.62 11.31±2.11 0.103 0.869 41.70±3.54 53.51±4.25 25.639 0.000
3 讨论
目前,早期前列腺癌应用腹腔镜下根治术具有创口小、术野清楚、疗效好等优势,已经被广泛认可。但研究指出[8],前列腺癌是一种雄激素依赖或部分依赖性肿瘤,机体雄激素来源于睾丸、肾上腺两个途径,腹腔镜下根治术仅将睾丸源性雄激素阻断,肾上腺源性双氢睾酮仍然产生,占总雄激素的10%~40%,是维持前列腺结构和功能的主要激素,使前列腺癌细胞得以继续生长。因此,腹腔镜下根治术后加以相关药物干预进行辅助治疗具有重要意义,可加快病情缓解。
既往临床常以药物去势作为前列腺癌根治术后的标准治疗方案,以黄体生成素释放激素类似物最为常见,主要通过下调机体黄体生成素释放激素受体而减少黄体生成素,从而降低机体血清睾酮水平。然而,该药物仅对睾丸产生的雄激素产生抑制作用,肾上腺分泌的雄激素不受影响,且治疗初期血清睾酮水平会出现一过性升高,以致疾病恶化。因此,临床开始采用高剂量雄激素进行干预,以作为治疗新方向。目前,临床上最常采用的抗雄激素药物为康士得,其于根治术后患者,能够加快患者康复,且安全性较高。康士得是一种非甾体类抗雄激素药物,其具体作用机制为:竞争性与前列腺细胞核的雄激素受体结合成无活性的复合物,以达到抑制靶组织吸收双氢睾酮的作用,降低体内雄激素水平,同时复合物可使前列腺组织内转化生长因子-β(TGF-β)、C-fos、C-mye基因表达增多,从而阻断雄激素对前列腺癌的刺激,阻碍雄激素依赖前列腺癌细胞的生长并引起其凋亡。因此,康士得能够加强腹腔镜根治术的抗肿瘤作用,病情缓解效果更佳。
本研究结果显示,观察组术后半年、术后1年的完全控尿率均明显高于对照组(P<0.05),说明根治术后加以康士得治疗具有明显的辅助康复作用,与上述研究结果一致。此外,有研究指出[9~10],前列腺癌发生时,前列腺腺管上皮细胞会产生一种具有保护精子活性作用的蛋白,即PSA,由于其在正常人体血液中无法检测,因此其具有特异性,常被作为检测前列腺健康与否的指标。本研究结果显示,治疗后观察组血清f-PSA、t-PSA明显低于对照组,f-PSA/t-PSA明显高于对照组(P<0.05),说明术后加以康士得治疗效果更佳,进一步证明其疗效。综上所述,康士得治疗腹腔镜下根治术后早期老年前列腺癌患者疗效显著,值得在临床推广。
