双峰驼粪便中纤维素分解菌的筛选及酶学特性分析
2019-12-10李国伟吉日木图
何 静 , 李国伟,海 勒 ,吉日木图,
(1.内蒙古农业大学,乳品生物技术与工程教育部重点实验室,呼和浩特 010018;2.内蒙古骆驼研究院,内蒙古阿拉善右旗 737300)
在自然界,纤维素是最丰富的可再生资源,通过对纤维素资源的充分利用,可以有效缓解环境污染、全球能源短缺以及动物饲料资源紧张等问题。目前,自然界中对结构复杂的天然纤维素降解的有效途径是生物降解,主要是借助真菌、细菌和放线菌产生的纤维素酶来进行降解;其中真菌的降解能力最强,木霉菌[1]和曲霉菌[2]产生和分泌的纤维素酶系最全面,效果也最佳。相较于真菌,细菌的降解能力较低,但是细菌具有培养简单、生长速度快和发酵周期短等优势。因此,从自然界中筛选生长速度快、纤维素酶活性高、对培养条件和产酶条件要求适宜的纤维素分解细菌是一项关键科学问题[3-4]。
纤维素酶作为重要的酶制剂,已经在人们生活的各个方面(畜牧业、食品、纺织、环保及化工等)得到广泛应用。从环境中筛选高效降解木质纤维素的菌株则成为重中之重的研究方向。目前研究人员已针对哺乳动物,如猪[5]、马[6]、奶牛[7]、狗[8]和小鼠[9]等开展了不同区段胃肠道微生物多样性的研究,以期能够分离和鉴定出高效降低木质纤维素的菌株。但是针对双峰驼胃肠道微生物的研究十分有限。双峰驼栖息于干旱的荒漠和半荒漠地区,喜食白沙蒿、鳍蓟、沙蓬、梭梭、驼绒藜、白刺等植物。被誉为“沙漠之舟”的双峰驼经过长期的自然选择,形成了独特的生理功能,如解毒、耐饥渴、耐干旱、耐热、耐寒等特性。双峰驼的消化系统与其他反刍动物不同,双峰驼仅有瘤胃、网胃、皱胃3个胃,没有瓣胃[10]。先前的研究表明,与其他草食性动物相比较,饲料颗粒在骆驼胃内的滞留时间会更长[11-12]。 近年来,骆驼肠道微生物的研究得到国内外的广泛关注。2013年,研究人员通过对单峰驼瘤胃微生物基于宏基因组焦磷酸测序,发现从门的水平上,拟杆菌门(Bacteroidetes,占55.5%)、厚壁菌门(Firmicutes,占22.7%)和变形杆菌门(Proteobacteria,9.2%)为主导菌群;分析瘤胃微生物潜在功能后发现,碳水化合物功能是单峰驼瘤胃微生物最丰富的功能类别,并且牛和骆驼具有相似的消化系统,单峰驼瘤胃中微生物的代谢功能与牛的极为相似[13]。2015年,Gharechahi 等[14]通过采集3峰成年雌性单峰驼的瘤胃内容物,基于16S rRNA基因扩增测序探究单峰驼瘤胃中细菌群落的结构特点,发现骆驼瘤胃微生物在结构上与其他反刍动物相似,但在组成上不同。导致骆驼独特瘤胃微生物组成的主要是其瘤胃中纤维素分解细菌的高度富集。2018年,Gharechahi等[15]对骆驼瘤胃内容物进行全宏基因组测序,拟杆菌门含有较高的脱支酶和寡糖降解酶基因,厚壁菌门和纤维杆菌门含有丰富的纤维素酶和半纤维素基因,并且具有极高的多样性。为了分离高效的骆驼源纤维素分解菌株,本研究采用羧甲基纤维素钠(CMC-Na)平板初筛法和摇瓶发酵复筛法,从双峰驼粪便内容物中分离筛选能够高效降解纤维素的细菌,并通过生化指标、16S r RNA序列测定等方法对该菌株进行种属鉴定,同时研究其所产纤维素酶的酶学特性,为开发双峰驼源纤维素降解菌株提供菌种来源与试验依据。
1 材料与方法
1.1 样品采集
在内蒙古自治区巴彦淖尔市乌拉特后旗养殖厂,随机采集10峰3岁成年健康双峰驼(体质量平均约为235 kg)的新鲜粪便,装入 50 mL无菌无酶离心管中,放入于 4 ℃冰袋中带回实验室。
1.2 培养基
CMC-Na培养基[16]:CMC-Na 5.0 g,(NH4)2SO42 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.1 g,琼脂粉 15.0 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
摇瓶发酵液体培养基[16]:普通 LB液体培养基中加入质量分数为1.0%的 羧甲基纤维素(CMC),用于纤维素分解菌的发酵培养。
1.3 方 法
1.3.1 纤维素分解菌的筛选、分离和纯化 称量1 g样品加入100 mL的富集培养基中,180 r/min、30 ℃条件下振荡培养3~4 d。取上述富集培养后的菌悬液稀释10-3~10-6,再从各个稀释样品中取100 μL液体在CMC-Na固体培养基平板上涂布,于 37 ℃恒温培养箱中培养 2~ 3 d[17]。之后采用刚果红染色法对菌株筛选,测量菌落直径(测量结果用d表示)和透明圈直径(测量结果用D表示)。根据透明圈直径和菌落直径的比值(D/d)大小进行菌株产纤维素酶能力的初步判断,比值越大,则产酶能力越强,根据此原则从中选取产酶能力较强的菌株进行后续研究。挑出D/d比值大的菌落纯化培养。纯化后测定D/d比值较大菌株的纤维素酶活力,选取产纤维素酶活力强的菌株用于后续研究[18]。
1.3.2 CMCase酶活力的测定 将菌株接种到液体发酵产酶培养基中, 培养3 d后离心取上清液,作为粗酶液。以葡萄糖作为标准,采用3,5-二硝基水杨酸(DNS) 试剂法测定纤维素酶活力,羧甲基纤维素酶(CMCase)和滤纸酶(FPase)活力以每毫升粗酶液每分钟产生1 μmol葡萄糖所需酶量为1个酶活力单位(IU/mL)[16,18]。每组试验做3次平行。
1.3.3 CMCase的酶学性质研究 酶反应最适pH测定:将粗酶液置于pH 4、5、6、7、8和9的磷酸氢二钠-磷酸二氢钾缓冲液中,50 ℃反应 30 min,取出发酵液体测定CMCase活性,每个样品进行3个重复,确定CMCase反应的最适pH。
酶反应最适温度的确定:将粗酶液分别置于不同温度(40 ℃、50 ℃、60 ℃、70 ℃和80 ℃)发酵30 min,取出发酵液体测定CMCase活力,每个样品设置3个重复,确定CMCase反应的最适温度。
酶的热稳定性测定:将所制备的粗酶液分别在45 ℃、50 ℃、55 ℃、60 ℃、65 ℃和70 ℃水浴保温10~60 min,取出发酵液体在最适温度和pH下测定剩余酶活,每个样品设置3个重复,评价该酶的热稳定性。
1.3.4 菌株鉴定 形态学鉴定:利用光学显微镜,对菌株细胞的微观结构进行观察,取培养 3~5 d 的分离菌菌液进行革兰氏染色,确定细菌的革兰氏属性;并观察菌落形状、大小、颜色、透明度、光泽度、质地、边缘整齐程度、隆起度等。
生理生化鉴定:观察菌落形态、透明度、颜色和边缘等。根据《常见细菌系统鉴定手册》和《伯杰氏系统细菌学手册》[19]中的方法测定分离菌株的生理生化特性。
分子生物学鉴定:提取分离菌株基因组DNA,采用细菌通用引物[20](27F:5′-AG- AGTTTGATCCTGGCTCAG-3′,1492R:5′-GG-TTACCTTGTTACGACTT-3′)扩增菌株的 16S rRNA 基因。PCR 扩增条件:95 ℃预变性 5 min;95 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃延伸1.5 min,共 24个循环;72 ℃ 修复延伸 10 min;4 ℃保存。获得的PCR产物送至美吉生物有限公司进行测序,并进行同源性分析。将该序列提交至NCBI,序列号为MK396502。
1.3.5 分离菌株产酶条件研究 不同pH对菌株产酶活力的影响:改变初始pH分别为4.0、 5.0、6.0、7.0、8.0和9.0,180 r/min震荡培养 3~5 d后,取出液体检测CMCase活力,每个样品设置3个重复,确定菌株液体发酵产酶的最适pH。
不同温度对菌株产酶活力的影响:在pH确定后,改变培养温度,分别调至20 ℃、25 ℃、 30 ℃、35 ℃和40 ℃,180 r/min震荡培养3 d后,取出液体检测CMCase活力,每个样品设置3个重复,确定菌株液体发酵产酶的最适发酵温度。
不同接种量对菌株产酶活力的影响:在pH和温度确定的条件下,改变初始接种量,分别为1%、5%、10%、15%和20%,180 r/min震荡培养3 d后,取出液体检测CMCase活力,每个样品设置3个重复,确定菌株液体发酵产酶的最适接 种量。
连续发酵对菌株产酶活力测定:将筛选出的降纤维素菌在液体发酵培养基进行连续5 d的发酵培养,每个样品设置3个重复,每天取出菌液,检测CMCase酶活力,确定菌株液体发酵产酶的最佳发酵时间。
1.4 数据处理
将获得的DNA序列与NCBI数据库进行Blast比对分析,选取同源性较高的模式菌株进行系统发育分析,借助MEGA 7.0软件分析并构建系统发育树。数据用“平均值±标准差”表示,使用SPSS 22.0软件统计分析,用Excel 2016软件绘图。
2 结果与分析
2.1 纤维素分解菌的分离
为了能够筛选出产纤维素酶活性较高的菌株,经CMC-Na平板初筛,通过刚果红染色从骆驼粪便内容物中筛选出能够降解纤维素的菌株。对透明圈较大的菌株进行纯化,并检测其纤维素酶活力(图1)。AT9-6的CMCase酶活达 (0.48±0.03)IU/mL,FPase为(0.21±0.06)IU/mL,相较于其他菌株,该菌株表现出更强的产纤维素酶的活力(表1)。
2.2 AT9-6菌株粗酶活性
2.2.1 酶反应最适pH及最适温度 pH是影响酶催化效率的条件之一,而温度是影响酶稳定性的重要因素。按照酶活测定方法,计算相对酶活,确定不同pH和温度对纤维素酶活力的影响。由图2可知,CMCase反应最适pH为 6.0;当pH为5.0~9.0时,该菌株的酶活力比较稳定,在pH较高时,该酶仍保持高活力的80%左右,表明该菌株产生的纤维素酶具有耐碱性。当反应温度为50 ℃时相对酶活性最大。当温度在40~60 ℃时,该酶的活力大于80%;当温度大于70 ℃时,该酶的酶活迅速下降,表明该菌株产生的纤维素酶具有一定的耐热性。
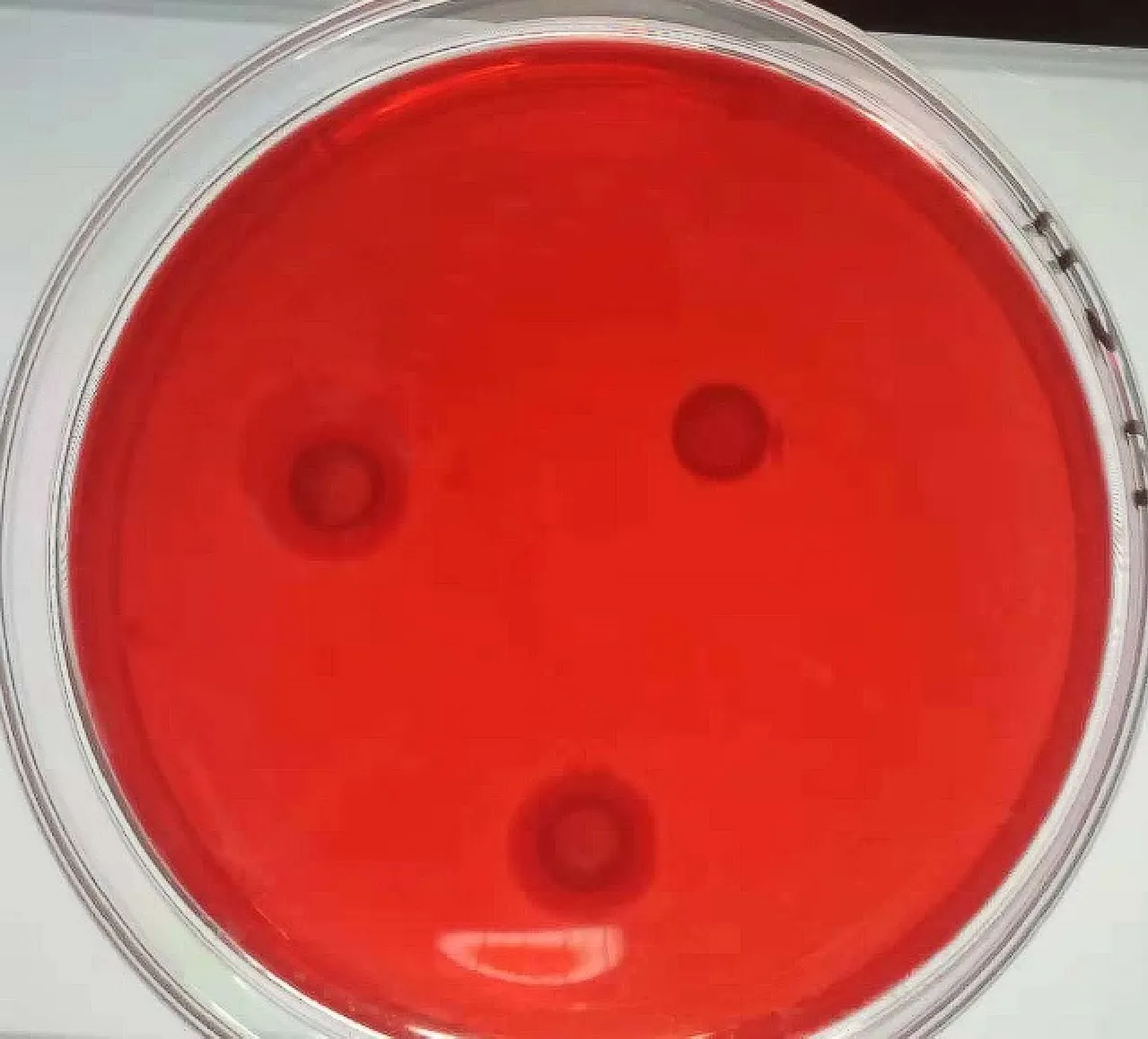
图1 菌株AT9-6在CMC-Na平板上的透明圈Fig.1 Transparent circle of strain AT9-6 on CMC-Na plate
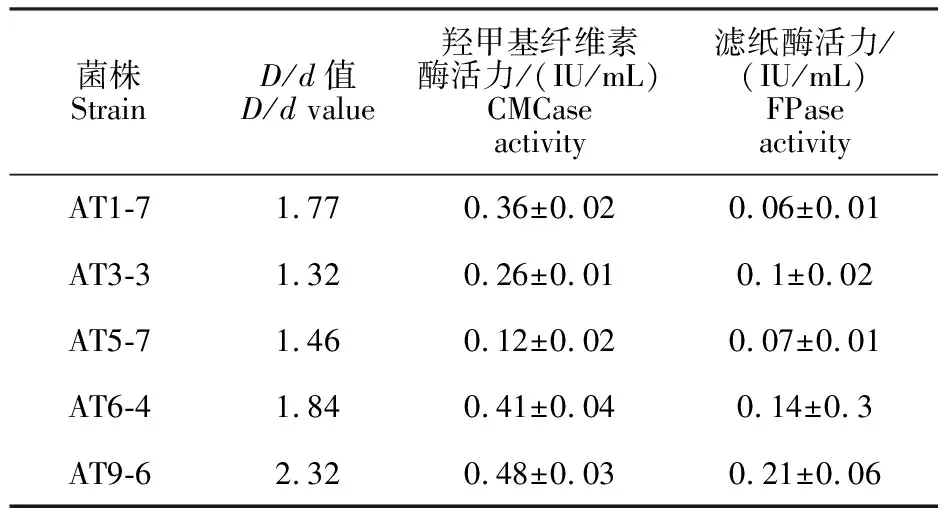
菌株StrainD/d值D/d value羟甲基纤维素酶活力/(IU/mL)CMCase activity滤纸酶活力/(IU/mL)FPase activityAT1-71.770.36±0.020.06±0.01AT3-31.320.26±0.010.1±0.02AT5-71.460.12±0.020.07±0.01AT6-41.840.41±0.040.14±0.3AT9-62.320.48±0.030.21±0.06
2.2.2 酶热稳定性 在45~70 ℃对提取的粗酶液分别处理10~60 min,计算相对酶活,判断该酶的热稳定性。由图3可知,在45 ℃时,分离菌纤维素酶的活性在处理60 min时仍可达85%以上。在50 ℃时,分离菌纤维素酶的稳定性相对较好,水浴60 min后酶活力仍可达65%以上;在 55 ℃保温20 min,该酶相对活性仍可保留在60%以上;当温度达到65 ℃和70 ℃,处理 10 min时,其酶相对活力显著下降,相对酶活力仅为40%左右。说明该菌株产生的纤维素酶在 45~50 ℃热稳定性较好。

图2 不同pH(A)和温度(B)下的酶活力Fig.2 Enzyme activity under different pH(A) and temperature(B)
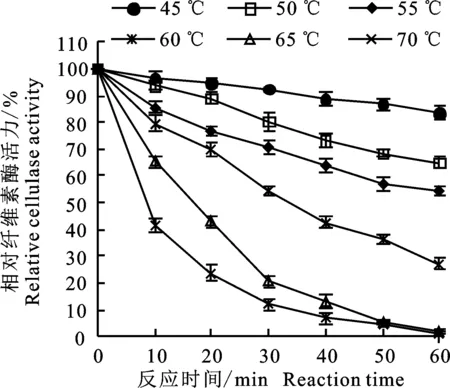
图3 菌株AT9-6 产CMCase的热稳定性Fig.3 Thermal stability of CMCase
2.3 分离菌株鉴定结果
2.3.1 菌株生理生化指标 通过对成年双峰驼的粪便微生物进行筛选,最终得到1 株酶活较高的菌株AT9-6。将该菌株接种在CMC-Na培养基上,在37 ℃培养4 d,由图4可知,该菌株菌落为圆形淡黄色,表面光滑,边缘整齐,革兰氏染色结果为阳性,菌体杆状。由表2可知,该菌株能够利用葡萄糖。氧化酶和接触酶反应为阳性,可以利用明胶,能利用各种碳水化合物为碳源,并且能够使硝酸盐还原。根据菌株AT9-6的形态学特性及生理生化特性鉴定结果,初步确定该菌株属于纤维单胞菌属。
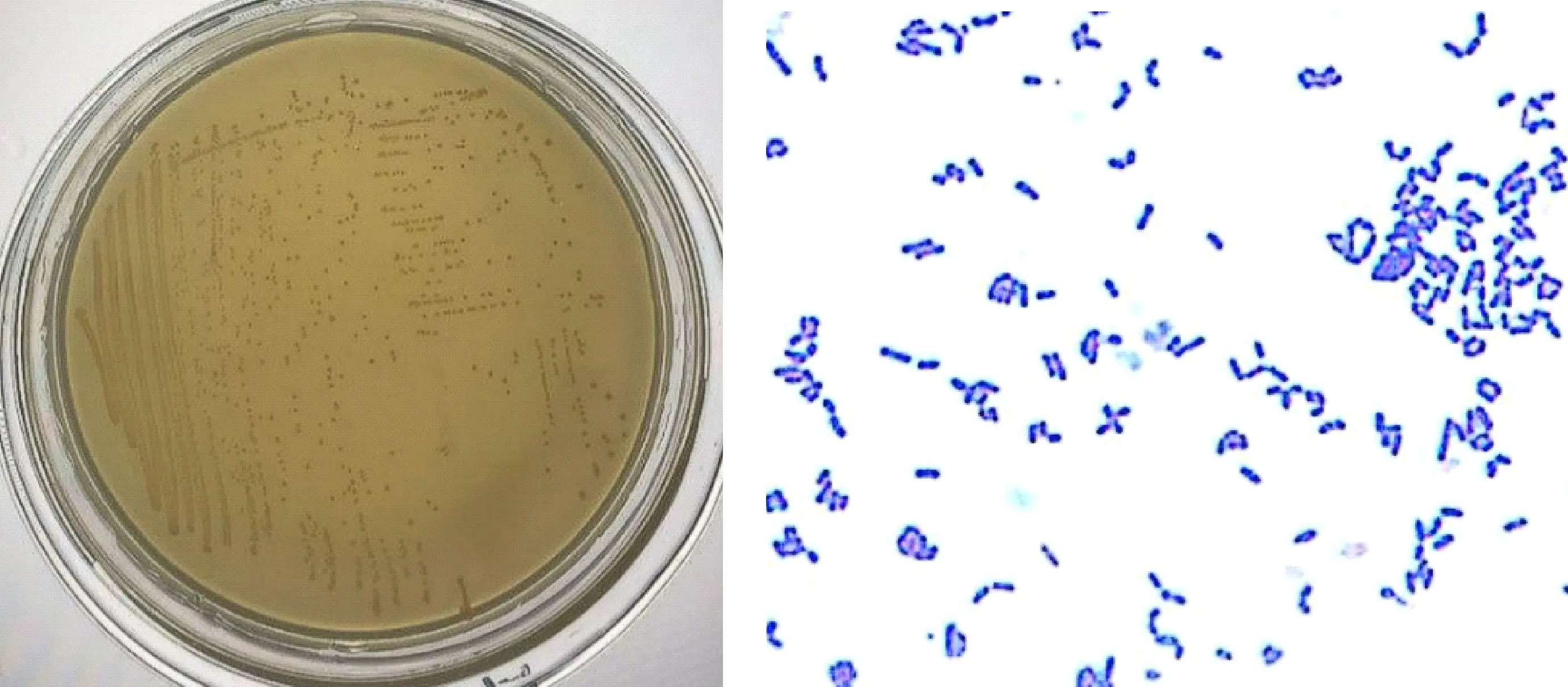
图4 菌株AT9-6菌落形态及革兰氏染色(10×100)Fig.4 Colony morphology and gram staining of the strain AT9-6
2.3.2 菌株分子生物学 测序结果显示,该纤维素分解菌AT9-6的16S rRNA基因序列长度为1 255 bp左右。序列同源性分析显示,菌株AT9-6与纤维单胞菌属细菌的16S rRNA序列相似性达99%以上。系统进化树分析显示,该菌株与C.cellulansstrain亲缘关系最近(图5)。综合该菌株的菌落形态、生理生化特性和分子生物学鉴定结果,确定获得的纤维素分解菌AT9-6为纤维化纤维微菌。

表2 菌株AT9-6生理生化特性Table 2 Physiological-biochemical characteristic of AT9-6
注: + : 阳性; - : 阴性。
Note: +,Positive; -,Negative.
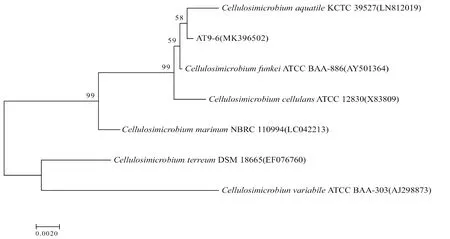
图5 基于16S rRNA的纤维素分解菌系统发育树Fig.5 Phylogenetic denfrogram of 16S rRNA gene sequence
2.4 菌株AT9-6产CMCase的初步优化
2.4.1 不同pH对菌株AT9-6产CMCase的影响 不同菌株发酵培养要求的起始pH不同;初始pH过高或过低都会抑制菌株的生长,从而导致该菌株的产酶能力迅速下降。适当pH有利于菌株生长和菌株产酶;一旦pH过低或过高会直接抑制菌株生长,从而抑制酶的产生。本研究设置不同的起始pH,以确定pH对菌株AT9-6产CMCase的影响。结果如图6所示,随着pH的逐渐升高,其产酶活性也逐渐升高。在pH 4.0时,产酶活力最低,仅为0.37 IU/mL;在pH 6.0~8.0,该菌的产酶效果较好,在pH 7.0时产酶效果最好,酶活力可达0.54 IU/mL。当pH继续增加时,该菌株的产酶能力逐渐下降。故最适AT9-6菌株产酶的最佳pH为7.0。
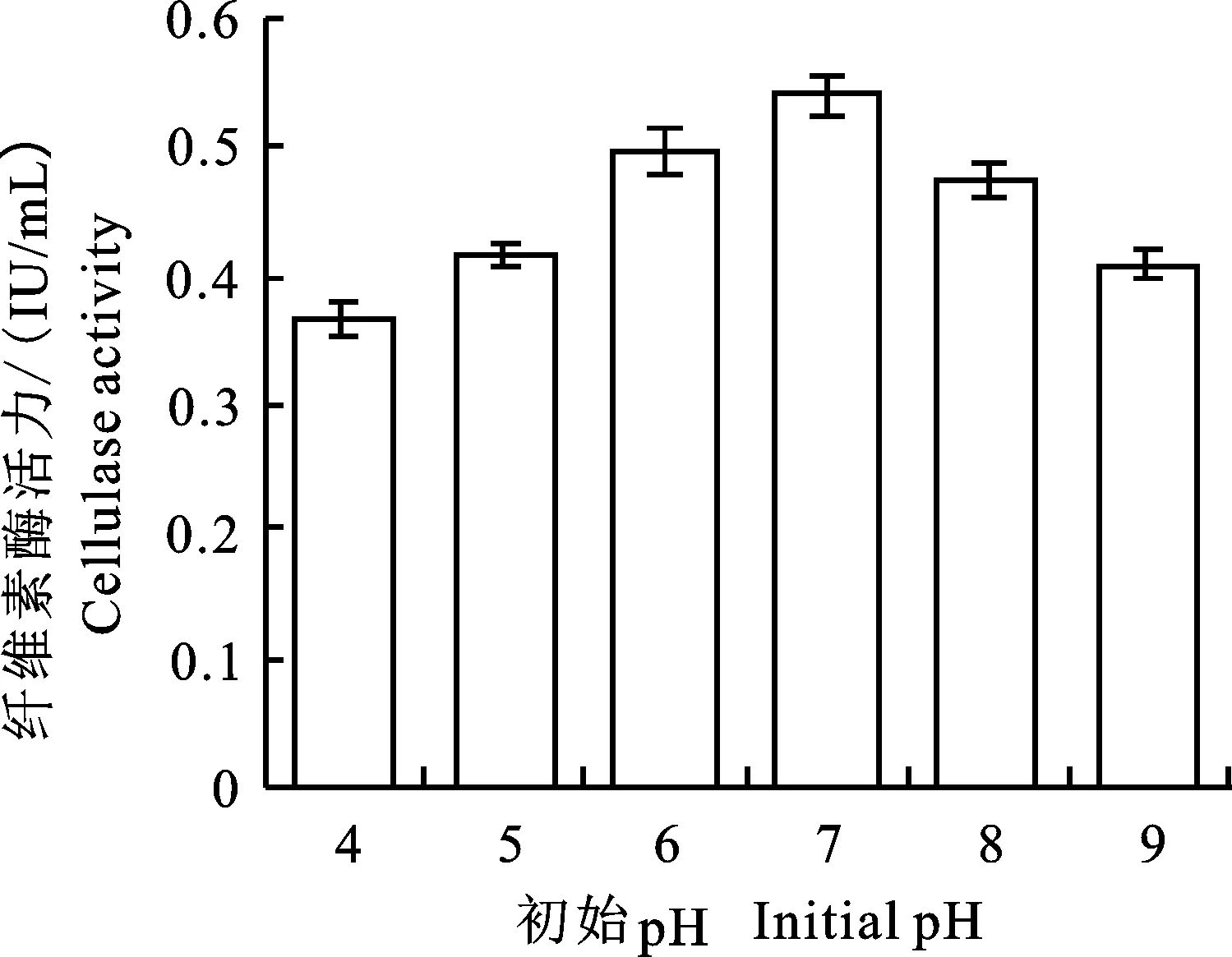
图6 不同初始pH下AT9-6产酶的结果Fig.6 Result of different pH on cellulase production of AT9-6
2.4.2 不同温度对菌株AT9-6产CMCase的影响 培养温度直接影响菌株产酶的活力和酶的稳定性。由图7可知,随着温度的升高,菌株产酶活力先增大后降低。在20 ℃,酶活力最低,酶活仅为0.24 IU/mL;在30 ℃时,菌株发酵产纤维素酶能力最强,酶活力可达0.62 IU/mL。说明培养温度对菌株发酵产酶存在一定的影响,较低温度和较高温度都不利于产酶。当温度较低时,菌株生长缓慢,导致酶活力偏低。温度过高可能会造成菌株的过早老化,酶分泌量减少。因此,初步确定在30 ℃条件下,CMC酶活最大。
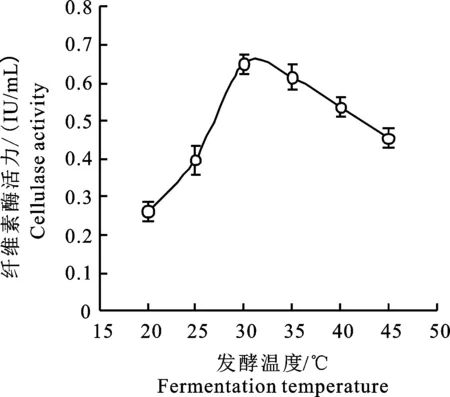
图7 不同温度下AT9-6产酶的结果Fig.7 Result of different temperature on cellulase production of AT9-6
2.4.3 不同接种量对菌株AT9-6产CMCase的影响 在发酵过程中,适宜的接种量能够使细菌发挥最佳的产酶能力。接种量的多少直接影响菌株的产酶能力,接种量过小会使细菌延迟进入对数期,使产酶的时间推迟;接种量过大会使细菌提前进入对数期,使产酶时间过早。如图8所示,菌液的接种量会明显影响酶活力。当接种量为10%时,CMC酶活力最高为0.66 IU/mL;当接种量增加到20%时,酶活显著下降,达到最低 0.36 IU/mL。故最适AT9-6菌株产酶的最佳接种量为10%。
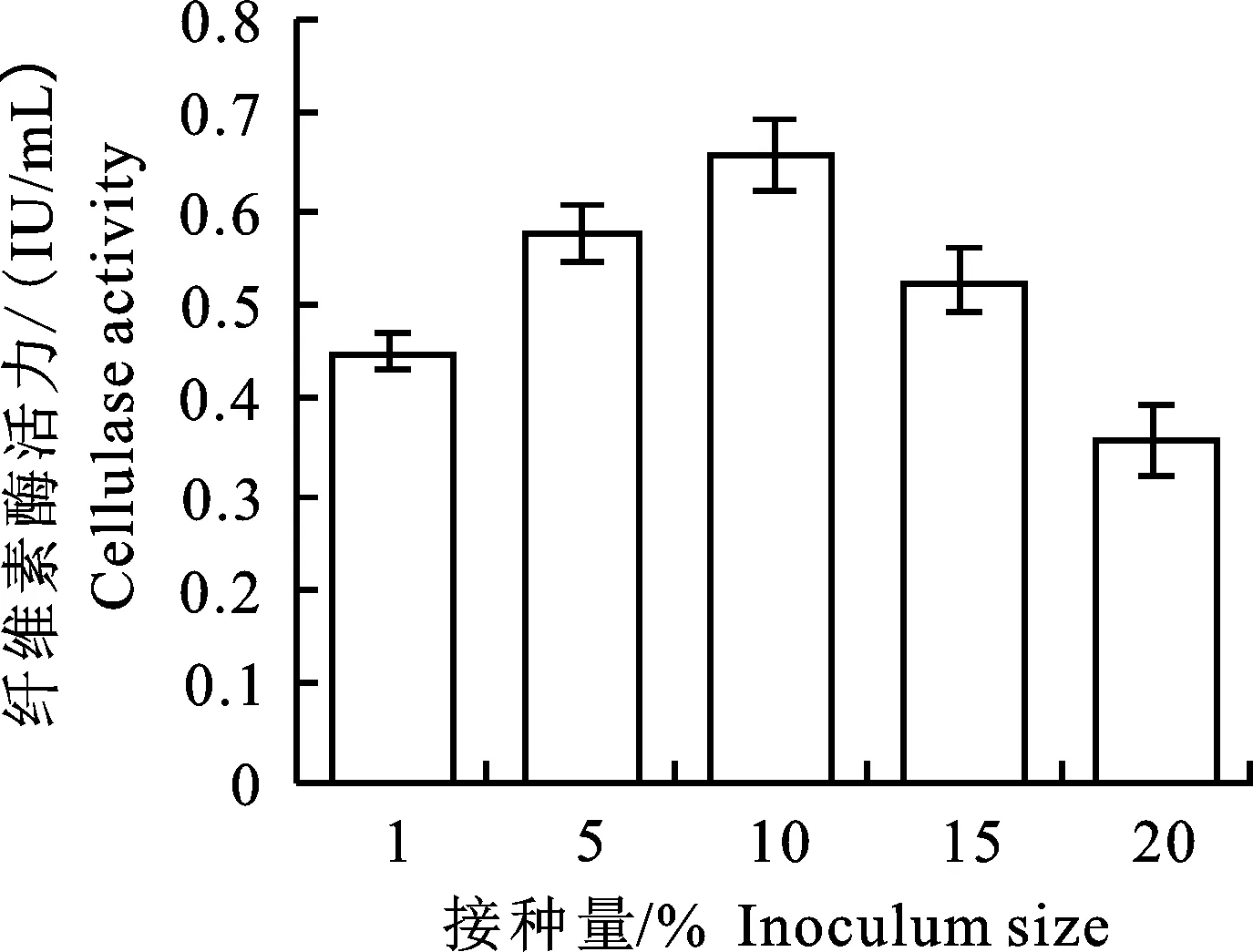
图8 不同接种量下AT9-6产酶的结果Fig.8 Result of different inoculum volume on cellulase production of AT9-6
2.4.4 不同发酵时间对菌株AT9-6产CMCase的影响 在上述最佳的发酵条件下,对菌株AT9-6进行连续5 d的发酵产酶,每隔24 h取样1次,测定CMCase活性。由图9可知,该菌株在发酵24~72 h酶活性呈增长趋势,在发酵培养 72 h时,产酶活性达到最强,可达0.66 IU/mL。随着发酵培养时间延长,活力逐渐降低。分析原因可能是在72 h时该菌株适应发酵培养基后开始大量产纤维素酶;在96 h后,受培养基成分和菌株老化的影响,菌株产酶能力下降,酶活力仅有0.46 IU/mL。故最适AT9-6菌株产酶的发酵培养的时间为72 h。
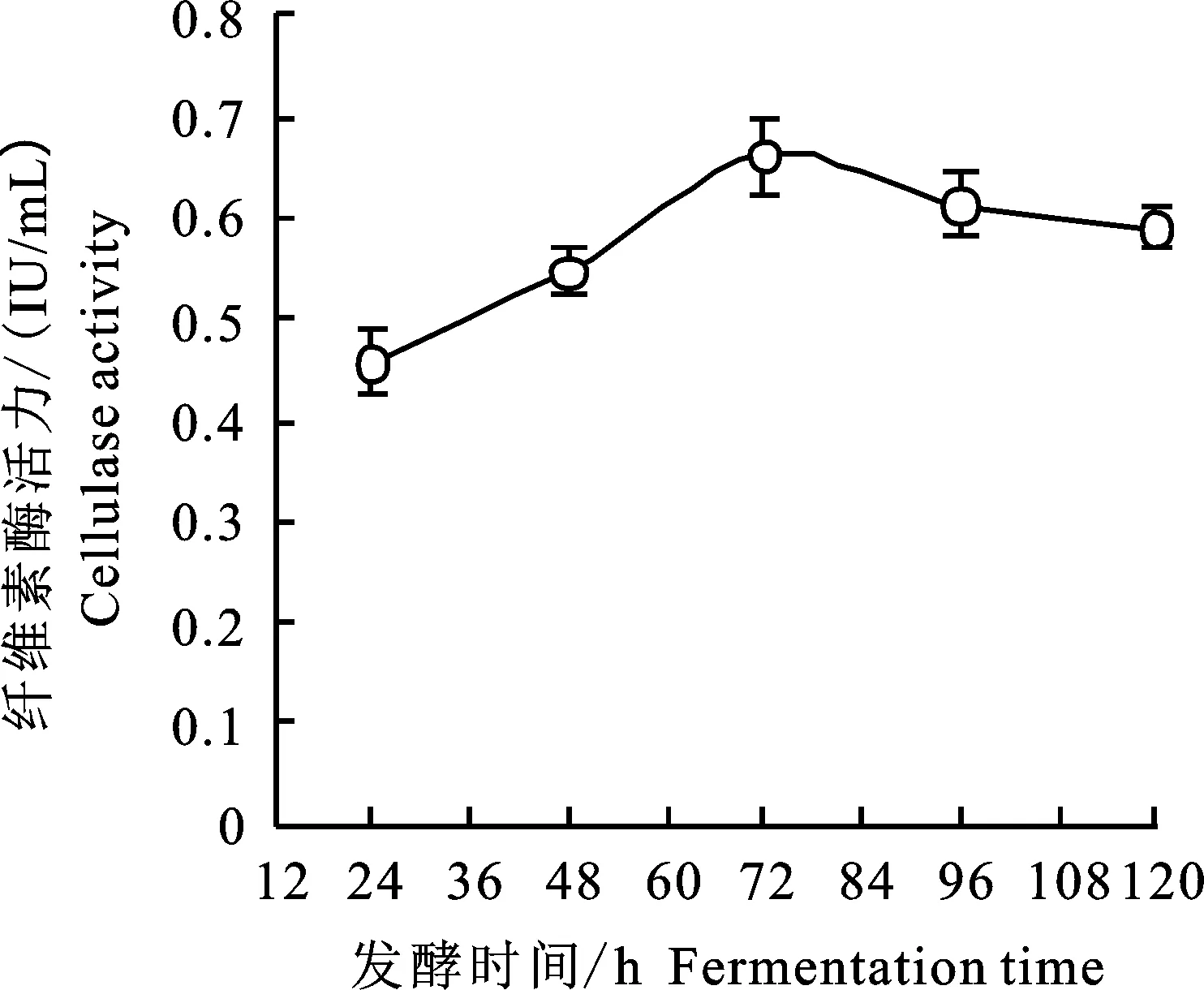
图9 发酵培养时间下AT9-6产酶的结果Fig.9 Result of different fermentation time on cellulase production of AT9-6
3 讨论与结论
纤维素作为自然界中广泛存在、含量最多的一种多糖,是微生物重要的碳源之一。纤维素是植物重要的组成部分,几乎占总干质量的50%[21],通过对纤维素资源的充分利用,可以有效缓解污染、全球能源短缺等问题。但是,目前绝大部分的纤维素都不能被有效利用。据报道,有效分解纤维素不仅可以使自然界的纤维素资源转化为所需要的能源,更能减少动物饲料中的粗纤维含量,促进动物的消化吸收[22]。目前降解纤维素的主要方法有微生物降解、化学降解、物理降解等[23]。大量的研究证实,生物降解纤维素是一种有效降解纤维的手段,该方法主要是利用纤维素分解菌及其所产生的酶来降解纤维素[24]。目前该方法被广泛应用于不同草食性动物胃肠道内容物的筛选中,如大熊猫[25]、藏猪[26]、牛[27]等。骆驼具有独特的微生物特性,Gharechahi等[15]对骆驼瘤胃内容物进行全宏基因组测序,确定了有助于木质纤维素降解和发酵过程产生挥发性脂肪酸的关键物种。但是从双峰驼胃肠道中分离分解纤维素细菌的研究仍然鲜见。本研究以骆驼粪便为研究对象,分离筛选具有高效降解纤维的细菌。
研究证实,以CMC为唯一碳源的选择培养基,基于刚果红染色法初步分离筛选纤维素分解菌,简单快捷、成本低,被认为是筛选纤维素分解菌最有效方法之一[28]。目前,已有许多研究人员从动物的胃肠道、粪便、土壤中分离出能够降解纤维素的细菌,如芽孢杆菌属[26]、瘤胃球菌属[29]、拟杆菌属[30]、假单胞杆属[31]、梭菌属[32]等。为了筛选骆驼源的纤维素分解菌株,本试验采用 CMC-Na 平板初筛法和摇瓶发酵复筛法,从双峰驼粪便内容物中分离筛选能够高效降解纤维素的细菌,并对其中1株透明圈较大的菌株进行纯化后检测其纤维素酶活力和菌株鉴定,初步鉴定该菌株为纤维化纤维微菌的一种,属纤维单胞菌属,放线菌门。
纤维单胞菌属由纤维化纤维微细菌(C.cellulans),芬氏纤维微菌(C.funkei和C.terreum)3 个种组成。这些物种属于需氧放线菌,表现为多形性革兰氏阳性杆菌,自然存在于土壤、水和腐烂的木材中,也有部分菌株来自于海洋、昆虫体表和人类肠道中[33]。此次筛选的菌株C.cellulans,属纤维单胞菌属,纤维单胞菌属作为丰富糖苷酶的来源被人们广泛关注。纤维微菌属蕴含许多糖苷酶,如内-β-1,4-葡聚糖酶、内-β-1,4-木聚糖酶、内-β-1,4-甘露聚糖酶和内-β-1,3-葡聚糖酶。2012年,研究人员从云南红豆杉的根土中分离出能分泌7-木糖紫杉烷糖基水解酶C.cellulansstrain F16[34]。能够分泌纤维素酶的C.cellulans已从各种不同的环境中被分离筛选出来。此外,Wei等[35]研究报道,C.cellulansL804为一种木质纤维素降解菌,可将未经处理的玉米秸秆转化为微生物絮凝剂,该菌株分泌纤维素分解酶活性的最佳pH为5.2~6.0。但从动物胃肠道中分离获得C.cellulans的报道相对较少。本次研究获得的菌株C.cellulans可以分泌纤维素酶,它在双峰驼源纤维素降解菌株上具有一定的应用 潜力。
在微生物生长过程中,菌体的培养条件对其生长和代谢产物的积累都有重要影响。菌株的发酵条件,如碳源、氮源、温度、pH和接种量等诸多因素对纤维素酶的产生具有显著的影响。对于好氧性微生物,菌株的接种量会影响发酵培养基的溶氧量,溶氧量不足直接会影响菌株的繁殖和代谢产物的产生[36]。此外,温度、pH和发酵时间都会影响菌株产纤维素酶的活力。据报道,真菌纤维素酶一般为酸性酶,在pH 4~5、温度40 ℃~60 ℃活性较高。细菌纤维素酶的最适pH通常在中性或偏碱性,其最适温度为40 ℃~70 ℃。本次研究的纤维素酶最适温度为40 ℃,最适pH为6,该结果与栗丛瑞[37]的研究结果相似。此外,研究证实纤维单胞菌最适生长温度为20 ℃~ 37 ℃,最适pH为6.0~8.0[38],本研究结果与报道一致。总之,本研究筛选并鉴定出一株纤维化纤维微菌,它具有相对较高的纤维素酶活。该菌株所产生的酶具有一定的耐碱性和耐热性,因此可将该酶应用于食品行业或废料处理等方面。
综上所述,本研究从双峰驼粪便样本中分离到1 株纤维素分解菌。根据该菌的菌落形态、生理生化和分子生物学鉴定结果,确定该菌为C.cellulans。该菌株产纤维素酶的最适温度为 40 ℃~50 ℃,最适pH为6.0。该菌株所产生的酶具有一定的耐碱性和耐热性。初步确定该菌株液体发酵的最佳接种量为10%,最适初始pH为 7.0,最适培养温度为30 ℃,最适发酵时间为 72 h。
