双氢青蒿素和吉非替尼联用对肺癌NCI-H1975细胞凋亡相关蛋白Bax与Bcl-2表达的影响
2019-12-10金红杨岚张黎莫迪李梦雨武艳季洪良姜爱英
金红 杨岚 张黎 莫迪 李梦雨 武艳 季洪良 姜爱英
(牡丹江医学院附属红旗医院 1检验科,黑龙江 牡丹江 157011;2眼科;3科研科;牡丹江医学院 4第一临床医学院;5医药研究中心;6牡丹江医学院附属红旗医院呼吸科)
目前肺癌已成为我国位居第一的癌症杀手,也是男性居首位的癌症死亡原因,女性第二位的癌症死亡原因〔1,2〕。吉非替尼作为非小细胞肺癌治疗的一线药物,被广泛应用于临床,但由于耐药导致治疗受限,因此开发多靶点的靶向治疗药物来增强吉非替尼作用敏感性是目前研究的热点。研究发现双氢青蒿素(DHA)具有抗肿瘤活性〔2〕,本研究旨在探讨DHA和吉非替尼联用对肺癌NCI-H1975细胞凋亡相关蛋白Bax与Bcl-2表达的影响。
1 资料与方法
1.1一般材料 人肺腺癌NCI-H1975细胞株购自中科院,10%胎牛血清和CCK8检测试剂盒购自中国海门碧云天生物技术研究所,Bcl-2 抗体、Bax抗体购自美国Abcam,吉非替尼和DHA购自上海阿拉丁生化科技股份有限公司。
1.2药物处理 DHA以二甲基亚砜(DMSO)配制成浓度为1×10-1mol/L储存液(DMSO浓度≤1‰),-20℃避光保存。吉非替尼10 mg,置100 ml量瓶中,用DMSO溶解并稀释浓度为100 μg/ml,-4℃保存。
1.3实验分组 对照组、吉非替尼组、DHA组、DHA+吉非替尼联合用药(联合)组。
1.4细胞培养与接种 NCI-H1975细胞复苏后,待细胞生长到一定数量后,0.25% 胰酶消化,用含10%血清的DMEM培养基重悬细胞。计数以后调整细胞浓度为5×105个/ml,按每孔0.1 ml接种于96孔板上,37℃、5%CO2条件进行培养。
1.5用CCK8法检测细胞增殖 取生长状态良好的对数生长期细胞,0.25%胰蛋白酶消化,计数,将细胞以密度为5×105个/ml接种于96孔培养板中,然后加入含10%胎牛血清的RPMI1640培养液,在37℃培养箱中培养24 h,待细胞贴壁生长并达80%时,完全培养基稀释吉非替尼和DHA分别至5个不同浓度,交叉组合作用24 h,向每孔加入20 μl CCK8溶液,将培养板在培养箱内继续孵育1~4 h,在420 nm波长下用酶标仪测定每个样本的吸光度(OD)值,每个样品重复做3次。细胞存活率=OD用药组/OD对照组×100%。对DHA与吉非替尼单独和联合给药的原始数据按照联合指数(CI)法进行分析,采用CalcuSyn软件计算联合用药的CI。
1.6TUNEL染色法检测细胞凋亡 细胞用4%多聚甲醛在室温下固定30~60 min,磷酸盐缓冲液(PBS)洗涤3次,用含0.1% Triton X-100的枸橼酸钠缓冲液浸透,冰浴孵育2 min,PBS洗涤2次,加入50 μl原位凋亡检测试剂盒的TUNEL检测液,细胞核用4,6-二脒基-2-苯基吲哚(DAPI)染色,于37℃下避光孵育60 min,PBS洗涤3次,用抗荧光淬灭封片液封片后在荧光显微镜下观察,激发光波长450~500 nm,发射波长515~565 nm(绿色荧光),荧光显微镜下计数细胞总数和TUNEL阳性细胞数,并计算细胞凋亡率(凋亡阳性细胞数/细胞总数)。
1.7流式细胞仪检测细胞周期 NCI-H1975细胞被接种于6孔板上,用DHA和(或)吉非替尼药物作用于细胞,37℃孵育24 h。细胞用PBS洗涤2~3次后,用70%乙醇固定后在4℃过夜,最后,细胞在室温下用80 mg/ml胰核糖核酸酶处理,转移至试管中,加入50 mg/ml碘化丙啶(PI)染色液,室温避光染色30 min,加入缓冲液,将全部液体转移至流式管中,然后用流式细胞仪分析细胞DNA含量。测定DNA含量后,可用流式细胞仪配备的分析软件Coulter®Epics®XLTMFlow Cytometer对其进行自动分析,测定的细胞周期按照DNA量分为G0/G1期、S期及G2/M期,并统计细胞周期各个时相所占比例。
1.8蛋白印迹法检测凋亡相关蛋白表达水平 将药物处理后的细胞收集加入裂解液,各组提取的总蛋白样品30~90 μg在10%~15%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)分离,将蛋白质从凝胶转印到硝酸纤维素膜,加入封闭液(5%脱脂奶粉),浸泡被转印膜,室温反应1 h,封闭转印膜上的一些非特异性蛋白质的潜在结合位点,防止发生非特异性反应;转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹;然后用第一抗体在4℃孵育过夜(抗Bcl-2抗体、抗Bax抗体抗β-actin抗体),弃一抗,用0.01 mol/L包含0.5% Tween 20的PBS分别洗膜,10 min×3次,振荡;加入荧光标记的二抗溶液,室温下反应1 h,保持平缓摇动;弃二抗,用0.01 mol/L PBS洗膜,10 min×4次,振荡。电化学发光(ECL)显色:将膜浸于ECL发光液中,避光显色3 min,将膜用滤纸吸干,以β-actin作为内参对照,用Tanon 5200全自动化学发光图像分析系统进行扫描,分析目标条带的灰度值。
1.9统计学分析 使用SPSS16.0统计软件进行t检验、方差分析、χ2及Fisher检验。
2 结 果
2.1DHA和吉非替尼对NCI-H1975细胞联合用药的药物浓度确定 0、5、10、20、50、100 μmol/L DHA作用于NCI-H1975细胞OD值分别为:2.81±0.54、2.54±0.36、2.34±0.41、1.87±0.21、0.89±0.04、0.32±0.02;0.0、2.5、5.0、10.0、15.0、20.0 μmol/L吉非替尼作用于NCI-H1975细胞OD值分别为:3.01±0.51、2.89±0.42、2.49±0.28、2.02±0.14、1.54±0.08、0.31±0.05。DHA和吉非替尼单独用药均对人肺腺癌NCI-H1975细胞增殖有明显抑制作用,并呈剂量-反应关系DHA(10 μmol/L)+吉非替尼(10 μmol/L)组OD值 (1.18±0.21)显著低于对照组(2.81±0.78)、吉非替尼组(2.01±0.45)及DHA(5 μmol/L)+吉非替尼(5 μmol/L)组(1.98±0.51)。DHA(10 μmol/L)与吉非替尼(10 μmol/L)联合应用于NCI-H1975细胞的CI值为0.64,说明二者联合为协同效应。因此,采用10 μmol/L DHA作为联合吉非替尼的药物浓度作为后续实验药物浓度。见表1。
2.2DHA与吉非替尼联合用药对NCI-H1975细胞增殖的抑制作用 与对照组(2.81±0.78)比较,吉非替尼组(1.98±0.51)对NCI-H1975细胞增殖有明显抑制作用,差异具有统计学意义(P<0.01);联合用药组(1.18±0.21)能增强对NCI-H1975细胞的抑制作用,且与吉非替尼组相比差异有统计学意义(P<0.01)。
2.3各组NCI-H1975细胞凋亡比较 对照组细胞核呈圆形,DAPI染色均匀,而吉非替尼组和联合组细胞核不规则,染色不均匀及片段化。DHA组细胞凋亡率为(2.98±0.09)%。与对照组〔(2.15±0.12)%〕比较,吉非替尼组〔(20.15±3.21)%〕能明显增加NCI-H1975细胞凋亡率(P<0.01);与吉非替尼组相比,联合组〔(35.41±5.23)%〕能明显增加NCI-H1975细胞凋亡率(P<0.05)。见图1。

表1 DHA与吉非替尼联合应用对NCI-H1975细胞作用的CI值

图1 各组NCI-H1975细胞凋亡结果(×100)
2.4各组NCI-H1975细胞周期分布比较 吉非替尼组和联合组G0/G1期、G2/M期细胞所占比例差异有统计学意义(P<0.05);各组S期细胞所占比例差异无统计学意义(P>0.05);见图2,表2。
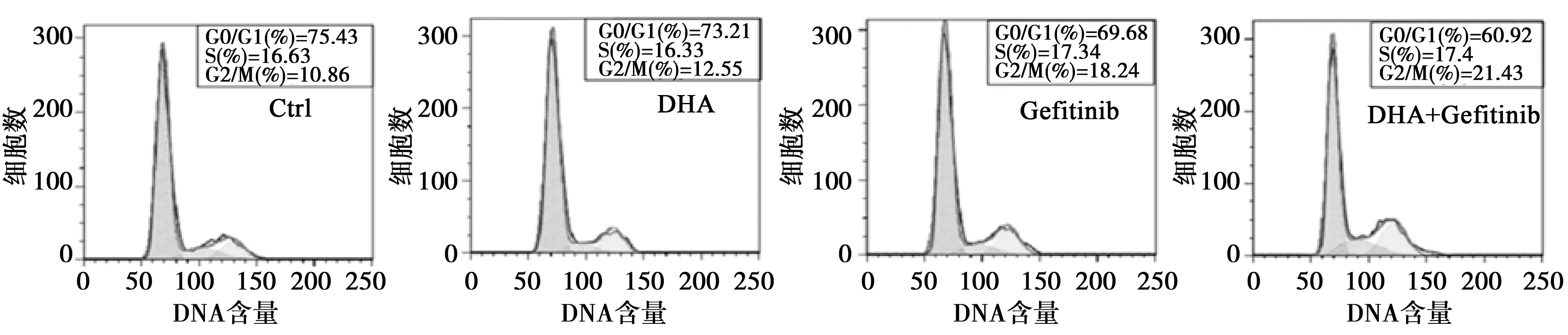
图2 DHA与吉非替尼对NCI-H1975细胞周期分布的影响

表2 各组NCI-H1975细胞周期分布比较
与对照组比较:1)P<0.01;与吉非替尼组比较:2)P<0.05;表3同
2.5DHA和吉非替尼对NCI-H1975细胞凋亡相关蛋白(Bax和Bcl-2)表达水平的影响 与吉非替尼单独用药组比较,联合用药组中Bax蛋白的表达水平显著升高,差异有统计学意义(P<0.01);Bax/Bcl-2的比值明显升高,有显著性统计学差异(P<0.05)。见图3、表3。

1~4:对照组、DHA组、吉非替尼组、联合组图3 各组Bax 和 Bcl-2蛋白表达水平比较

表3 各组凋亡率及Bax、Bcl-2蛋白表达水平比较
3 讨 论
肺癌是我国发病率和死亡率较高的恶性肿瘤,非小细胞肺癌是引起癌症死亡的主要原因之一〔3〕。临床上通过化疗药物之间的联合作用来提高单药作用的敏感性已成为治疗癌症的新策略,也将成为未来治疗癌症的发展趋势。目前将吉非替尼与放疗联合或与其他化疗药物联合治疗肺癌,以期提高吉非替尼药物的疗效,寻求克服吉非替尼的耐药性的研究还较少。DHA是青蒿素成分中有效的代谢物,是一种被广泛用于抗疟疾的治疗药剂〔4~6〕,已有研究发现DHA在多种肿瘤细胞中均具有抗癌作用,能减少肿瘤细胞增殖、促进肿瘤细胞凋亡〔7~9〕,同时对正常细胞具有较低毒性而成为一种新型的抗肿瘤药物。有研究报道其他化疗药物与吉非替尼联合应用能增强吉非替尼的敏感性,使药效增强〔10,11〕。薛斌〔12〕研究发现,一定浓度的DHA能够对瘢痕疙瘩成纤维细胞凋亡起促进作用,促进凋亡的作用与Bcl-2和survivin下调有关,最终通过含半胱氨酸的天冬氨酸水解酶(caspase)-9和caspase-3的活化而实现。
在恶性肿瘤发展过程中,不仅是细胞增殖失控和分化异常的结果,且与凋亡的抑制密切相关。存在于恶性肿瘤中的自发凋亡可能是引起肿瘤消退的一种自身治疗肿瘤的作用。细胞凋亡可以被肿瘤的放疗、化疗和生物治疗等各种刺激所诱导,是机体对各种刺激起到的一种自身保护和调节作用。肿瘤是细胞增殖和死亡异常引起的疾病,细胞凋亡对维持正常生理功能起到重要作用,随着对肿瘤细胞凋亡机制的不断深入研究发现,细胞凋亡过程受基因调控,Bcl-2家族蛋白是细胞凋亡中起重要作用的一类蛋白质〔12〕。Bcl-2 蛋白是Bcl-2家族中最具有代表性的抑制凋亡基因,通过抑制蛋白酶的激活所需的适配器促进细胞生存,Bcl-2的升高可以提高各种类型的细胞生存和促进癌症进展,且Bax蛋白对Bcl-2蛋白活性具有调控作用,是Bcl-2家族中最具代表性的促进凋亡的基因,肿瘤的放疗、化疗及生物治疗作用主要通过Bax和Bcl-2对肿瘤细胞凋亡的调控作用〔13〕,二者形成了细胞凋亡的正负调控,二者比例决定了细胞是否凋亡,比例增高抑制细胞凋亡,比例降低则促进细胞凋亡。本实验结果证实,相较于吉非替尼单独用药,DHA与吉非替尼联合用药能增强诱导NCI-H1975细胞凋亡作用;能更明显地上调NCI-H1975细胞的Bax蛋白表达水平,使NCI-H1975细胞Bax/Bcl-2比值升高。
本研究首次研究DHA增强人肺腺癌细胞对吉非替尼的敏感性,但其中的作用机制是一个复杂、多因素、多层次、多条信号通路共同参与的相互作用的抗癌过程,其研究仍处于基础阶段。
