2009—2014年国产中药批准情况分析
2019-12-09吴宁李俊采顾文涛伍福华
吴宁 李俊采 顾文涛 伍福华


[摘要] 目的 为了解国产中药批准情况及发展趋势提供参考。方法 对2009—2014年间国家食品药品监督管理局批准注册的12 297条中药数据记录进行统计分析。结果 2010年国产中药批准数量激增,2011年中药批准数量出现回落,2012年后,中药批准数量稳步上升,逐渐趋于平稳。不同地区间中药获批数量存在明显差异。批准的国产中药仍以传统剂型为主。结论 药品年批准数量逐渐趋于稳定,地区间药品获批数量不均衡,中药新兴剂型注册有待增加。
[关键词] 国产中药;批准情况;国家食品药品监督管理局
[中图分类号] R954 [文献标识码] A [文章编号] 1672-5654(2019)09(c)-0186-06
[Abstract] Objective To provide reference for understanding the approval status and development trend of domestic Chinese medicine. Methods A statistical analysis was carried out on 12 297 Chinese medicine data records approved by the State Food and Drug Administration during 2009-2014. Results In 2010, the number of approved Chinese medicines surged. In 2011, the number of Chinese medicines approved declined. After 2012, the number of Chinese medicines approved increased steadily and gradually stabilized. There are significant differences in the number of approved Chinese medicines in different regions. The approved domestic Chinese medicines are still based on traditional dosage forms. Conclusion The number of drug approvals has gradually stabilized, the number of approved drugs in different regions has been uneven, and the registration of new drug formulations has yet to be increased.
[Key words] Domestic Chinese medicine; Approval situation; State Food and Drug Administration
中药是中华传统文化的重要组成部分,是我国独特的卫生资源、潜力巨大的经济资源,具有原创优势的科技资源、优秀的文化资源和重要的生态资源,在经济社会发展中发挥了重要作用[1]。药品注册,是国家食品药品监督管理局(CFDA)依照《药品管理法》规定,根据药品注册申请人申请,对已上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程[2]。自2007年实施修订《药品注册管理办法》起,CFDA在数年内连续颁布了《中药注册管理补充规定》《关于加强中药生产中提取和提取物监督管理的通知 (2014-07-29)》《关于进一步加强中药材管理的通知 (2013-10-09)》《关于印发已上市中药变更研究技术指导原则(一)的通知(2011-11-16)》《关于做好药品再注册审查审批工作的通知(2009-07-31)》《关于印发中药品件保护指导原则的通知(2009-02-03)》等一系列文件。这些通知办法的颁布实施,从法制、机制和技术方面完善了中药注册管理工作,整合了中药注册管理资源,规范了中药注册审批程序,从而以求提升中药安全质量水平,深刻地影响后续药品的研发与注册批准。该文通过对CFDA 2009—2014年批准的国产中药数据记录进行统计分析,以期为了解国产中药批准情况及发展趋势提供参考,报道如下。
1 资料与方法
资料来源于國家食品药品监督管理局官方网站国产药品批准数据记录,共检索2009—2014年间12 297条国产中药批准情况的数据记录。采用Microsoft Excel 2013软件建立数据库,SPSS 20.0统计学软件进行统计分析。采用描述性分析方法,对计数资料用频数与构成比表示。
2 结果
2.1 国产中药批准情况年度分布
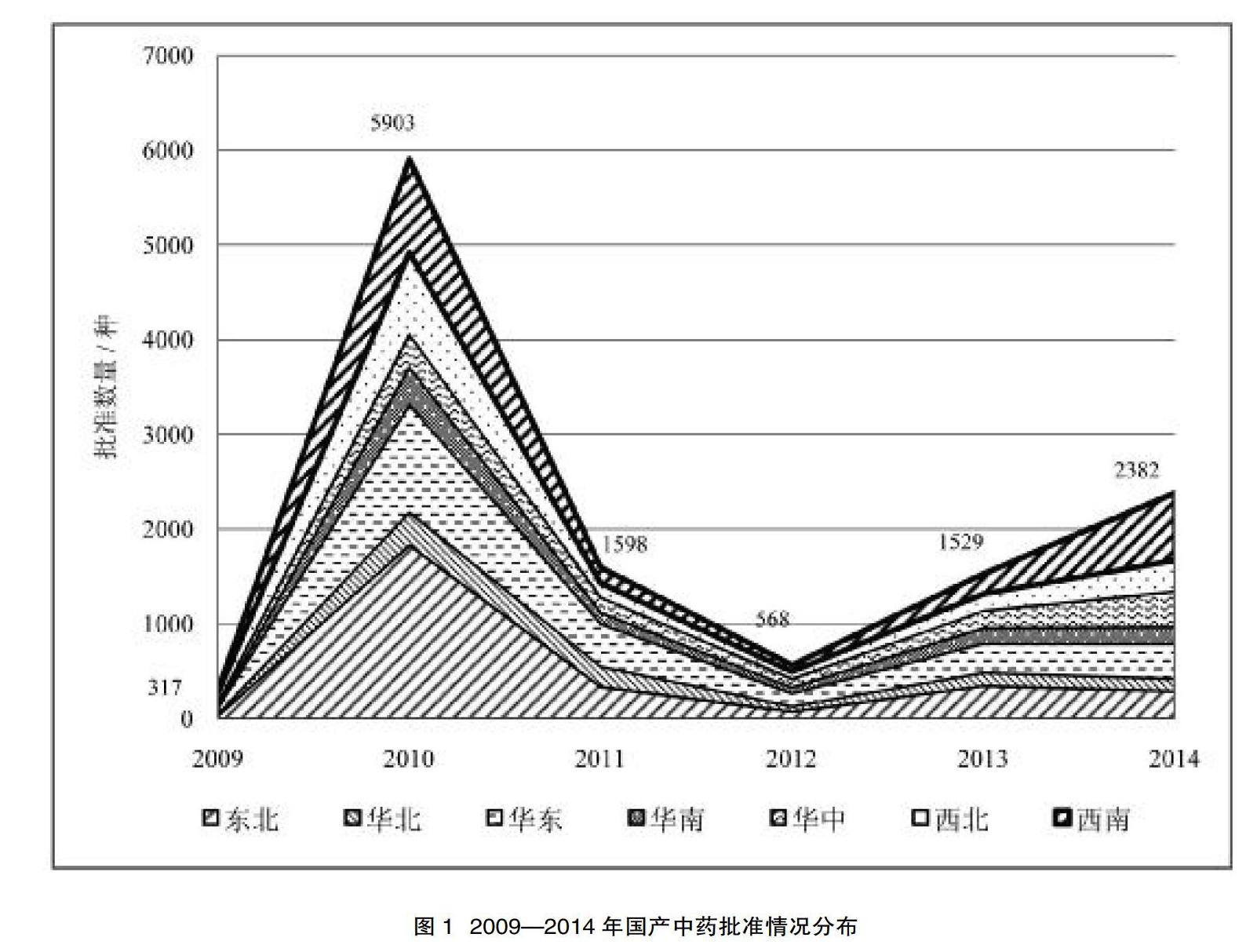
根据统计数据,2009—2014年间共计批准国产中药12 297件。平均每年批准国产中药2 050件。其中2010年中药药品数量从2009年的317件增长至5 903件,呈激增态势。而2011年,中药批准数量出现回落,为1 598件,但批准总量仍保持在一定水平。2012年,中药批准数量降至几年来的最低点,为568件。2012年后,中药批准数量稳步上升,逐渐趋于平稳。见图1。
2.2 国产中药批准情况地区分布
2009—2014年间,共计批准国产中药12 297件。从获批地区分布数据来看,不同地区的中药批准数量存在较大差异。东北地区(2 900件,23.6%)、华东地区(2 463件,20.0%)、西南地区(2 186件,17.8%),这3个地区相比于西北地区(1 718件,14.0%)、华中地区(1 189件,9.7%)、华南地区(934件,7.6%)、华北地区(904件,7.4%)这4个地区的国产中药获批数量较多。
在省级层面,2009—2014年间国产中药获批数量排在前3位的省份依次是黑龙江省(1 219件,9.9%)、吉林省(1 054件,8.6%)和江西省(858件,7.0%),审批数量排在后3位的省份依次是西藏自治区(20件,0.2%)、青海省(50件,0.4%)和海南省(75件,0.6%)。见图2。
2.3 不同年度国产中药批准情况获批地区分布
从不同年度国产中药批准情况申报地区分布分析,全国各地区在2009—2010年间中药获批数量均大幅增长,而在2010—2012年间中药批准数量均出现减少并产生较大波动。2012年后,西南、西北、华中、华南地区中药获准数量保持逐年增长。而各地区中药批准数量占全国总体批准数量的比例显示,只有西南地区在2012—2014年间所占比例也逐年增长。见表1。
2.4 国产中药批准情况剂型分布
CFDA在2009—2014年间批准的中药,仍以传统剂型为主,占比超过10%的共4种剂型,分别为片剂3 242件(26.4%),丸剂2 679件(21.8%),胶囊剂2 193件(17.8%),颗粒剂1 434件(11.7%),共占批准药物总数的77.7%。占比超过1%的共6件剂型,分别为合剂572件(4.7%),糖浆剂488件(4.0%),膏剂351件(2.9%),注射剂273件(2.2%),散剂272件(2.2%),酒剂143件(1.2%),其他剂型所占比例均小于1%。而锭剂、凝胶剂、滴剂、油剂等多个剂型的获批药物数目均小于10件。由于剂型数目过多,为便于统计,该文将获批数目小于5件的剂型,归为“其他”类。见图3。
根据批准药物物态分类统计得到,获批数量达到9 965件的固体剂型占比最大,达到81.0%,获批量达1 902件的液体剂型占比15.5%,半固体制剂397件,占比3.0%,数目最少的气体制剂,获批量不足40件。
以給药方式作为分类标准进行统计分析,国产中药仍以口服制剂为主,获批量达11 546件,占比接近95%,经皮肤给药和注射给药制剂的获批数目接近,分别为335件(占比2.7%)和273件(2.2%),均小于3%。其他给药途径的制剂总占比仅为1%左右。
2.5 不同年度国产中药批准情况剂型分布
从不同国产中药批准剂型的时间分布统计易知,统计范围内各剂型在各年的获批比例与总体趋势一致,均为固体剂型>液体剂型>半固体剂型>气体剂型。而各剂型的批准数量又与当年的批准总数趋势基本保持一致,2010年前后的获批数量出现巨大的波动,当年的批准量处于波峰位置,2012年的批准量跌入低谷,并在之后出现回升趋势。见图4。
3 讨论
3.1 药品年批准注册数量逐渐趋于稳定
2007年4月CFDA发布《关于贯彻落实国务院办公厅关于进一步加强药品安全监管工作通知的意见》,同年10月开始实施新修订的《药品注册管理办法》,至此药品注册申报更加规范严格。2008年CFDA对过渡期品件集中审评有效解决申报品件过多累积的问题,同时肃清一些低水平的品件,提高收紧审批的门槛。因此2009年审批数量相对较少。
在2010年,中药药品数量激增,其原因可能主要有3个方面:①随着《药用原辅材料登记备案管理规定》《药品标准管理办法》《天然药物注册管理补充规定》《药品注册质量管理规范》《药品注册现场核查工作实施细则》等一系列法规的颁布,药品注册管理体制不断完善,药物研究全过程监管得到了加强;②在2009—2010年,CFDA通过一系列中药受保护品件的公示,为中药审批提供一个良好的大环境;③新研发的中药药品与此前仍在审批的药品积累到了一定程度,大量药品在该时间得到审批通过。
2011年,中药批准数量出现回落,这与药品审批监管连续出台《关于开展药物非临床安全性评价研究机构重大变更有关情况调研的通知》《关于联合开展药品安全专项整治督查工作的函》《关于做好药品再注册审查审批工作的补充通知》《关于进一步做好基本药物标准提高工作的通知》等一系列政策文件密切相关。在保持继续推进提高药品标准的同时,加强对药品审批的严格控制。总体批准量虽然下降,但仍保持在一定数量。
2012年,中药批准数量降至几年来最低点,主要受到日益强化的药物生产监管影响,尤其以《关于进一步加强基本药物生产监管工作的意见》《关于印发已上市中药变更研究技术指导原则(一)的通知》《关于印发药物Ⅰ期临床试验管理指导原则(试行)的通知》等系列文件为代表。与之相呼应的是各地方政府积极开展中药的各类监督专治工作,当年的审批流程更加严格且审批周期更长,因此数量急剧下降。
2013年,中药批准开始回暖,这得益于上年年末由国家食品药品监督管理局、国家发展改革委、工业和信息化部、卫生部共同制定的《关于加快实施新修订药品生产质量管理规范促进医药产业升级有关问题的通知》:①鼓励和引导药品生产企业尽快达到新修订药品GMP,积极鼓励药品生产向优势企业集中,加快优势企业通过认证;②加强对实施新修订药品GMP的指导和服务,注重质量保证体系建设,这些举措为中药审批提供了良好的契机。
2014年,中药审批逐渐趋于稳定,数量较去年略有上升。随着药品注册管理机制的日益完善,同时企业更加适应新的标准。在此基础上,CFDA制定了《中药、天然药物改变剂型研究技术指导原则》,尤其是在药物剂型技术突破上进一步推动药品研发。
总体而言,中药的批准受到政策的宏观调控,药品注册申报逐渐回归理性的同时[3],批准后的反馈也影响着政策的调整。伴随着药品注册管理制度的完善,中医药行业的规范发展,药品年批准数量在经历早期的一些波动后,逐渐趋于稳定。
3.2 地区间药品获批数量不均衡,中药资源优势明显
国产中药的批准情况地区间的不平衡客观存在。2009—2014年间,总体而言,东北地区(2 900件,23.6%)、华东地区(2 463件,20.0%)、西南地区(2 186件,17.8%)整體获批中药数量较多。然而,进一步结合时间因素,考虑不同年度间各地区中药获批数量,可以发现西南、西北、华中、华南地区的中药获批数量在2010年以后呈逐年增长态势,同时西南地区在2010—2014年间获批数量占全国获批数量比率保持逐年增长,分析这可能与上述地区在中药注册获批上受到有关政策调控的积极影响,同时可能与这些地区具有相对较为丰富的道地中药材资源[4]或者较为成熟的中药研发生产基础,其为中药的研发注册申报创造了良好的条件。故上述地区的中药发展有着巨大的潜力和广阔的前景。
3.3 中药各剂型批准情况差异明显,新兴剂型注册有待增加
从剂型分类分析,根据统计结果,2009—2014年6年间,CFDA批准的中药中,仍以传统剂型为主,如片剂(26.4%),丸剂(21.8%),胶囊剂(17.8%),颗粒剂(11.7%),共占批准药物的77.7%。从服用方式来看,这些剂型的服用更方便,生物顺应性较好,更加符合当前药物剂型发展的趋势和市场需求。而更加传统的散剂、搽剂、敷剂等,所占的比例则相对小得多。这些剂型相应的都存在使用不便、利用度低或是容易给患者造成困扰等问题,而逐渐淡出市场,或被新的剂型所取代[5]。此外,伴随着药用高分子材料发展起来的一系列新剂型,也开始逐渐应用于中药制剂领域,如滴丸剂、软胶囊等,并在其中占据一定的比例,可以预见中药新剂型在未来会有更大的发展空间。而将化学药物中作为主要剂型的注射剂,引入中药制剂领域,是一项大胆的创新。6年内批准的注射剂占据批准中药总量的2.2%,表明中药注射剂正在逐步克服严重的不良反应危机,走向扩大化应用。
根据药物物态进行分析比较可以发现,6年内批准的中药,包括片剂、丸剂、胶囊剂、颗粒剂等剂型在内的固体剂型占据了超过80%的比例,而包括注射剂、糖浆剂等剂型在内的液体剂型占比超过15%。相对而言,半固体制剂和较为新型的气体制剂,目前所占比例极小。这一比例也符合不同剂型药物的稳定性及研发难度趋势。气体剂型由于研发难度和成本原因及给药方式的特殊性,在短期内的研发和应用难以出现爆发式增长的情况。可以预见,在当前及未来较长一段时间内,片剂等传统剂型仍将居于主导地位,而新型制剂则将会随着研究的不断深入,得到长足的发展。
从批准中药的给药途径统计数据来看,国产中药基本涵盖了所有给药途径。其中以最为传统的口服给药为主(93.9%),透皮给药剂型(2.7%)和注射给药剂型(2.2%)分别占据了一定的比例,针对其他给药方式的剂型则都相对较少。由于存在特定病变部位给药的因素,且各病变部位可能发生疾病的种类及发病率存在极大的差异,故而针对这些病变部位的药物数目与疾病的多少密切相关。如直肠给药(0.1%)、口腔给药(0.1%)和阴道给药(0.1%)等,与获批药物数目仅为1个的耳腔相比,这些病变部位存在一定的发病概率,故还占有一定的比例。随着研究的深入和技术的进步,针对特定部位病变的靶向制剂和定制药物正在成为医药研究的热点,可以预见,未来药物的给药途径可能会具备更大的特异性,也会更加多样化。
4 结论与建议
根据6年内的审批数据分析结果,国内中药审批数量受政策影响极为显著。对药品生产企业而言,在药品研发需要关注临床疗效和市场的需求的基础上[6],药品申报需要时刻关注国家政策方针来调整研发方向。对于药品审评工作,除了要坚决执行国家政策,严把质量关,为人民的生命安全负责,也要根据企业申报的实际情况进行“具体情况具体分析”,解决企业的问题,早日将中药做大做强。
就中药批准地区间对比而言,不同地区间的差异是允许的。应当鼓励和支持全国各企业实现共同全面提高,而不是各地区间简单的药物批准数量保持均衡。各地区应根据该地区资源优势,如当地药材以及地域优势,如地区经济水平和政策支持等,综合进行合理规划,形成各具特色、百家争鸣的区域分布格局。
就中药批准剂型进行分析,中药传统炮制和剂型受现代医药学的冲击较大,且其现代化起步晚、发展慢。其现代化的主要问题在于如何实现传统工艺与现代技术的有机统一。对国产中药而言,不必一味追求纯粹的现代制剂,应当在对中药传统理论进行“取华弃粕”基础上,制定符合实际的剂型发展方向,推出有特色的中药现代剂型。
[参考文献]
[1] 黄璐琦.中医药资源优势浅析[J].创新人才教育,2017(2):42-44.
[2] 吴浩,张清.新《药品注册管理办法》出台后的药品注册申报工作[J].中国新药与临床杂志,2008,27(11):861-865.
[3] 王奇巍,赖树清,郭文.药品注册管理新政对药品研发申报的影响分析[J].中国医药工业杂志,2017,48(11):1660-1665.
[4] 陈欢,谭舒舒,罗小泉,等.中药道地药材的研究进展[J].时珍国医国药,2018,29(9):2228-2230.
[5] 王春燕.药剂学[M].重庆:重庆大学出版社,2017.
[6] 冯爱玲,郭富利,邢花.我国药品注册制度调整对新药研发的影响研究[J].中国药房,2017,28(22):3025-3029.
(收稿日期:2019-06-20)
