利用剩余活性污泥合成聚羟基脂肪酸酯的研究进展
2019-12-09孟栋李枘枘刘玉玲樊祥宇黄兆松古鹏飞李强
孟栋,李枘枘,刘玉玲,樊祥宇,黄兆松,古鹏飞,李强
综 述
李强 济南大学生物科学与技术学院副院长,教授、博士生导师,中国微生物学会终身会员,山东微生物学会理事,长期从事资源与环境微生物学相关研究。先后主持承担国家自然科学基金项目3项、省部级项目4项。在、、等主流学术刊物发表科研论文30余篇,其中SCI收录20余篇。作为第一完成人获授权国家发明专利5项,获中国商业联合会科技进步二等奖1项、山东省高校优秀科研成果二等奖1项。

利用剩余活性污泥合成聚羟基脂肪酸酯的研究进展
孟栋,李枘枘,刘玉玲,樊祥宇,黄兆松,古鹏飞,李强
济南大学 生物科学与技术学院,山东 济南 250022
利用单一微生物发酵是现阶段获得聚羟基脂肪酸酯 (PHA) 的主要方式,但过高的生产成本限制了其大规模应用。近年来利用活性污泥菌群混合培养合成PHA被广泛研究。将剩余污泥处理与PHA合成相结合,不仅可以省去纯培养所必需的灭菌环节,同时可以实现剩余污泥的资源化利用。剩余污泥的水解酸化、菌群富集驯化及PHA合成受环境因素影响,深入的生物合成机制研究有助于混合培养合成PHA的推广应用。文中主要介绍利用剩余污泥合成PHA的可行性、影响剩余污泥水解酸化的因素、污泥菌群富集驯化合成PHA及其机制等方面的研究进展。
聚羟基脂肪酸酯,活性污泥,挥发性脂肪酸,微生物混合培养
随着“白色污染”带来的问题愈发严重,寻找石油基塑料的替代产品迫在眉睫。聚羟基脂肪酸酯 (PHA) 可在自然条件下被微生物完全降解,具有与石油基塑料产品相似的物理化学性质,使其成为一种潜在的替代产品,可广泛应用于工业、农业、建筑、制药及生物医学等领域[1-2]。利用单一微生物发酵是现阶段获得PHA的主要方式。虽然产量较高,但昂贵的发酵底物及发酵过程需保持无菌条件使其生产成本至少是传统塑料的3倍以上[3]。因此寻找低成本的生产方式成为PHA研究领域的重点方向。利用活性污泥微生物混合培养发酵合成PHA无需保持无菌条件,且污泥本身经水解酸化可以产生廉价碳源,有望解决合成PHA成本较高的问题。
1 利用剩余污泥合成PHA的可行性
活性污泥法是目前应用最广泛的污水生物处理技术,缺点是产生大量的剩余活性污泥亟待处理。根据《“十三五”全国城镇污水处理及再生利用设施建设规划》[4](以下简称“《规划》”) 数据显示,截止2015年底我国污水处理能力达2.17亿m3/d,约产生污泥13万t/d,而污泥无害化处置规模仅为3.74万t/d。因此《规划》中特别强调,“十三五”期间国家“鼓励采用能源化、资源化技术手段,尽可能回收利用污泥中的能源和资源”。
Wallen等[5]首次报道活性污泥中的微生物可以积累PHA,揭开了利用剩余活性污泥这种废弃物资源合成PHA的序幕。2014年Van等[6]在上撰文指出了未来的污水处理厂利用剩余活性污泥菌群合成PHA的重要意义。Pittmann等[7]通过论证在德国或欧洲其他国家的污水处理厂进行PHA生产的可行性,认为全欧洲的污水处理厂可以生产出全球目前生物聚合物产量1.15倍的产品,因此利用污水处理活性污泥规模化生产PHA的潜力巨大。
Valentino等[8]提出可以将利用活性污泥生产PHA与污水处理过程结合,产PHA的同时可以减少活性污泥的产量,这一过程主要是通过将有机固体转化为挥发性脂肪酸 (VFAs) 来实现,而VFAs可以作为PHA的合成原料。在经济上切实可行的利用剩余污泥菌群混合培养发酵合成PHA主要包括3个过程:1) 底物准备阶段:含大分子有机物的废水或剩余污泥经水解酸化生成VFAs;2) 产PHA菌群富集阶段:通过驯化污泥将具有合成PHA能力的菌群富集;3) PHA合成阶段:经驯化富集的污泥菌群利用VFAs合成PHA[9]。
2 剩余污泥水解酸化的影响因素
剩余污泥厌氧水解酸化生成的VFAs主要是由6个或者更少的碳原子组成的短链脂肪酸,该反应一般在序批式反应器 (SBR) 中进行。研究表明以下若干因素会对生成VFAs的浓度及组成有较大影响。
2.1 温度对水解酸化的影响
温度对厌氧消化底物中组分的物化特性有重要影响,同时还影响微生物的生长速率与代谢,从而使反应器中的种群动态发生变化[10]。Yuan等[11]研究表明在24.6 ℃条件下VFAs最高产量为 2 154 mg/L,而在嗜冷范围14 ℃和4 ℃条件下VFAs产量分别为1 449 mg/L和782 mg/L,但在这3种不同温度下产生的VFAs的组成并没有显著的变化。Liu等[12]发现,在最佳pH下总VFAs的积累在嗜热 (55 ℃) 条件下最高,是嗜温 (35 ℃) 条件下的2倍,是嗜高温 (70 ℃) 条件下VFAs积累量的1.12倍。另外,Hao等[13]的研究也证明了55 ℃条件下VFAs产量高,厌氧发酵VFAs的积累量是嗜温条件的10倍。通过以上研究表明,55 ℃左右的嗜热条件是水解酸化的最适温度。
2.2 pH对水解酸化的影响
由于大多数的产酸微生物在强酸 (pH<3) 和强碱 (pH>12) 环境下不能生存,因此控制反应器中的pH对于VFAs的生产非常重要[14]。在酸性和碱性环境下,产酸微生物均能够进行厌氧发酵产酸。在碱性条件下,污泥中胞外聚合物带电基团的电离会促进污泥水解,并导致胞外聚合物之间的强排斥,从而使碳水化合物和蛋白质释放到环境中。同时碱性条件还能够防止生成的VFAs消耗形成甲烷[15]。Liu等[12]研究了不同pH条件对VFAs生产的影响,发现在pH 12条件下,最大VFAs浓度为2 930 mg/L;在pH 10条件下,VFAs最大浓度为6 128 mg/L;在pH 8条件下,VFAs最大浓度为5 463 mg/L。碱性环境下的VFAs浓度均高于未调节pH的VFAs浓度。Cheah等[16]利用城市垃圾发酵产酸时,在酸性条件 (pH 6) 下发酵3.5 d后,VFAs浓度是最初体系中浓度的2倍。同样是利用城市垃圾产酸,Moretto等[17]在实验过程中监测发酵体系的pH变化,发现pH随发酵时间降低,尤其在初始条件为碱性时变化显著,在低于pH 4.5时水解过程及产酸菌生长严重受到抑制,最终导致有机物溶解及VFA积累下降。另外,pH还会影响VFAs的类型,Cokgor等[18]的研究显示在pH 5.5时乙酸产生的百分比约为70%,而在pH 6.5时乙酸所占比例降低为35%左右。因此,在生产特定类型的VFAs组成时,需要确定最佳pH。
2.3 有机负荷率对水解酸化的影响
有机负荷率 (OLR) 可以反映体系中微生物处理有机物的能力,在水解酸化的过程中有机物被微生物分解成VFAs。Lim等[19]发现食品垃圾中随着OLR从5 g/(L·d)增加到13 g/(L·d),厌氧产生的VFAs浓度从 (13.0–14.0) g/L增加到(28.9–30.0) g/L;而当OLR超过13 g/(L·d)时,反应器变得不稳定。此外,增加OLR会改变VFA的组分。Tang等[20]研究了食品垃圾乳酸发酵的结果,当OLR从14 g/(L·d)增加到22 g/(L·d)时,乙酸浓度从2.1 g/L增加到5.5 g/L,丙酸和丁酸则几乎没有变化;当OLR从14 g/(L·d)增加到18 g/(L·d)时,乳酸浓度从29 g/L上升至37.6 g/L;OLR从18 g/(L·d)增加到 22 g/(L·d)时,乳酸产量急剧下降至22 g/L。Wijekoon等[21]在厌氧产酸发酵工艺中,将OLR从5 g/(L·d)提高到12 g/(L·d)时发现VFA的主要组分从乙酸变成正丁酸。因此,优化OLR参数不仅可以提高酸的产量还可以获取不同种类的VFA。
2.4 停留时间对污泥水解酸化的影响
停留时间包括固体停留时间 (SRT) 与水力停留时间 (HRT),使用剩余污泥来生产VFAs时,SRT等于HRT[22]。Feng等[23]在pH 10条件下,SRT从4 d延长至12 d,VFAs浓度增加了43.6%;而SRT增加至16 d时,VFAs浓度下降,可能是由于产甲烷菌消耗了部分生成的VFAs。所以在一定的范围内增加SRT可以提高VFAs的产量。SRT对于VFAs组分中乙酸和丙酸的影响较大,SRT从4 d增加到16 d,乙酸的比例从32.0%增加到42.4%,而丙酸则从23.6%下降到14.3%,丁酸与戊酸保持相对稳定。Yuan等[24]的研究中,随着SRT延长至10 d,VFAs产量增加了46%,但是乙酸所占比例从第5天的66%下降至第10天的49%,丙酸的比例保持稳定,维持在17%左右。适当调整停留时间,提高水解酸化过程中VFAs的产量,可以为菌群富集和PHA合成阶段积累充足的养分。
3 污泥菌群的富集驯化及PHA合成
3.1 污泥菌群的富集驯化模式
菌群富集驯化的目的是为了富集PHA合成菌,以获得较高的PHA产量。活性污泥合成PHA的工艺中,较多采用好氧瞬时补料工艺 (丰盈-饥饿模式)。该工艺使微生物在丰盈和饥饿状态下反复交替。在丰盈状态下,菌群可以将过量碳源转化成PHA储存在体内;而在饥饿状态时,这些物质可以被利用供微生物的生长和代谢。通过这种选择性压力,每个周期都会淘汰掉部分无法合成PHA的菌株,从而实现对PHA合成菌群的富集。清华大学王慧教授课题组采用该模式驯化活性污泥,得到具有较高PHA合成能力的菌群S-150,并通过将剩余污泥的厌氧发酵控制在水解酸化阶段大量合成VFAs。然后以S-150为菌种分别利用剩余污泥水解酸化液及模拟污泥水解液合成PHA,PHA含量最高可达细胞干重的62.43%[25]。除此之外,活性污泥菌群的驯化还可采用厌氧-好氧工艺,该过程中微生物在厌氧阶段处于休眠期,主要是微生物对碳源进行摄取在体内储存PHA,随后的好氧阶段通入空气时,此时体系碳源不足以供菌群生长代谢,而PHA合成菌可以利用储存的PHA继续生长。Liu等[26]报道使用该工艺不仅可以对废水进行生物除磷,对PHA合成菌群的富集也具有一定效果,实现了污水处理和合成PHA的双重效果。Bengtsson等[27]利用该模式处理废水时,通过菌群结构分析,发现了大量的聚磷菌 (PAOs) 和聚糖菌 (GAOs),这两种菌群是典型的PHA合成优势菌群。除此之外还可以将不同的合成工艺整合来富集PHA合成菌群,比如将利用微生物产H2和PHA合成相结合。Suriyamongkol等[28]研究发现H2可以作为合成VFAs的中间体,而VFAs可以被微生物利用产PHA,将两个工艺相结合不仅可以获取H2能源,而且有利于富集PHA合成菌群。
3.2 影响菌群富集的因素
在菌群富集的过程中,基质、pH、温度、SRT等条件参数都会影响最终的富集效果和微生物群落结构。Janarthanan等[29]提出不同基质投放会影响污泥中PHA菌群的驯化效果。Beccari等[30]在研究中发现在富集PHA合成菌群时,当使用复杂的富含VFAs的原料时,如橄榄油废水,更有利于PHA菌群的富集。Oliveira等[31]通过研究发现,在低有机负荷体系中,通过添加奶酪乳清促进PHA菌群的富集。除此之外在富集阶段,优先考虑改善PHA合成菌群的生长条件,投加之前需对原料进行预处理。Korkakaki等[32]对城市垃圾过滤液稀释后再进行投放,较未处理组的富集效果显著提升。另外还可以通过控制温度与pH的方法为混合菌群创造良好的生长环境。Zhang等[33]在以有毒污染物苯酚为原料合成PHA的过程中,考察了不同温度对微生物富集的影响,发现低温可以抑制PHA合成菌群的生长,菌群的丰富度也降低。在此之前的研究中表明在pH<7时,菌群生长变缓,Fleit等[34]发现这种抑制作用可能与低pH下底物中的未解离酸 (如乙酸) 有关。这些酸可以扩散到细菌的细胞内造成质子负荷,从而导致菌体代谢生长变慢。Oehmen等[35]研究pH对富集阶段菌群结构的影响时,通过对比发现富集体系控制在pH为8时,富集菌群的生物量是未控制pH体系的两倍,最终前者体系中PHA的积累率也明显提升。控制SRT对活性污泥合成PHA的体系至关重要,SRT参数作为一种选择性压力可以表征富集过程中微生物世代交替时间,适当调控SRT可以保持富集体系中微生物的活性[36]。Albuquerque等[37]利用水解酸化后的废水对PHA合成菌群进行富集,通过调整不同的SRT进行对比实验,最终发现在SRT设为10 d时,富集效果最佳,菌群代谢旺盛,PHA的合成比例高达74.6%。
3.3 影响PHA积累的因素
富集之后的PHA合成菌群具有相似的代谢特征,根据生长环境的变化,菌群会利用碳源合成PHA[38]。虽然具备这种特征,在PHA积累过程中还应该控制微生物的生长环境,如通过控制补料模式、溶解氧、碳源种类、氮磷比、pH、温度等参数,来满足微生物合成代谢的需求。目前报道的补料方式主要有两种:间歇批次补料模式和连续补料模式。在PHA生产中间歇批次补料模式应用最广泛。Serafim等[39]采用间歇批次补料模式,将乙酸分3次加入反应器,最后合成的PHA含量高达78.5%。与间歇批次补料模式相比,连续补料不会中断反应,可以防止微生物在中断过程中消耗体内储存的PHA,但是该过程对碳源的利用率较低。Albuquerque等[40]通过实验验证,同等条件下在连续补料模式中微生物对碳源的摄取速率和代谢活力比间歇批次补料更具有优势,最终PHA的产量高出5%。
氧气供给是混合菌群利用活性污泥合成PHA的关键因素。Wang等[41]通过改变氧气的供应证明PHA的合成与硝化反应密切相关,通过调节溶解氧 (DO),不仅可以促进氮的去除,而且不影响现有菌群的PHA最大存储速率,为活性污泥生产PHA工艺生产条件的控制提供了依据。郑裕东 等[42]在厌氧-好氧模式下研究PHA合成时,发现污泥中大多数微生物利用碳源合成聚磷酯和糖原等物质,PHA实际占的比重较低,而对通氧量进行控制可以促进微生物积累PHA。
合成PHA的种类与所使用的底物的组成直接相关,脂肪酸、葡萄糖、蔗糖和果糖通过代谢产生不同的羟基烷酸单体,并用于PHA的生物合成。选择不同碳源,菌群积累PHA的能力也有所不同。哈尔滨工业大学陈志强等[43]以VFAs作为碳源,开发了一种利用污泥菌群合成PHA的连续供料模式,PHA最高积累量可达菌体干重的70.4%。厦门大学王远鹏等[44]选用乙酸 (和丙酸)为碳源,利用二沉池活性污泥在序批式反应器中发酵合成PHBV,积累率可达到74%。Rodriguez等[45]对近些年利用不同废弃物合成PHA报道作了统计,发现混合菌群利用的废弃底物来源广泛,并且合成PHAs的种类丰富,具有巨大的应用潜力。Palmeiro等[46]报道在中试规模下活性污泥中PHA的含量占污泥有机质成分的66%,活性污泥不仅可以作为菌种来源,同时也可以作为合成底物,富含可供微生物生长繁殖的营养物质,目前报道利用活性污泥合成PHA的产率接近纯菌发酵的产率。Ribeiro等[47]在利用粗甘油合成PHA的过程中,发现底物基质里中链和长链的脂肪酸比例越高,合成的中链和长链聚合物的摩尔含量越大。
在PHA合成阶段,适当控制pH可以促进微生物的代谢积累。Villano等[48]在研究控制pH对PHA积累影响时发现当pH 7.5–9.0时更有利于PHA积累,并且通过pH改变可以控制PHAs的合成种类。相反如果不控制pH,甚至会导致PHA的水解,Zheng等[49]研究发现在厌氧碱性 (pH 10) 发酵条件下,通过荧光原位杂交 (FISH)等技术研究菌群结构,发现有大量的假单胞菌属和产碱杆菌属富集,这两种菌可以分泌胞外蛋白酶和解聚酶,将PHA水解成单体 (3-羟基丁酸、3-羟基戊酸),之后产酸菌可以利用这些单体合成短链脂肪酸。不同基质中N/P含量有所差异,研究表明高浓度的氮磷会影响微生物的代谢生长,Korkakaki等[32]通过曝气使垃圾渗滤液中的磷酸盐沉淀,低浓度的磷酸盐不会造成微生物的生长抑制,提高了PHA积累率。Schmidt等[50]研究发现氮的消耗会导致PHB产量下降,而3-羟基戊酸酯的积累和氮的消耗保持在同一水平,因此在生产体系中要补充氮元素以获得较高的PHA产率。
4 PHA的生物合成机制
虽然混合培养合成PHA的研究已经取得令人瞩目的成果,但是与单一菌种发酵相比还有不小差距。有效缩短驯化富集时间,提高PHA在污泥中的含量成为摆在污泥资源化利用面前的难题,而深入的PHA合成机制研究有助于解决这一问题。
4.1 PHA代谢相关基因
已知的PHA代谢相关的酶和调控蛋白及它们的编码基因见表1,按照所执行的功能,可分别归类为PHA合成、PHA降解和PHA代谢调控[51-52]。
其中PHA合酶 (PHA synthase,PhaC) 是PHA生物合成过程中最关键的酶,由(或)编码。它能够以羟基脂肪酸 (HA) 的CoA硫酯为底物,催化HA脱去CoA聚合形成PHA。根据合成PHA的类型、合酶结构中亚基的种类以及对底物的特异性,PHA合酶可分为4种类型 (Ⅰ−Ⅳ合酶)。Ⅰ类和Ⅱ类合酶由一个亚基组成 (PhaC),其分子量大约为60 kDa,Ⅲ类合酶由PhaC亚基 (分子量40–53 kDa) 和PhaE亚基 (分子量20–40 kDa)组成,Ⅳ类合酶由PhaC亚基 (分子量约41 kDa)和PhaR亚基 (分子量约22 kDa) 组成。四类PHA合酶都可以行使催化功能,尽管组分及结构具有一定差异,但均以二聚体形式进行催化。Ⅰ类和Ⅱ类合酶以两个PhaC亚基形成同二聚体,而Ⅲ类和Ⅳ类合酶分别由两个不同亚基形成异二聚体进行催化。在合成过程中,Ⅰ类、Ⅲ类和Ⅳ类PHA合酶可以利用丙酸盐、丁酸盐、戊酸盐、己酸盐等合成短链聚合物 (scl-PHA),而Ⅱ型PHA合酶可以利用烷烃等作为前体合成中链聚合物 (mcl-PHA)。此外,丙二酰辅酶A酰基转移蛋白转酰酶(由编码) 及3-酮酰辅酶A还原酶(由fabG编码) 等与PHA合成途径相耦联的酶也参与了PHA合成。
PHA凭借生物可降解特性受到了科学界广泛关注,在降解的过程中PHA解聚酶 (Depolymerase,PhaZ) 起到了关键作用,它可以将PHA分解成小分子量的寡聚体[53]。PhaZ酶位于PHA颗粒上,它可以水解含有脂肪族和芳香族单体的PHA,该酶由一条多肽链构成 (分子量37–60 kDa),包括N-端催化结构域、C-端催化结构域和两位点的结合区[54]。Jendrossek等[55]研究发现微生物可以通过在胞外或者胞内分泌解聚酶来降解不同环境中的PHA,然后利用分解后的小分子物质作为碳源供细胞生长繁殖。在PHA降解的过程中,解聚酶的催化效率取决于环境因素以及PHA的种类。Huisman等[56]研究发现在厌氧条件下微生物对PHA的降解时间可长达数月,而在高盐的海水中则需要一年。Kunioka等[57]在研究PHA的单体构造时发现,当引入4HB单体时,PHA的降解速度显著提高,最终的降解对比结果是P (3HB-co- 4HB)>P (3HB)>P (3HB-co-3HV)。
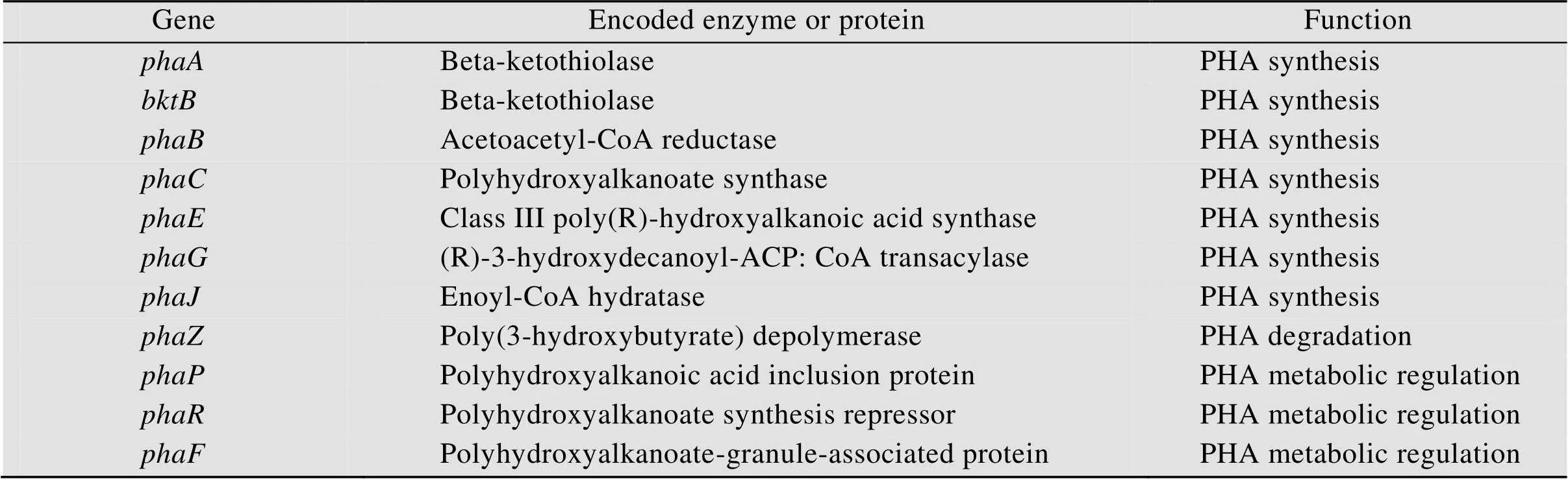
表1 PHA代谢相关的酶和蛋白及其编码基因
PHA是以包涵体的形式储存在微生物体内,其表面覆盖蛋白质层,这些蛋白质被称为PHA颗粒结合蛋白 (GAPs),在PHA代谢中起调控作用,其中phasin蛋白占绝大多数。Phasin蛋白是不均匀的小尺寸蛋白质群,具有两亲性 (可保护疏水性聚合物),它虽然缺乏一定的催化功能,但是在PHA颗粒构造和代谢过程中起到关键调控作用[58]。近些年,大量phasin蛋白被发现并证实了其功能。科学家在青枯菌中发现了大量的PhaP家族蛋白,这些多肽与PHA的疏水端紧密结合,可以分散PHA颗粒,防止与其他蛋白质特异性结合[59]。Kuchta等[60]通过构建突变菌株发现PhaP基因缺失虽然不会对PHA合成产生影响,但是会显著影响PHA的成粒,最终突变菌株体内会形成一个大颗粒的PHA。Prieto等[61]在假单胞菌中发现了PhaF蛋白,证实了该蛋白有两个结构域:N-末端和C-末端,其中N-末端与PHA结合,而C-末端则非特异性与DNA结合。PhaF蛋白不仅可以增强PHA在细胞内的稳定性,而且对PHA在细胞内的定位起关键作用,它可以将DNA与PHA颗粒连接,确保两者在细胞分裂时分配均匀[62]。
4.2 微生物中PHA的合成途径
微生物中已知的PHA合成途径主要分为3种:1) 聚羟基丁酸 (Polyhydroxybutyrate,简称PHB)的葡萄糖合成途径;2) 脂肪酸β-氧化途径;3) 脂肪酸从头合成途径[63]。微生物以VFAs 为碳源合成PHA时,以H16合成聚羟基丁酸戊酸共聚酯 (Poly (3-hydroxybutyrate-co-3- hydroxyvalerate),简称PHBV) 为例,主要的合成途径包括:1) 乙酸主要经乙酰辅酶A合成酶 (由编码) 或乙酸激酶 (由编码) 催化生成乙酰辅酶A,β-酮基硫解酶 (由编码) 催化2个乙酰辅酶A缩合成乙酰乙酰CoA,乙酰乙酰CoA由NADPH依赖的乙酰乙酰CoA还原酶 (由编码) 还原生成3HBCoA,然后在PhaC的催化下参与合成PHA;2) 丙酸经丙酰辅酶A合成酶 (由编码) 催化生成丙酰辅酶A,β-酮基硫解酶 (由编码) 再催化1分子的乙酰CoA和1分子丙酰CoA缩合而成的β-酮戊酰CoA,β-酮戊酰CoA在PhaB的催化下生成3-羟基戊酰CoA,然后在PhaC的催化下参与合成PHA;3) 丁酸经β-氧化过程的酶催化生成丁烯酰CoA,再经(R)-烯脂酰CoA水合酶 (由编码) 催化生成(R)-3-羟基丁酰CoA用于PHA的合成。此外,(R)-3-羟基脂酰-ACP:CoA酰基转移酶 (由编码) 催化脂肪酸从头合成途径的中间产物 (R)-3-羟基脂酰-酰基载体蛋白转化成相应的CoA的衍生物,用于PHA的合成。合成的PHA可以被解聚酶 (由编码) 作用后,被微生物重新利用。活性污泥菌群中可能的VFAs消耗及PHA代谢途径见图1。

图1 活性污泥菌群中可能的VFAs消耗及PHA代谢途径
4.3 混合培养PHA合成菌群研究
变性梯度凝胶电泳 (DGGE)、末端限制性片段长度多态性分析 (T-RFLP) 等技术曾广泛应用于分析混合培养PHA合成菌群的结构[64-65]。随着价格的大幅度降低,高通量测序逐渐成为目前菌群研究的主要技术手段。Wang等[66]利用16S rDNA高通量测序,分析了强化生物除磷工艺中污泥菌群结构,并利用宏基因组高通量测序从中拼接出一株名为GAO-HK菌株的接近完整的基因组草图,并挖掘出菌株降解吗啉过程中通过乙醛酸循环利用VFAs合成PHA的代谢途径。Oshiki等[67]通过对多种活性污泥的菌群结构进行解析,发现具有合成PHA潜力的微生物在污泥菌群所占比例为11%–18%。
Wang等[68]以处理[Cl–]高达24 000 mg/L以上的环氧丙烷 (Propylene epoxide,简称 PO) 皂化废水的活性污泥菌群为研究对象,采用丰盛-饥饿模式向PO皂化废水中定期添加乙酸,驯化PO皂化废水活性污泥菌群合成PHA,最终获得占污泥干重23.67%的PHBV,同时污泥驯化及合成PHA过程中COD明显降低,证明PO皂化废水污泥菌群经驯化可利用含VFAs废水合成PHA。利用 16S rDNA高通量测序,检测了驯化前后污泥菌群的变化情况,推测芽孢杆菌、不动杆菌、短波单胞菌及假单胞菌等为污泥中可能合成PHA的微生物。
越来越多的优势菌株被筛选和鉴定,在基因水平上证明了活性污泥来源的微生物具有较强的PHA合成潜力。Janarthanan等[29]通过对污泥样品中的菌群进行基因测序,分析了PHA合成菌群的多样性和丰富度以及MMCs (Mixed microbial cultures,微生物混合培养) 的动态变化,评估出该条件中PHA合成的潜力。因此利用高通量测序技术研究污泥中PHA菌群的结构能够更好地使PHA生产工艺和废水的处理相结合。
5 展望
随着高通量测序技术的不断发展,未来有关混合培养合成PHA研究领域的重点方向将是从生物多样性出发深入研究合成PHA菌群的特征及相关代谢途径等[52]。另外,借鉴陈国强等开发的蓝水生物技术的研究经验[69],从驯化富集的污泥中筛选PHA合成优势菌株,并在开放条件下利用污泥水解酸化产生的VFAs为碳源合成PHA,也可能会成为混合培养合成PHA研究的一个主要方向。
[1] Reddy CSK, Ghai R, Rashmi, et al. Polyhydroxyalkanoates: an overview. Bioresour Technol, 2003, 87(2): 137–146.
[2] Ivanov V, Stabnikov V, Ahmed Z, et al. Production and applications of crude polyhydroxyalkanoate- containing bioplastic from the organic fraction of municipal solid waste. Int J Environ Sci Technol, 2015, 12(2): 725–738.
[3] Sudesh K, Bhubalan K, Chuah JA, et al. Synthesis of polyhydroxyalkanoate from palm oil and some new applications. Appl Microbiol Biotechnol, 2011, 89(5): 1373–1386.
[4] 国家发展改革委网站. 《“十三五”全国城镇污水处理及再生利用设施建设规划》[EB/OL]. (2016-12-31). http://www.ndrc.gov.cn/zcfb/zcfbtz/201701/t20170122_836015.html.
[5] Morgan-Sagastume F, Hjort M, Cirne D, et al. Integrated production of polyhydroxyalkanoates (PHAs) with municipal wastewater and sludge treatment at pilot scale. Bioresour Technol, 2015, 181: 78–89.
[6] van Loosdrecht MCM, Brdjanovic D. Anticipating the next century of wastewater treatment. Science, 2014, 344(6191): 1452–1453.
[7] Pittmann T, Steinmetz H. Potential for polyhydroxyalkanoate production on German or European municipal waste water treatment plants. Bioresour Technol, 2016, 214: 9–15.
[8] Valentino F, Morgan-Sagastume F, Fraraccio S, et al. Sludge minimization in municipal wastewater treatment by polyhydroxyalkanoate (PHA) production. Environ Sci Pollut Res, 2015, 22(10): 7281–7294.
[9] Morgan-Sagastume F, Heimersson S, Laera G, et al. Techno-environmental assessment of integrating polyhydroxyalkanoate (PHA) production with services of municipal wastewater treatment. J Cleaner Prod, 2016, 137: 1368–1381.
[10] Appels L, Baeyens J, Degrève J, et al. Principles and potential of the anaerobic digestion of waste- activated sludge. Prog Energy Combust Sci, 2008, 34(6): 755–781.
[11] Yuan Q, Sparling R, Oleszkiewicz JA. VFA generation from waste activated sludge: Effect of temperature and mixing. Chemosphere, 2011, 82(4): 603–607.
[12] Liu XG, Dong B, Dai XH. Hydrolysis and acidification of dewatered sludge under mesophilic, thermophilic and extreme thermophilic conditions: Effect of pH. Bioresour Technol, 2013, 148: 461–466.
[13] Hao JX, Wang H. Volatile fatty acids productions by mesophilic and thermophilic sludge fermentation: Biological responses to fermentation temperature. Bioresour Technol, 2015, 175: 367–373.
[14] Liu H, Wang J, Liu XL, et al. Acidogenic fermentation of proteinaceous sewage sludge: Effect of pH. Water Res, 2012, 46(3): 799–807.
[15] Zhang P, Chen YG, Zhou Q. Waste activated sludge hydrolysis and short-chain fatty acids accumulation under mesophilic and thermophilic conditions: Effect of pH. Water Res, 2009, 43(15): 3735–3742.
[16] Cheah YK, Vidal-Antich C, Dosta J, et al. Volatile fatty acid production from mesophilic acidogenic fermentation of organic fraction of municipal solid waste and food waste under acidic and alkaline pH. Environ Sci Pollut Res, 2019: 1–14, doi: 10.1007/s11356-019-05394-6.
[17] Moretto G, Valentino F, Pavan P, et al. Optimization of urban waste fermentation for volatile fatty acids production. Waste Manage, 2019, 98: 21–29.
[18] Cokgor EU, Oktay S, Tas DO, et al. Influence of pH and temperature on soluble substrate generation with primary sludge fermentation. Bioresour Technol, 2009, 100(1): 380–386.
[19] Lim SJ, Kim BJ, Jeong CM, et al. Anaerobic organic acid production of food waste in once-a-day feeding and drawing-off bioreactor. Bioresour Technol, 2008, 99(16): 7866–7874.
[20] Tang JL, Wang XC, Hu YS, et al. Lactic acid fermentation from food waste with indigenous microbiota: Effects of pH, temperature and high OLR. Waste Manage, 2016, 52: 278–285.
[21] Wijekoon KC, Visvanathan C, Abeynayaka A. Effect of organic loading rate on VFA production, organic matter removal and microbial activity of a two-stage thermophilic anaerobic membrane bioreactor. Bioresour Technol, 2011, 102(9): 5353–5360.
[22] Lee WS, Chua ASM, Yeoh HK, et al. A review of the production and applications of waste-derived volatile fatty acids. Chem Eng J, 2014, 235: 83–99.
[23] Feng L, Wang H, Chen YG, et al. Effect of solids retention time and temperature on waste activated sludge hydrolysis and short-chain fatty acids accumulation under alkaline conditions in continuous-flow reactors. Bioresour Technol, 2009, 100(1): 44–49.
[24] Yuan Q, Sparling R, Oleszkiewicz JA. Waste activated sludge fermentation: Effect of solids retention time and biomass concentration. Water Res, 2009, 43(20): 5180–5186.
[25] Jia QQ, Xiong HL, Wang H, et al. Production of polyhydroxyalkanoates (PHA) by bacterial consortium from excess sludge fermentation liquid at laboratory and pilot scales. Bioresour Technol, 2014, 171: 159–167.
[26] Liu ZG, Wang YP, He N, et al. Optimization of polyhydroxybutyrate (PHB) production by excess activated sludge and microbial community analysis. J Hazard Mater, 2011, 185(1): 8–16.
[27] Bengtsson S. The utilization of glycogen accumulating organisms for mixed culture production of polyhydroxyalkanoates. Biotechnol Bioeng, 2010, 104(4): 698–708.
[28] Suriyamongkol P, Weselake R, Narine S, et al. Biotechnological approaches for the production of polyhydroxyalkanoates in microorganisms and plants- A review. Biotechnol Adv, 25(2): 148–175.
[29] Janarthanan OM, Laycock B, Montano-Herrera L, et al. Fluxes in PHA-storing microbial communities during enrichment and biopolymer accumulation processes. New Biotechnol, 2015, 33(1): 61–72.
[30] Beccari M, Bertin L, Dionisi D, et al. Exploiting olive oil mill effluents as a renewable resource for production of biodegradable polymers through a combined anaerobic-aerobic process. J Chem Technol Biotechnol, 2009, 84(6): 901–908.
[31] Oliveira CSS, Silva CE, Carvalho G, et al. Strategies for efficiently selecting PHA producing mixed microbial cultures using complex feedstocks: Feast and famine regime and uncoupled carbon and nitrogen availabilities. New Biotechnol, 2016, 37: 69–79.
[32] Korkakaki E, Mulders M, Veeken A, et al. PHA production from the organic fraction of municipal solid waste (OFMSW): Overcoming the inhibitory matrix. Water Res, 2016, 96: 74–83.
[33] Zhang Y, Wusiman A, Liu X, et al. Polyhydroxyalkanoates (PHA) production from phenol in an acclimated consortium: Batch study and impacts of operational conditions. J Biotechnol, 2018, 267: 36–44.
[34] Fleit E. Intracellular pH regulation in biological excess phosphorus removal systems. Water Res, 1995, 29(7): 1787–1792.
[35] Oehmen A, Pinto F V, Silva V, et al. The impact of pH control on the volumetric productivity of mixed culture PHA production from fermented molasses. Eng Life Sci, 2014, 14(2): 143–152.
[36] Deng Y. Process stability of polyhydroxyalkanoates production using acidogic waste water[D]. Harbin: Harbin Institute of Technology, 2012 (in Chinese). 邓毅. 废水产酸合成聚羟基烷酸酯工艺稳定运行研究[D]. 哈尔滨: 哈尔滨工业大学, 2012.
[37] Albuquerque MGE, Torres CAV, Reis MAM. Polyhydroxyalkanoate (PHA) production by a mixed microbial culture using sugar molasses: Effect of the influent substrate concentration on culture selection. Water Res, 2010, 44(11): 3419–3433.
[38] Guo ZR. Research on new progress of PHA production using activated sludge based on dynamic pulse discharge-aerobic dynamic feeding mode[D]. Harbin: Harbin Institute of Technology, 2016 (in Chinese). 郭子瑞. 基于动态间歇排水瞬时补料的活性污泥合成PHA新工艺研究[D]. 哈尔滨: 哈尔滨工业大学, 2016.
[39] Serafim LS, Lemos PC, Oliveira R, et al. Optimization of polyhydroxybutyrate production by mixed cultures submitted to aerobic dynamic feeding conditions. Biotechnol Bioeng, 2004, 87(2): 145–160.
[40] Albuquerque MGE, Martino V, Pollet E, et al. Mixed culture polyhydroxyalkanoate (PHA) production from volatile fatty acid (VFA)-rich streams: Effect of substrate composition and feeding regime on PHA productivity, composition and properties. J Biotechnol, 2011, 151(1): 66–76.
[41] Wang XF, Bengtsson S, Oehmen A, et al. Application of dissolved oxygen (DO) level control for polyhydroxyalkanoate (PHA) accumulation with concurrent nitrification in surplus municipal activated sludge. New Biotechnol, 2019, 50: 37–43.
[42] Zheng YD, Zhong QH, Ma WS, et al. Biosynthesis of PHA from anaerobic-aerobic activated sludge process. Res Environ Sci, 2001, 14(2): 41–44 (in Chinese). 郑裕东, 钟青华, 马文石, 等. 厌氧-好氧驯化活性污泥生物合成PHA的研究. 环境科学研究, 2001, 14(2): 41–44.
[43] Chen ZQ, Huang L, Wen QX, et al. Efficient polyhydroxyalkanoate (PHA) accumulation by a new continuous feeding mode in three-stage mixed microbial culture (MMC) PHA production process. J Biotechnol, 2015, 209: 68–75.
[44] Wang YP, Cai JY, Lan JH, et al. Biosynthesis of poly(hydroxybutyrate-hydroxyvalerate) from the acclimated activated sludge and microbial characterization in this process. Bioresour Technol, 2013, 148: 61–69.
[45] Rodriguez-Perez S, Serrano A, Pantión AA, et al. Challenges of scaling-up PHA production from waste streams. A review. J Environ Manage, 2018, 205: 215–230.
[46] Palmeiro-Sánchez T, Fra-Vázquez A, Rey-Martínez N, et al. Transient concentrations of NaCl affect the PHA accumulation in mixed microbial culture. J Hazard Mater, 2016, 306: 332–339.
[47] Ribeiro PLL, Silva GDS, Druzian JI. Evaluation of the effects of crude glycerol on the production and properties of novel polyhydroxyalkanoate copolymers containing high 11-hydroxyoctadecanoate byIPT 029 andIPT 429. Polym Adv Technol, 2016, 27(4): 542–549.
[48] Villano M, Beccari M, Dionisi D, et al. Effect of pH on the production of bacterial polyhydroxyalkanoates by mixed cultures enriched under periodic feeding. Process Biochem, 2010, 45(5): 714–723.
[49] Zheng X, Su YL, Li X, et al. Pyrosequencing reveals the key microorganisms involved in sludge alkaline fermentation for efficient short-chain fatty acids production. Environ Sci Technol, 2013, 47(9): 4262–4268.
[50] Schmidt M, Ienczak JL, Quines LK, et al. Poly(3-hydroxybutyrate--3-hydroxyvalerate) production in a system with external cell recycle and limited nitrogen feeding during the production phase. Biochem Eng J, 2016, 112: 130–135.
[51] Chen GQ, Jiang XR. Engineering bacteria for enhanced polyhydroxyalkanoates (PHA) biosynthesis. Synth Syst Biotechnol, 2017, 2(3): 192–197.
[52] Wang Q. Biosynthesis, biodegradation and molecular evolution of polyhydroxyalkanonates in[D]. Ji’nan: Shandong University, 2009 (in Chinese). 王倩. 聚羟基脂肪酸酯在大肠杆菌中的合成、降解以及分子改造[D]. 济南: 山东大学, 2009.
[53] Jendrossek D, Schirmer A, Schlegel HG. Biodegradation of polyhydroxyalkanoic acids. Appl Microbiol Biotechnol, 1996, 46(5/6): 451–463.
[54] Alvarez HM, Pucci OH, Steinbuchel A. Lipid storage compounds in marine bacteria. Appl Microbiol Biotechnol, 1997, 47(2): 132–139.
[55] Jendrossek D. Peculiarities of PHA granules preparation and PHA depolymerase activity determination. Appl Microbiol Biotechnol, 2007, 74(6): 1186–1196.
[56] Huisman GW, Wonink E, Meima R, et al. Metabolism of Poly(3-hydroxyalkanoates) (PHAs) by pseudomonas oleovorans. Identification and sequences of genes and function of the encoded proteins in the synthesis and degradation of PHA. J Biol Chem, 1991, 266(4): 2191–2198.
[57] Doi Y, Kanesawa Y, Kunioka M, et al. Biodegradation of microbial copolyesters: poly(3-hydroxybutyrate-co-3-hydroxyvalerate) and poly(3-hydroxybutyrate-co-4-hydroxybutyrate). Macromolecules, 1990, 23(1): 26–31.
[58] PötterM, Steinbüchel A. Poly (3-hydroxybutyrate) granule-associated proteins: impacts on poly (3-hydroxybutyrate) synthesis and degradation. Biomacromolecules, 2005, 6(2): 552–560.
[59] Cho M, Brigham CJ, Sinskey AJ, et al. Purification of polyhydroxybutyrate synthase from its native organism,: implications for the initiation and elongation of polymer formation in vivo. Biochemistry, 2012, 51(11): 2276–2288.
[60] Kuchta K, Chi LF, Fuchs H, et al. Studies on the influence of phasins on accumulation and degradation of PHB and nanostructure of PHB granules inH16. Biomacromolecules, 2007, 8(2): 657–662.
[61] Moldes C, García P, García JL, et al.immobilization of fusion proteins on bioplastics by the novel tag BioF. Appl Environ Microbiol, 2004, 70(6): 3205–3212.
[62] Maestro B, Galán B, Alfonso C, et al. A new family of intrinsically disordered proteins: structural characterization of the major Phasin PhaF fromKT2440. PLoS ONE, 2013, 8(2): e56904.
[63] Wang Q, Xia YZ, Chen Q, et al. Incremental truncation of PHA synthases results in altered product specificity. Enzyme Microb Technol, 2012, 50(6/7): 293–297.
[64] Ciesielski S, Pokoj T, Klimiuk E. Molecular insight into activated sludge producing polyhydroxyalkanoates under aerobic–anaerobic conditions. J Ind Microbiol Biotechnol, 2008, 35(8): 805–814.
[65] Yang C, Zhang W, Liu RH, et al. Analysis of polyhydroxyalkanoate (PHA) synthase gene and PHA-producing bacteria in activated sludge that produces PHA containing 3-hydroxydodecanoate. FEMS Microbiol Lett, 2013, 346(1): 56–64.
[66] Wang DB, Zeng GM, Chen YG, et al. Effect of polyhydroxyalkanoates on dark fermentative hydrogen production from waste activated sludge. Water Res, 2015, 73: 311–322.
[67] Oshiki M, Onuki M, Satoh H, et al. Microbial community composition of polyhydroxyalkanoate- accumulating organisms in full-scale wastewater treatment plants operated in fully aerobic mode. Microbes Environ, 2013, 28(1): 96–104.
[68] Wang YW, Zhu Y, Gu PF, et al. Biosynthesis of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) by bacterial community from propylene oxide saponification wastewater residual sludge. Int J Biol Macromol, 2017, 98: 34–38.
[69] Yin J, Che XM, Chen GQ. Progress on polyhydroxyalkanoates (PHA). Chin J Biotech, 2016, 32(6): 726–737 (in Chinese).尹进, 车雪梅, 陈国强. 聚羟基脂肪酸酯的研究进展. 生物工程学报, 2016, 32(6): 726–737.
Advances in synthesis of polyhydroxyalkanoates by using residual activated sludge
Dong Meng, Ruirui Li, Yuling Liu, Xiangyu Fan, Zhaosong Huang, Pengfei Gu, and Qiang Li
,’,’250022,,
Pure microbial fermentation is the primary means of polyhydroxyalkanoates (PHA) production at present, but high cost limits its large-scale application. In recent years, the synthesis of PHA by mixed microbial culture of activated sludge has been extensively studied. Combining the residual sludge treatment with PHA synthesis not only eliminates the sterilization process necessary for pure culture, but also utilizes residual sludge as resource. The hydrolysis and acidification of the residual sludge, the enrichment and acclimation of the consortium and the PHA synthesis are affected by environmental factors. The intensive biosynthesis mechanism study is helpful for the application of mixed culture to synthesize PHA. This paper introduces the feasibility of using residual sludge to synthesize PHA, the factors affecting the hydrolysis and acidification of residual sludge, the accumulation and domestication of PHA by sludge microbial consortium and its mechanism.
polyhydroxyalkanoates, activated sludge, volatile fatty acids, mixed microbial culture
July9, 2019;
August 26, 2019
National Natural Science Foundation of China (Nos.31870105, 31741007).
Qiang Li. Tel: +86-531-82767364; Fax: +86-531-89736818; E-mail: chm_liq@ujn.edu.cn
国家自然科学基金 (Nos.31870105, 31741007) 资助。
2019-09-09
http://kns.cnki.net/kcms/detail/11.1998.Q.20190906.1035.001.html
孟栋, 李枘枘, 刘玉玲, 等. 利用剩余活性污泥合成聚羟基脂肪酸酯的研究进展. 生物工程学报, 2019, 35(11): 2165–2176.
Meng D, Li RR, Liu YL, et al. Advances in synthesis of polyhydroxyalkanoates by using residual activated sludge. Chin J Biotech, 2019, 35(11): 2165–2176.
(本文责编 郝丽芳)
