乳饮料中苯甲酸快速检测试剂盒的研制及应用
2019-12-09陈百科蔡锦明王钰鑫韩如雁陈涔潘家荣郑方媛
陈百科,蔡锦明,王钰鑫,韩如雁,陈涔,潘家荣,郑方媛
(中国计量大学生命科学学院,杭州310018)
0 引 言
苯甲酸是弱酸,能形成盐、酯、酰卤、酰胺、酸酐等不易被氧化化合物。在酸性条件下,对霉菌、酵母和细菌均有抑制作用而作为食品、饲料、乳胶和牙膏的防腐剂,尤其作为乳饮料中的添加剂。《GB2760-2014食品添加剂使用标准》中规定各种饮料中苯甲酸的最大使用量和限量,如碳酸饮料,最大使用量为0.2 g/kg;低盐酱菜、酱类、蜜饯,0.5 g/kg;葡萄酒、果酒、软糖,0.8 g/kg;酱油、食醋、果酱(不包括罐头)、果汁(味)型饮料,1.0 g/kg;食品工业用塑料桶装浓缩果蔬汁,2.0 g/kg;果汁(果味)冰,1.0 g/kg(混用或单独使用)[1]。由于添加剂的不合理使用,当前饮品中苯甲酸含量超标使用的 常
苯用甲方 酸法超有高标效检液测相是色饮谱品法监(管H的PL一C)部[2]分、气,目相前色检谱测法(法G(C H)P[3]L、C气-相M色S)谱[5]、质毛谱细法管(电G泳C-法M[6S]、)紫[4]外、液分相光色光谱度质法谱[7]以食及品薄安层全层国析家法标[8]准等。食在品国中家苯标甲准酸中、,《山G梨B酸50和09糖.28精-钠20的16测方定法》前中处采理用繁的琐也、是耗液时相长色,仪谱器法操和作气需相要色专谱业法技,这术些人员,难以现场快速检测。现象经常发生,对消费者的生命健康造成伤害。
针对上述问题,本项目根据免疫分析原理,建立饮品中苯甲酸免疫分析技术,研制酶联免疫分析试剂盒,以满足企业与基层单位对液态奶中苯甲酸钠残留作现场检测和批量检测的需求,为饮品中苯甲酸的现场快速检测提供了技术支撑,具有科学价值和重要意义。
1 材料与方法
1.1 材料和试剂
牛血清白蛋白(BSA)、鸡卵白蛋白(OVA)(阿拉丁生化科技股份有限公司);对氨基苯甲酸、、碳酸钾、尿素、亚硝酸钠、氯化钠、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、柠檬酸(杭州米克化工仪器有限公司);辣根过氧化物酶标记抗兔(IgG)、弗氏完全佐剂、弗氏不完全佐剂(上海佑隆生物科技有限公司)。
缓冲液 PBS(0.01 mol/L,pH 7.4):磷酸二氢钾0.27 g,磷酸氢二钠1.42 g,氯化钠8 g,氯化钾0.2 g,加去离子水约800 mL充分搅拌溶解,加入浓盐酸调p H至7.4,定容到1 L。
封闭液:0.2%脱脂奶粉的PBS溶液。
底物缓冲液(p H 5.0磷酸-柠檬酸缓冲液):0.2 mol/L磷酸氢二钠(28.4 g/L)25.7 mL,0.1 mol/L柠檬酸(19.2 g/L)24.3 mL,加蒸馏水至100 mL。
TMB(3,3’5,5’-四甲基联苯胺二盐酸)底物使用液:TMB(10mg/5mL无水乙醇)0.5 mL,底物缓冲液(pH O.5)10mL,30%H H2SO410μL。(临用时新鲜配制,H2SO4在临用前加入,配后立即使用)
终止液(2 mol/L H2SO4):取蒸馏水177.8 mL,逐滴加入98%浓硫酸22.2 mL。
1.2 仪器
酶标仪(赛默飞世尔科技公司)、恒温水浴锅(上海一恒科技有限公司)、磁力搅拌仪(江苏省金坛市荣华仪器制造有限公司),全波长紫外分光光度仪(上海元析仪器有限公司)。
1.3 实验方法
1.3.1 免疫抗原和包被抗原的制备
取800 mg对氨基苯甲酸,400 mg亚硝酸钠溶于10 mL三蒸水中,置冰浴中搅拌20 min,加少量尿素得重氮盐溶液。逐滴加入BSA溶液(500 mg BSA溶于25 mL PBS溶液中),避光搅拌48 h后将其置于透析袋中,4℃下用PBS液透析两天,期间多次换液,至透析袋外液几乎无色为止,取透析袋内容物,用PBS液调至50 mL,即为对氨基苯甲酸-BSA,分装后冷冻干燥,置于-20℃冰箱中保存。反应方程式如下:
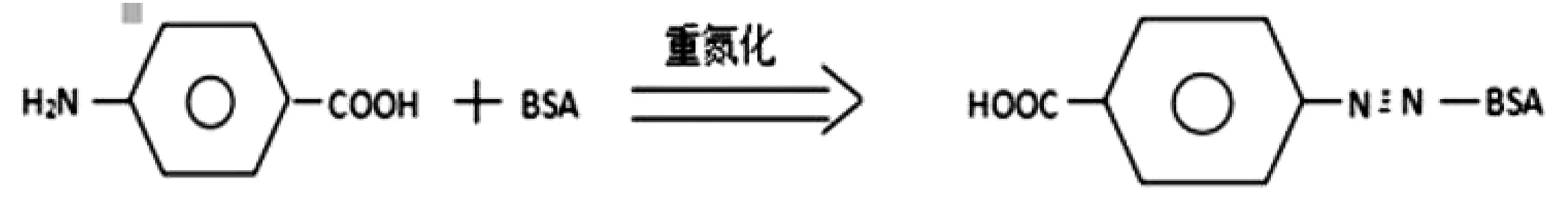
包被抗原制备方法同上,将BSA换为OVA即可。用紫外可见分光光度计鉴定。
1.3.2 抗体的制备
取2月龄雌性新西兰大白兔两只采用大腿肌肉多点注射的方式进行三次免疫。每次每只新西兰大白兔抗原免疫用量为500μg,初次免疫用等量弗氏完全佐剂乳化,第二次免疫用等量弗氏不完全佐剂乳化,第三次用等量生理盐水混合,耳静脉注射。第二次免疫后14 d静脉采血,通过间接法测抗体效价,以此确定是否有针对目标的抗体生成。效价达标后第三次进行加强免疫;效价不达标,则第三次继续弗氏不完全佐剂皮下进行免疫,28 d后第四次进行加强免疫。加强免疫14 d后取血。血清离心取上清,经Protein-A柱进行纯化,得到多克隆抗体,测定效价、亲和常数和特异性。
1.3.3 ELISA试剂盒的研制
根据棋盘稀释法用PBS稀释包被原(5、10、15、20、25、30、35、40、45、50μg等)和抗体(1∶100、1∶200、1∶500、1∶1000等),在酶标板上加入包被原120μL/孔,4℃过夜,弃去溶液,PBS冲洗3次;加入封闭液150μL/孔,37℃温育1 h,弃去溶液,PBS冲洗3次;加入系列抗体溶液50μL/孔37℃温育1 h,弃去溶液,PBS冲洗3次。加入酶标记抗IgG(1∶8000)100μL/孔37℃30 min,弃去溶液,PBS冲洗3次。再加底物TMB 100μL/孔,37℃温育15 min后加50μL终止液终止反应。
1.3.4 试剂盒检测限、精密度测定
在酶标仪上测定反应液吸光值(450 nm),取吸光值为1的组合作为最适包被浓度和抗体浓度。配制苯甲酸标准浓度系列,按ELISA测定吸光值,计算结合率,结合率对苯甲酸浓度的对数作曲线,得到苯甲酸酶联免疫分析标准曲线,从而得出检出限。利用ELISA检测试剂盒测定牛奶、果汁和葡萄酒样品,通过同一次测定中各平行样本的变异系数(批内变异系数)和同一样本在不同批次测定中的重复性(批间变异系数)反应试剂盒的重复性和稳定性。
1.3.5 前处理技术研究
取不同饮品样品(乳品、乳酸饮料、果汁等),每份1 mL,按0.03、0.3、3μg/mL的比例添加标准苯甲酸溶液,每个样品设3个重复,再添加等量的乙腈、水和甲醇,3 000 r/min条件下离心2 min,取上清进行检测(本试验得到的酶联免疫试剂盒)。根据回收率结果得到适合的提取试剂和方法。
2 结果与分析
2.1 ELISA试剂盒
2.1.1 紫外可见分光光度计鉴定人工抗原
图1、图2说明BSA、对氨基苯甲酸、BSA蛋白与对氨基苯甲酸偶联产物三者的紫外吸收光谱均有明显的差异(OVA类同)。人工抗原对氨基苯甲酸-BSA、对氨基苯甲酸-OVA分别在236、223 nm处有明显的出峰;对氨基苯甲酸在248 nm处有出峰;相对平缓;OVA在210 nm、279 nm处有出峰。三条曲线峰值有明显的改变,说明人工抗原相对于对氨基苯甲酸和OVA在化学结构上发生了变化,证明对氨基苯甲酸成功地偶联到证明载体蛋白上。
计算可得BSA蛋白和对氨基苯甲酸偶联产物偶联比25,蛋白质含量为178;OVA蛋白和对氨基苯甲酸偶联产物偶联比为73,蛋白质含量为140。即在该反应体系中和反应条件下,合成的人工抗原中,半抗原与载体BS的偶联比率约为25∶1。
2.1.2 抗原效价测定
表1表明单克隆抗体效价达到1∶243 000。
2.1.3 抗体的亲和常数计算
亲和常数K=150 000/(滴度×抗体浓度)=150 000/[(1/243 000)×1]=3.645×1 010,由此计算结果可知抗体具有良好的亲和性。
2.1.4 抗体的交叉反应
表2表明抗体的交叉反应率均较低,说明制备的抗体有良好的特异性。

图1 BSA蛋白,对氨基苯甲酸及BSA蛋白与对氨基苯甲酸偶联产物的紫外分光光谱

图2 OVA蛋白,对氨基苯甲酸及OVA蛋白与对氨基苯甲酸偶联产物的紫外分光光谱
2.1.5 苯甲酸抗体与包被原最佳工作浓度的确定
由表3中可以看出,当OD450在1.0左右时,抗原浓度为1.5μg/mL,抗体稀释浓度为1.0μg/mL,以此作为本实验抗原抗体的最佳工作浓度。
2.1.6 标准曲线及线性分析
由图3可得,间接ELISA法分析线性方程为:y=-0.4787x+1.6904,苯甲酸在0.03~3 mg/L范围内,结合率与苯甲酸浓度的对数值呈显著的线性关系,相关系数R2=0.997,检出限为0.027 mg/L。
2.1.7 ELISA试剂盒测样的精密度测定
由表4的实验结果可以看出,ELISA试剂盒的平均批内变异系数和批间变异系数均小于7.51%。
2.1.8 回收率及与GC的对比实验
从表5可以看出,ELISA的平均回收率是93.29%,G 96C.2的1%平。均回收率是96.97%,这两者的相符率在
2.1.9 ELISA试剂盒的组成
(1)包被苯甲酸包被原的96孔酶标板一块;

表1 兔单克隆抗体效价测定

表2 抗体交叉率表
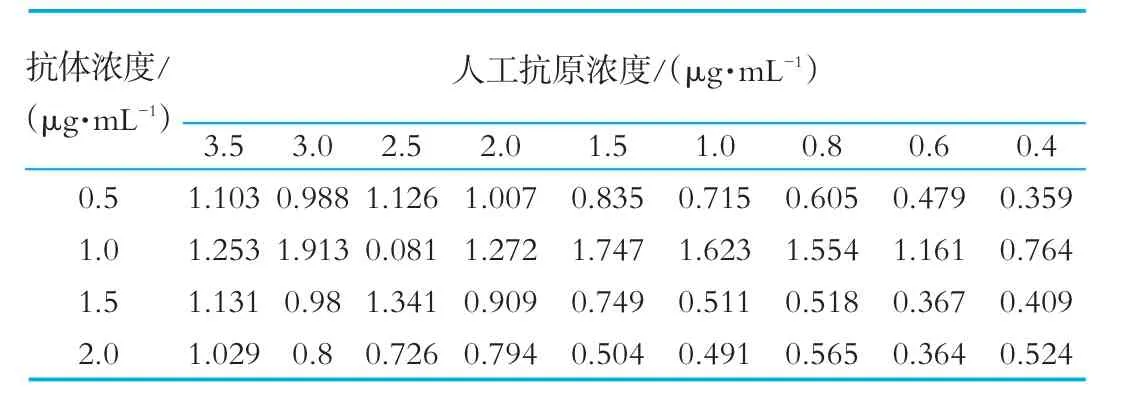
表3 苯甲酸抗体与包被原最佳工作浓度

图3 间接ELISA测得的苯甲酸的标准曲线
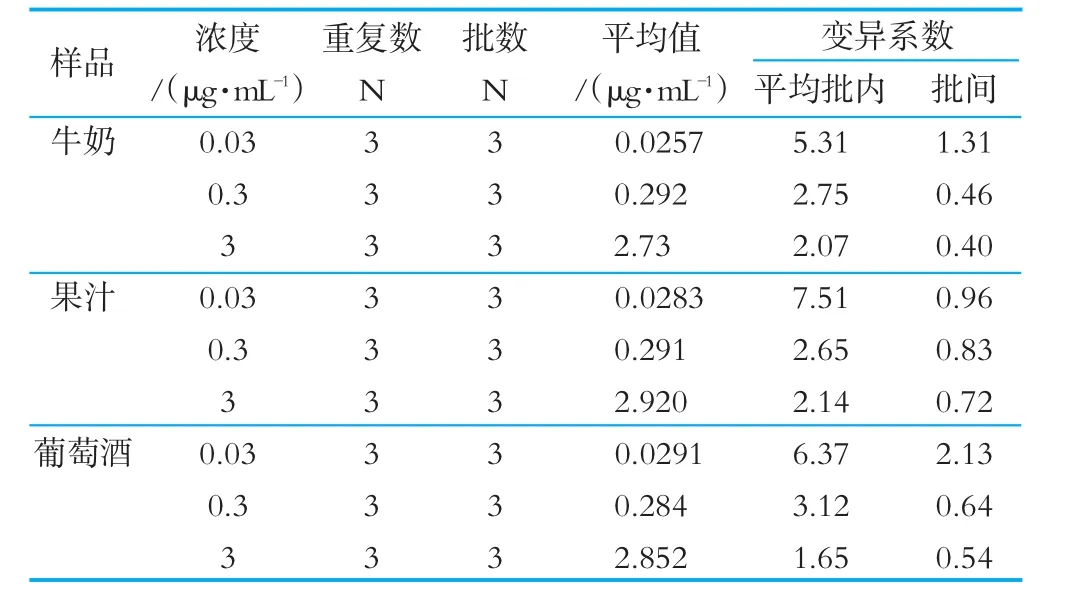
表4 间接竞争ELISA试剂盒测样的精密度
(2)苯甲酸抗体一瓶;
(3)抗体稀释液一瓶;
(4)洗涤液一瓶;
(5)辣根过氧化物酶标记的羊抗兔IgG一瓶;
(6)酶标二抗稀释液一瓶;
(7)底物及显色液各一瓶;
(8)终止液一瓶。
2.2 前处理技术
从表6中可知,利用甲醇对不同饮品样品中的苯甲酸进行提取,离心过滤后,取上清进行检测,有较高的回收率。
因此,前处理方法为取5 mL饮品样品,加入等量甲醇溶液,3 000 r/min条件下离心2 min,取上清进行检测。
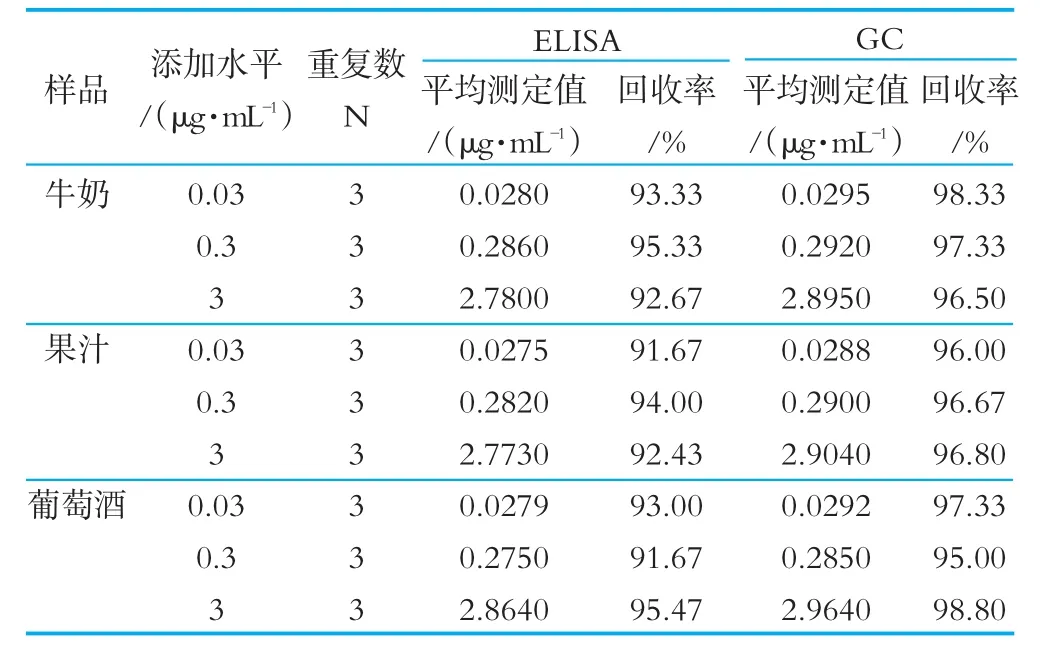
表5 样品中添加苯甲酸的回收率与GC对比实验
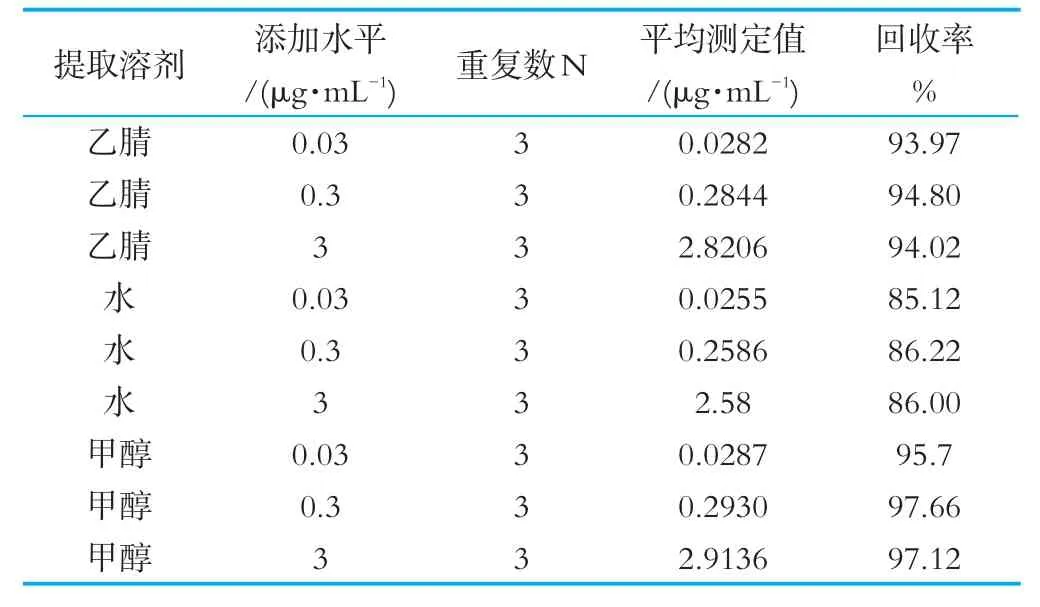
表6 以牛奶为例研究不同溶剂对苯甲酸的回收率的影响
3 讨 论
的检
目前我国苯甲酸超标使用现象仍时有发生,传统的检测方法有高效液相色谱法[9-11]气相色谱法[12-13]及其联用质谱法[14-15]等。王克新等[16]利用高效液相色谱法测定乳制品中的苯甲酸和山梨酸含量,其中苯甲酸的最低检出量为1.5×>10-9g,回收率为99.93%,变异系数为0.22%。舒平等[15]以固相微萃取-气相色谱质谱联用法(SPME-GC/MS)分析测定原料乳中苯甲酸,检出限和定量限分别为0.2mg/L和0.5mg/L,平均回收率为83.2%~97.9%。虽然这类方法的灵敏度较高,结果稳定,但是样品的预处理操作较为繁琐,测定周期长,但是所需仪器较为昂贵。以免疫化学为基础ELISA检测试剂盒属于超微量分析技术[17-18],主要是以抗原或抗体的固相化及其酶标记为基础,具有快速、灵敏经济、简便的特点,适合大批量样品筛查,但国内外鲜有用于检测乳制品中苯甲酸含量的研究报道。因此,研制乳饮料中苯甲酸的快速检测试剂盒,对方便现场快速检测和维护人们食品健康具有重要的科学价值和研究意义。
本研究根据免疫分析原理和苯甲酸的结构特点,选择对氨基苯甲酸作为偶联物,既突出了以苯甲酸整个结构作为特异结构,可提高特异性,有具备合适的偶联臂,能得到抗体。以对氨基苯甲酸为半抗原成功合成了免疫抗原和包被抗原,同时针对饮品中苯甲酸的检测作了系统性的探讨,建立了用于检测饮品中苯甲酸的免疫分析技术,酶联免疫分析试剂盒的检测限分别为0.027 mg/L,本法所用的抗体与其他参与实验的结构类似物没有反应,说明具有较高的特异性。对加标试样的回收率均符合技术要求,批间批内变异系数均较低。该种方法都具有快速、简便、特异、安全等特点,试剂盒可在3 h内完成实验,且准确性较高,为饮品中苯甲酸的现场快速检测提供了技术支撑,具有科学价值和重要意义。可以预见,该试剂盒在饮品中苯甲酸含量的现场检测和批量检测中有广阔的应用前景。
4 结论
本研究基于免疫分析原理,通过合成苯甲酸免疫原和包被原,制备抗体,优化包被原浓度和抗体稀释度,研制酶联免疫分析试剂盒,用于乳饮料中苯甲酸含量的快速检测。该试剂盒检测限为0.027 mg/L,与现有检测方法相比,该试剂盒具有样品前处理简单、灵敏、快速等优点,适合基层单位和中小企业对乳饮料中苯甲酸的含量作现场检测和批量检测。
