胰岛素样生长因子-1衍生物的研究进展
2019-12-06李佳楠
谢 倩,李佳楠
(江汉大学 生命科学学院生物技术系,湖北 武汉 430056)
0 引言
胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是一种单肽链(7.5 ku)的稳态调节因子,它可以在几乎所有的身体组织中以内分泌、旁分泌和自分泌的方式产生,参与了机体的许多合成和代谢过程,在生长、发育、寿命控制和衰老等方面发挥着重要作用[1-4]。因为IGF-1 对人体具有广泛的生物学作用,如降血糖、降血脂、促生长、修复神经损害和增强免疫功能等[5],因此许多生物制药公司对于IGF-1 蛋白的药物开发投入了大量的精力和财力,但由于IGF-1 作为药物开发存在表达难的缺点,并且IGF-1 具有促进细胞生长和抗凋亡的作用,会提高机体肿瘤的发生的概率[6],因此,为使IGF-1 成药更具安全性和有效性,其衍生物的开发尤为重要。如何使其既能发挥正面作用同时又克服容易造成的不良反应是目前IGF-1 衍生物研究的难点和热点。
为了使IGF-1 最大程度地发挥其功能,国外许多科研人员正积极研发IGF-1 类似物和衍生物。目前有些发达国家已有一部分研究成果,如美国已有IGF-1 衍生物相关的药物通过了FDA 的审批,而我国IGF-1 衍生物尚处于研究阶段。随着生物医学的迅速发展,对于IGF-1 的衍生物的研究也日益成熟,相信在不久的将来,IGF-1 衍生物相关的药物可以为人类的健康提供一定的帮助。
1 IGF-1的生物学特征及功能
1.1 IGF-1的结构与IGF-1调控系统
IGF 家族包括胰岛素、IGF-1 和IGF-2,后二者因与胰岛素结构相似而得名。IGF-1 有70 个氨基酸残基,相对分子量为7.649 ku,等电点约为8.2[7],有3 对分子内的二硫键,IGF-1 与胰岛素原的同源性高达49%,IGF-1 与胰岛素原均含有A、B、C 3 个区域,但IGF-1 的羧基末端比胰岛素原多一个D 区域,A链和B 链由二硫键衔接,C 肽为连接肽,比胰岛素的C 肽略短。IGF-1 的结构如图1所示。

图1 IGF-1 结构示意图Fig.1 Structure of IGF-1
胰岛素样生长因子家族包括IGF-1、IGF-2、IGF-1 受体(insulin-like growth factor-1 receptor,IGF-1R)、IGF-2R、与IGF 有高度亲和力的6 种胰岛素样生长因子结合蛋白(insulin-like growth factor binding proteins,IGFBPs)以及IGFBP 降解蛋白酶类。胰岛素样生长因子系统如图2所示[8]。
人体许多组织如肾脏、大脑、肺等都可产生IGF-1,而在正常生物体内则主要由肝脏进行合成,这也是血液中存在大量IGF-1 复合物的原因。IGF-1R 是一种跨膜酪氨酸激酶蛋白,它是由α、β 两个亚单位组成的四聚体结构,介导了IGF-1 和绝大部分IGF-2 的生物学活性[9]。在体内循环系统中,血液中游离的IGF-1 非常少,研究[10]表明体内游离的IGF-1 过高可能会有致癌致肿瘤的风险,循环系统中约99%的IGF-1 会与IGFBP 结合,其中与IGFBP-3 结合最多,IGFBP 对IGF-1 具有抑制和增强的双向调控作用,IGFBP 与IGF-1 结合会占据IGF-1R 的结合位点,从而抑制IGF-1 的生物学活性;而IGFBP 与IGF-1形成的复合物又能保护其免受蛋白酶的降解,延长IGF-1 的半衰期,从而促进IGF-1 发挥其功能。
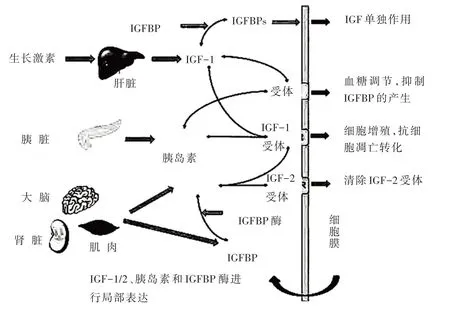
图2 胰岛素样生长因子系统Fig.2 Insulin-like growth factor system
1.2 IGF-1及其衍生物的医学功能
IGF-1 主要有类胰岛素样的促进代谢和有丝分裂的生物学作用。它能促进肌肉细胞对葡萄糖和氨基酸的摄取,增加糖原的合成,减少分解;除此之外还能抑制胰岛素、生长激素水平、C 肽、胰高糖素和肝糖的输出,降低血液中游离的脂肪酸和氨基酸水平;还可以促进细胞增殖,刺激组织细胞的生长与分化。研究[11]证明,生物体血液中IGF-1 降低会增加机体罹患心血管疾病的风险,如冠心病、心肌梗死、心绞痛等;由于IGF-1 参与了骨骼肌的许多合成代谢途径,在调节蛋白质代谢和肌肉功能的通路中起着关键作用,因此IGF-1 在促进生长和肌肉萎缩的治疗中发挥着显著的作用[12];IGF-1 还可以在高含量葡萄糖的情况下体外保护施旺细胞,并减少施旺细胞空泡化,因而IGF-1 在血清指标中对糖尿病神经病变的发生有提示作用,有助于糖尿病周围神经病的及早发现、干预和治疗[13];此外,IGF-1 可以抑制凋亡因子和促进抗凋亡因子的表达,从而具有阻止细胞凋亡的作用,是维持人体年轻最基本的生长因子之一[14]。
IGF-1 在人体的生长代谢和疾病治疗等方面发挥着不可替代的作用,但其带来的增加患癌风险等负面影响也是不可忽视的,因此,对于IGH-1 衍生物的研究就显得尤为重要。虽然IGF-1 具有神经保护作用,对脑损伤有一定的改善,但其分子体积大、中心吸收能力差、有丝分裂潜能小等缺点,限制了其在各种疾病中的临床应用。
1.3 IGF-1的结构研究
IGF-1 的成熟多肽有A、B、C、D 4 个结构域(NH-B-C-A-D-COOH),结构域A、B 分别对应胰岛素的A 链和B 链,其有约50%的同源性;环状结构域C 连接A、B 结构域,相当于胰岛素原的C 肽,而A 结构域的羧基端连接着无规则的D 结构域,在三维结构上,IGF-1 与胰岛素也具有相似的结构,二者都有3 个螺旋结构和3 个分子内二硫键[15]。IGF-1 和胰岛素的三维结构图如图3所示。IGF-1 分子含有3 个α螺旋,第一个螺旋位于Ala8 ~ Val17 氨基酸残基之间,经过 Gly19 ~ Gly22 的β 转角构象之后是Phe23 ~Asn26 的一个延伸结构;第二个螺旋位于Val44 ~Phe49 的残基之间,位于Leu54 ~Met59 残基之间的是第3 个螺旋。IGF-1 分子的3 对二硫键肽链紧密相连,Cys6 ~Cys48 之间的二硫键位于分子表面,而Cys18 ~Cys61 和Cys47 ~关Cys52 之间的二硫键则嵌入蛋白核心中;IGF-1 的疏水核心被3 个α 螺旋和一些多肽骨架包裹在远离溶剂的地方。IGF-1 分子的两个突出区域是C 和D 区域,C 区域的亲水性较强,所以C3 ~C8 远离分子表面,形成非常柔韧的结构,使得所有侧链都处于溶液中,D 区具有发夹结构,2 个侧枝由于疏水作用紧密靠拢,亲水性侧链则暴露于溶液[16]。

图3 胰岛素和IGF-1 的三维结构图Fig.3 Three-dimensional structure diagram of insulin and IGF-1
2 截短型IGF-1
截短型IGF-1 是在完整型IGF-1 的基础上,N 端缺少3 个氨基酸(甘氨酸、脯氨酸、谷氨酸),因此也被称为des(1-3)IGF-1,它最初在胎儿和成人的大脑中被发现,随着研究的深入,在牛的初乳和猪的子宫也发现了 des(1-3)IGF-1,作为体内天然存在的截断型 IGF-1,研究[17]表明,由于 des(1-3)IGF-1 游离的程度较高,而只有游离的IGF-1 才能发挥生物学功能,因此其生物学活性比完整型IGF-1 高出1.4 ~ 10 倍,刺激细胞增殖的能力也较完整型IGF-1 高出10 倍以上,并且des(1-3)IGF-1 具有不同的IGF-1R 和 IGFBP 结合 活性 。
已有研究[18]表明,牛初乳中的短链IGF-1 可以促进淋巴组织增生、调节T 细胞生长与分化,因此推测其体液调节的功能可能在早期治疗糖尿病方面具有积极作用。除此之外,短链IGF-1 还可以降低生长激素水平、调节胰岛素受体,增加脏器组织对胰岛素的敏感性,从而达到对糖尿病慢性并发症的改善。
赵维玲等[19]研究了牛初乳短链胰岛素样生长因子对脂蛋白诱导的肾小球系膜细胞增生与转化生长因子-β1 表达的影响,结果发现加入牛初乳短链胰岛素样生长因子进行干预后,随着短链胰岛素样生长因子水平的升高,肾小球系膜细胞的增殖率降低、凋亡率则升高;并且随着短链胰岛素样生长因子干预时间的延长,肾小球系膜细胞的增殖率也随之降低、凋亡率则随之增高,说明短链胰岛素样生长因子水平可以抑制脂蛋白诱导的肾小球系膜细胞的异常增生,促进脂蛋白诱导的肾小球系膜细胞的凋亡,从而达到治疗儿童增生性肾脏病、防止病变恶化的目的。
谢曌[20]提出了一种截短型的 IGF-1,N 端的 4 个氨基酸(Gly-Pro-Glu-Thr)和中间 C 区的氨基酸Gly-Ser-Ser-Ser-Arg-Arg-Ala 部分序列被酶切去,测序结果显示,此衍生物编码59 个氨基酸,符合预期的目的片段,通过检测此蛋白的活性,显示其在促进动物细胞生长方面的生物学作用十分显著,为深入开展截短型IGF-1 的动物体内活性研究奠定了良好的基础。
截短型IGF-1 比完整型IGF 在体内的稳定性更好,同时也能发挥IGF-1 相应的生物学作用,甚至比IGF-1 对机体的正面效应更为明显,因此des-(1-3)IGF-1 呈现出了很大的发展潜力。
GUAN 等[21]研究了IGF-1 衍生的小神经肽,此衍生物是从IGF-1 的N-末端和环甘氨酸-脯氨酸(cGP)中分离合成得到的一种小神经肽,这种小神经肽具有比IGF-1 更好的药代动力学特性和更实用的给药途径,提供了有效的神经保护作用,这种改良的神经肽可以克服内源性神经肽的局限性,是一种新的神经疾病药物开发手段。
KRAEHNKE 等[22]研究了IGF-1 在标准球团培养和软骨工程用透明质酸(HA)水凝胶中对骨髓间充质干细胞软骨分化的影响,通过定量生化分析发现,IGF-1 和des(1-3)IGF-1 均可诱导糖胺聚糖(GAG)和胶原合成,且二者呈剂量依赖关系,但与des(1-3)IGF-1 相比,由于IGF-1 与IGFBPs 的结合增强,导致其生物利用度降低,因此需要更高剂量的IGF-1 诱导骨髓间充质干细胞的软骨分化。
3 加长型IGF-1
加长型IGF-1 是将完整IGF-1 的基因序列与其他基因或调控序列相连接,使得最后诱导表达的蛋白质既具有IGF-1 的生物学功能,又能提高IGF-1 在人体内的稳定性及避免长期用药带来的不良反应,从而达到改良IGF-1 的目的,使其在医药领域得到更广泛的应用。
IGF-1-LongR3 是 IGF-1 的类似物,相比于天然的 IGF-1,IGF-1-LongR3 在 N 端多了 13 个氨基酸,由于IGF-1-LongR3 与IGFBP 的结合能力比IGF-1 低,而IGFBP 可以降低IGF-1 的活性,因此IGF-1-LongR3比IGF-1 更具有优势。ARAUJO 等[23]研究了IGF-1-LongR3 对牛卵母细胞的影响,发现IGF-1-LongR3对促进卵母细胞的成熟具有重要作用。
李亚明等[24]将IGF-1 与增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)融合表达,构建重组质粒,并将其转染进SD 大鼠牙囊细胞(rat dental follicle cells ,rDFCs),实验发现pEGFP-N1-IGF-1 对rDFCs 的增殖和早期成骨分化效应具有一定的促进作用,为IGF-1 衍生物在牙周组织修复再生中的应用提供了试验依据,具有一定的科学研究价值和应用潜力。
IGF-1 或其他蛋白质在单独进行治疗时,可能会出现一定程度的不良反应,而将二者进行融合表达时,不仅可以减低单独使用时的副作用,而且还可以利用两个蛋白的协同作用,将各自的功能发挥得更充分。
李建安[25]将来源于胶原酶的胶原组合基团(collagen-binding domain,CBD)融合到human IGF-1 上,在克服了半衰期短等基础上,也具有了较好的胶原绑定作用,有效促进施旺细胞进行增殖,并且在体内也有促进神经再生的优良功能,增强了IGF-1 的稳定性,优化了生物学功能。
陈骥等[26]使用与纯钛高亲和性的核酸适配体minTBP-1 作为活性蛋白载体,通过蛋白重组将其与IGF-1 结合在一条肽链上,通过minTBP-1 与钛金属表面静电结合作用,将IGF-1 锚定在钛表面并缓慢释放生长因子,结果发现minTBP-1-IGF-1 融合蛋白涂层修饰的纯钛表面有利于改善在高糖高脂条件下成骨细胞的生物学活性,并且在促进成骨相关基因和蛋白表达方面也有积极的作用,有利于为在2 型糖尿病条件下钛-骨结合的种植体表面改性提供一种新的方法。
4 IGF1-Fc融合蛋白
IGF1-Fc 融合蛋白是指使用基因工程技术将目的基因与免疫球蛋白IgG 的Fc 片段相连并表达的重组蛋白,使重组蛋白同时具有目的蛋白和免疫球蛋白的功能域,由于在融合蛋白中加入了重链的恒定区,因此其半衰期可以明显延长,而且Fc 段能贯穿胎盘,结合补体并参与补体依赖的细胞毒作用。融合蛋白的铰链区可以使融合蛋白形成二聚体或多聚体,从而增加其抗原的结合能力。这些特点增加了融合蛋白在制药和医疗的应用价值。
CN201380066090.8[27]提供了一种人IGF-1 与人IgG 的免疫球蛋白Fc 区相融合的蛋白,并将人IGF-1 蛋白的位置42 处氨基酸中的甘氨酸用丝氨酸替代,该融合蛋白可以用来治疗肌肉骨骼疾病、慢性肾脏疾病和慢性阻塞型肺病等疾病。
CN201710085047.6[28]提供了一种 FGF21 与 IGF-1 的融合蛋白,此融合蛋白从 N 端到 C 端连接的分别是人成纤维细胞21 号生长因子21(hFGF21)、柔性肽接头(L)、人免疫球蛋白Fc 片段、柔性肽接头(L)和胰岛素样生长因子-1(IGF-1),即FGF21-human IgG4Fc-IGF-1,此发明的融合蛋白展现出良好的疗效,比单独使用FGF21 或者IGF-1 展现出更好的治疗效果,同时克服了蛋白单独使用时半衰期短等缺陷。
EP2241575[29]提供了一种 IGF-1 与融合组件(IgG 的 Fc 域)的融合蛋白,Fc 段位于融合蛋白的 C 端,IgG 的Fc 域与IGF1 相互作用可以形成更高阶的结构,如二聚体、三聚体,此融合蛋白可以用来治疗由IGF-1 缺乏引起的和提高IGF-1 水平而改善的疾病,如侏儒症和心脏病等,
WO2017RU00521[30]提供了一种由表皮生长因子(EGF)、转化生长因子(TGF)、显微细胞生长因子(FGF)、IGF-1 和多肽的Fc 片段组成的融合蛋白,此融合蛋白的安全性增加了,并且并发症减少,可用于治疗软骨损伤。
5 聚乙二醇化IGF-1
近年来,蛋白质等的生物大分子由于其较好的生物学功能被广泛地应用于医学领域,极大地推动了医药产业的进步。但是,生物大分子存在作为药物方面因为半衰期短、易被酶解和有一定的毒性等问题被大大限制了应用。为了解决这些问题,用聚乙二醇对生物大分子进行修饰,从而明显延长药效是一种可行的方法。因为聚乙二醇(PEG)分子的空间阻碍作用会大大提高被修饰蛋白对蛋白酶酶解的抵抗能力,同时修饰分子的分子排阻体积会显著增大,最终降低其肾脏过滤清除率。同时,肝脏网状内皮系统会因为聚乙二醇分子的结构特异性从而对被修饰蛋白的识别摄取和清除能力大为降低,并且诱导产生中与抗体结合的能力可以被显著降低或消除,免疫系统难以识别和清除,由于以上特点使得聚乙二醇修饰后的生物大分子具有了比未修饰分子更为优良的药理和药代动力学性能。
KLETZL 等[31]研究了IGF-1 和PEG-IGF-1 在体内临床治疗中的安全性和耐受性,发现PEG-IGF-1可以更好地支持IGF-1 的稳态生物学,并且可以精确和可持续地提高系统IGF-1 水平,而不会干扰IGF-1 的稳态,同时与IGF-1 相比,PEG-IGF-1 具有慢吸收和长半衰期的优点,由于其明显的安全性优势,在治疗IGF-1 缺乏症或需要IGF-1 介导的骨骼肌再生疾病方面具有广阔的应用前景。
SAENGER 等[32]研究了PEG-IGF-1 对家族性肌萎缩侧索硬化症(ALS)小鼠的治疗作用,发现PEGIGF-1 可以调节神经肌肉功能,并在运动神经元疾病模型中可以防止疾病的进一步恶化,而在病情较轻和病情较重的两种小鼠治疗过程中,虽然PEG-IGF-1 对两种小鼠的肌力、运动协调性和动物存活率方面均有显著改善,但在病情较轻小鼠的治疗中效果更为显著,尽管都增加了大脑和脊髓的信号传导,由此为PEG-IGF-1 在临床表型较轻的ALS 患者中的治疗潜力提供了一定依据。
SAENGER 等[33]研究了PEG-IGF-1 在中枢神经系统疾病中的治疗效果,结果发现,与IGF-1 相比,PEG-IGF-1 在脑组织和脑脊液中均达到较高的稳态水平,根据突触蛋白和相关动物行为的变化判断,PEG-IGF-1 两周的治疗足以调节大脑的可塑性过程;此外,PEG-IGF-1 对小鼠脑淀粉样变性模型的慢性治疗逆转了IGF-1 信号、突触蛋白和认知功能的缺失,由此为中枢神经系统疾病的治疗提供了新的方向,并为其在突触功能和神经元发育障碍中的应用提供了科学依据。
GEHRIG 等[34]研究了对肌营养不良小鼠的治疗效果,实验结果表明PEG-IGF-1 可以保护膈肌不疲劳,保护胫前肌不受收缩性损伤,但其仅对轻度肌肉病变有治疗作用,因为其改善严重肌营养不良的潜力有限,如果要达到较好的治疗效果,应该只对轻度肌肉病变进行治疗,因此PEG-IGF-1 可以作为一种短期治疗,加速受伤后健康肌肉功能的修复。
6 结语
IGF-1 的生物学效应在医学领域已展示出巨大的发展潜力,随着医学的发展,IGF-1 已逐步被应用于临床。在疾病诊断方面,用血清中IGF-1 含量评估患者的营养水平和生长迟缓程度的方法已被医学界广泛使用。在疾病治疗方面,因IGF-1 可以促进细胞的生长和增殖,可促进伤口的加速愈合,因此在治疗骨骼肌萎缩方面也有较显著的疗效;糖尿病患者血液中的IGF-1 水平普遍较低,给胰岛素失敏的糖尿病患者皮下注射适量IGF-1 不仅可降低血糖,而且还能提高患者机体对胰岛素的敏感性;阿尔兹海默症发生的关键环节是淀粉样蛋白在脑组织沉积从而导致神经元的毒性损伤,IGF-1 对脑内淀粉样蛋白转运至外周有一定的促进作用,可以减少淀粉样蛋白在脑内的沉积,降低淀粉样蛋白对脑内神经元的毒性作用,减弱神经元的变性和死亡,延缓阿尔兹海默症的进一步恶化。
虽然IGF-1 在多种疾病的治疗中都起着积极作用,但IGF-1 带来的不良反应和潜在危险也不容忽视。其不良反应包括组织水肿、体重增加、注射部位灼痛、呼吸困难和关节痛等,长期使用IGF-1 会带来骨质疏松和致癌致肿瘤风险。因此,既能发挥IGF-1 生物学功能又能避免IGF-1 带来的风险的IGF-1 衍生物和改构物的开发显得尤为重要。随着重组DNA 技术的应用,研究人员已经能设计合成出IGF-1 的新型肽变体。这些新型的衍生物表现出与IGF-1 相同的生物学效应,有些甚至优于IGF-1,在发挥功能的同时还能降低不良反应。另一方面,随着结构生物学和分子模拟技术的发展,通过计算机模拟改构后的IGF-1 衍生物多级结构与性质,可以设计出保留其基本生物学功能的最小多肽类药物,使其在有效发挥治疗效果的同时,最大限度地降低可能带来的不良反应。相信随着各学科交叉融合,IGF-1 衍生物的开发将有更多的新思路、新技术和新方法,新型药物也将为更多的患者带来福音。
