稳定同位素直接稀释/超高效液相色谱-串联质谱法测定葡萄酒中赭曲霉毒素A
2019-12-05王兴龙桂文锋蔡增轩许娇娇任一平
王兴龙,蔡 强,桂文锋,蔡增轩,许娇娇,任一平*
(1.浙江清华长三角研究院 分析测试中心,浙江 嘉兴 314000;2.上海师范大学 环境与地理科学学院,上海 200233;3.浙江省疾病预防控制中心,浙江 杭州 310000)
赭曲霉毒素(Ochratoxin)是一类主要由曲霉菌属(Aspergillus)和青霉菌属(Penicillium)的真菌产生的次级代谢产物,根据化学结构,可分为赭曲霉毒素A(Ochratoxin A,OTA)、赭曲霉毒素B(Ochratoxin B,OTB)和赭曲霉毒素C(Ochratoxin C,OTC)。其中OTA的毒性最强,化学性质稳定,半衰期较长,可产生致畸[1]、致癌、肾毒性[2]、免疫毒性、肝细胞毒性[3]、神经毒性[4]等毒性。由于受葡萄生长条件和酿制工艺的影响,葡萄酒易造成赭曲霉毒素的污染。近年来,Yusefi等[5]对伊朗的70个葡萄汁样本进行评估研究,发现55.7%的样本中OTA浓度高于0.125 μg/L,平均污染水平为0.5 μg/L,最高达2.6 μg/L。刘青等[6]对9个国家11种不同种类的葡萄酒中赭曲霉毒素进行筛查,OTA的检出率高达45.4%,检出浓度为1.1~11.5 μg/L,有4个样本超过2 μg/L。为有效控制葡萄酒中OTA 对人类健康产生危害,国内外相继制定了限量标准,如我国GB 2761-2017标准[7]及欧盟法规[8]均规定OTA在葡萄酒中的最大残留量为2 μg/kg。随着葡萄酒中OTA风险评估研究的深入,对其检验方法不仅要求结果更加精准,而且要求前处理技术更加简单、高效。
目前,酒类产品中真菌毒素的定量检测方法主要有酶联免疫吸附法[9]、高效液相色谱法[10-11]、液相色谱-串联质谱法[12-13]等。其中,酶联免疫吸附法的前处理相对简单,主要用于快速筛查,但易出现假阳性。高效液相色谱法的准确度高、稳定性好,但对前处理要求较高,抗干扰能力较差。而液相色谱-串联质谱法具有灵敏度高、选择性好、分析效率高等优势,逐渐成为赭曲霉毒素检测的首选方法。目前,液相色谱-串联质谱法检测葡萄及其制品中真菌毒素的前处理技术主要有固相萃取柱净化[14-15]、免疫亲和柱净化[5,16]、分散液-液微萃取[17-18]以及QuEChERS[19-20]等方法。然而,上述前处理技术成本较高,过程相对复杂,易造成目标物损失,且无法满足大批量样本的同时检测需求。
本研究将样品直接稀释、过滤膜处理,利用稳定同位素稀释技术消除基质效应,建立了超高效液相色谱-串联质谱(UPLC-MS/MS)检测葡萄酒中OTA的方法。本方法简单、高效、成本低,适用于大批量葡萄酒样品中OTA的快速、准确定量检测,可为葡萄酒中OTA的安全风险评估提供技术支持。
1 实验部分
1.1 仪器与试剂
Acquity H 超高效液相色谱仪、Waters TQD 三重四极杆串联质谱仪(美国Waters公司);Milli-Q超纯水仪(美国Millipore公司)。
OTA(C20H18ClNO6,CAS号:303-47-9)及其稳定同位素13C20-OTA标准品:质量浓度均为 10 μg/L,购自Romer国际贸易(北京)有限公司。色谱纯乙腈、甲酸,以及0.22 μm亲水PTFE针式滤膜购于上海安谱实验科技股份有限公司;实验用水为超纯水,由Milli-Q超纯水仪制备。
1.2 标准溶液配制
1.2.1 OTA标准储备液移取适量的OTA标准品溶液,用乙腈稀释至10 mL,配制成100 μg/L的标准储备液,于-20 ℃保存。
1.2.213C20-OTA工作溶液移取适量的13C20-OTA标准品溶液,用乙腈稀释至5 mL,配制成5 μg/L的稳定同位素工作溶液,于-20 ℃避光保存。
1.2.3 OTA标准工作溶液准确移取适量的OTA标准储备液,用乙腈-水-甲酸( 29.8∶70∶0.2,体积比)溶液逐级稀释,分别配成0.05、0.1、0.2、0.5、1 μg/L的OTA标准工作溶液。移取20 μL13C20-OTA工作溶液与180 μL OTA 标准工作溶液于300 μL进样小瓶中,充分混匀,待测。
1.3 样品前处理
准确移取100 μL试样于1.5 mL离心管中,加入900 μL乙腈-水-甲酸(29.8∶70∶0.2)溶液,涡旋混匀后,过0.22 μm PTFE针式滤膜。移取20 μL13C20-OTA工作溶液于300 μL进样小瓶中,加入180 μL样品滤液,充分混匀后,待测。
1.4 仪器条件
1.4.1 液相色谱条件ACQUITY BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);柱温为40 ℃;进样体积为10 μL;流速为0.3 mL/min;流动相:A为0.1%甲酸水,B为0.1%甲酸乙腈。洗脱条件:0~1.0 min,70%A;1.0~4.5 min,70%~5%A;4.5~6.5 min,5%A;6.5~9.5 min,5%~70%A。
1.4.2 质谱条件电喷雾离子源(ESI);正离子扫描;毛细管电压为3.0 kV;离子源温度为150 ℃;脱溶剂气温度为500 ℃;脱溶剂气流速为800 L/h,锥孔反吹气流速为30 L/h;多反应监测模式(MRM)采集。
2 结果与讨论
2.1 质谱参数的优化
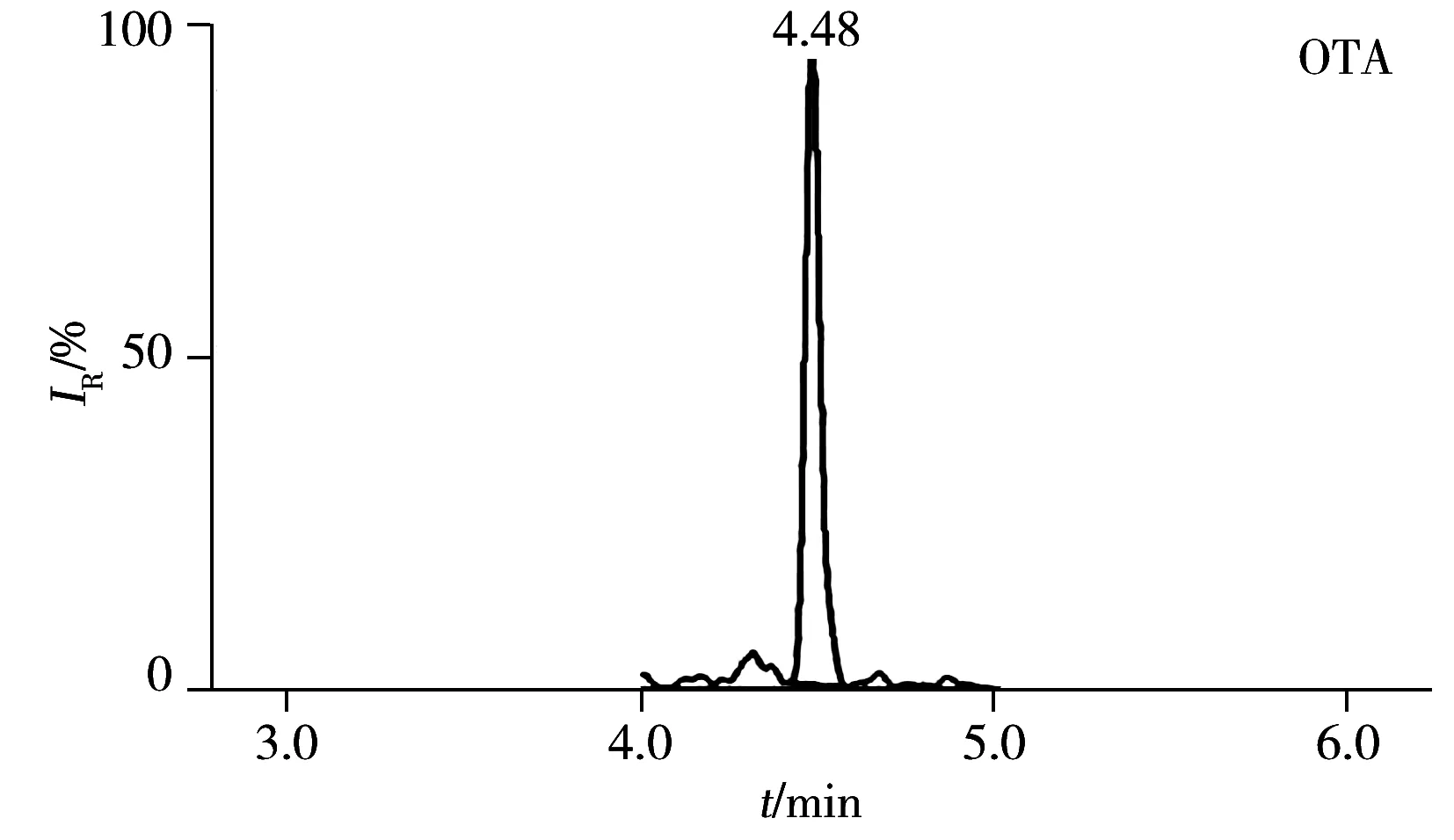
在ESI+模式下,采用MS Scan模式,对500 ng/mL的OTA及13C20-OTA分别进行一级质谱全扫描分析,得到每种目标物的母离子。比较不同锥孔电压下母离子的响应强度,以最大响应值时为最佳锥孔电压。采用Daughter模式,在不同碰撞能量下,对目标物母离子分别进行二级质谱全扫描,得到每种母离子的碎片离子,比较不同碰撞能量下碎片离子的响应强度,选择响应强度较高的两个子离子作为定量离子和定性离子,优化的质谱参数见表1。在上述优化条件下,OTA及13C20-OTA的总离子流图见图1。

表1 OTA及其同位素的质谱参数Table 1 Mass spectrometric parameters of OTA and its isotope
*quantitative ion
2.2 前处理条件的优化
葡萄酒基质相对复杂,含多种抗氧化剂、色素、葡萄糖与果糖等成分。在ESI+模式下,OTA及13C20-OTA的离子化效率易受到基质干扰,从而影响定量检测。本实验按照下式评估基质效应:ME=|C-A|/B×100%[21],式中,C为样品加标1 μg/L测定的峰面积,A为样品本底的峰面积,B为OTA浓度为1 μg/L的溶剂标准品的峰面积。若ME=100%,说明无基质效应;ME>100%,说明存在基质增强效应;ME<100%,说明存在基质抑制效应。将葡萄酒样品经乙腈-水-甲酸(29.8∶70∶0.2)溶液分别稀释5、10、20倍后按照本方法进行分析,结果显示,3种稀释倍数下的基质效应均接近100%,说明直接稀释可基本消除基质效应。综合考虑方法灵敏度与仪器污染,本实验将稀释倍数设为10倍,同时加入稳定同位素作为内标[22- 23],以降低质谱仪器波动的影响,保证实验结果更加可靠。
2.3 方法学验证
2.3.1 线性关系、检出限与定量下限在优化条件下,采用内标法对质量浓度为0.05~1 μg/L的OTA标准工作溶液进行测定,以OTA与13C20-OTA的峰面积比值为纵坐标(Y),OTA的质量浓度为横坐标(X,μg/L)进行线性拟合。结果表明,13C20-OTA的质量浓度为 0.5 μg/L时,OTA在0.05~1 μg/L范围内线性关系良好,回归方程为Y=18.264 5X+0.105 421,相关系数(r2)为0.999 6。在空白样品中加入一系列不同浓度的标准品,按本方法进行前处理后进样分析,得到OTA的检出限(LOD,S/N≥3)和定量下限(LOQ,S/N≥10)分别为0.1、0.3 μg/L。
2.3.2 准确度与精密度针对红葡萄酒和白葡萄酒2种空白样品进行1.00、2.00、5.00 μg/L 3个水平的加标回收实验,每个加标水平测定6 次,通过内标法计算加标回收率,并计算同一浓度水平的相对标准偏差(RSD),作为日内精密度。按照以上操作连续测定3 d,以每天对应浓度的平均值计算RSD,作为日间精密度。结果如表2所示,OTA的回收率为102%~113%,日内、日间的RSD均小于10%,说明该方法的准确度和精密度良好。

表2 OTA的加标回收率及相对标准偏差Table 2 Recoveries and relative standard deviations of OTA
2.4 方法比较
为验证本方法的可行性,以空白葡萄酒为基质,OTA的加标浓度设为 2 μg/L,参考GB 5009.96-2016[24]第三法,采用免疫亲和柱净化法与本实验建立的直接稀释法,在相同的分析条件下进行测定,比较加标回收结果是否存在显著性差异,结果如表3所示。经计算,t值为0.71,小于t(0.05,10)=2.23,说明两种前处理方法的结果一致。
2.5 实际样品检测
通过市场采购,选取橡木桶、白杨河、长城、威龙、香格里拉、天然、赤霞珠、梅洛等国产品牌的15种红葡萄酒和5种白葡萄酒,采用本方法进行检测。结果显示,所有样本中均未检出OTA,表明上述样品满足欧盟和我国食品安全标准对于葡萄酒中OTA的限量要求。
3 结 论
本文建立了葡萄酒中OTA的超高效液相色谱-串联质谱检测方法,通过直接稀释的前处理方法,并结合稳定同位素内标定量技术,避免了目标物损失,保证了测定结果准确、可靠。本方法前处理简单、高效、灵敏度高、成本低,适合大批量葡萄酒中OTA的快速、准确定量检测,同时还可用于葡萄酒中多种真菌毒素的检测。
