阿帕他胺(ARN-509)治疗前列腺癌的研究进展
2019-12-04何志嵩
虞 巍,何志嵩
(北京大学第一附属医院泌尿外科,北京 100871)
2018年最新全球统计数据显示,前列腺癌(prostatic cancer,PCa)在男性中的发病率及死亡率均占居男性肿瘤发病的第二位。仅2018年,全球PCa新发病例及死亡病例分别为127.6万与35.8万,在整个肿瘤发病及死亡中的占比分别高达7.1%与3.8%[1]。在中国,虽然男性PCa发病人数、死亡人数及年龄标化发病率均大幅增加[2];不过,近5年中国男性PCa的生存改善较为明显,相对生存率逐年升高。尽管如此,目前中国PCa的发病率、死亡率及其造成的疾病负担总体明显增加,应重点加强防治工作[3]。
研究表明,雄激素受体(androgen receptor,AR)在PCa的发生发展中发挥着重要作用[4]。因此,AR是治疗PCa的重要靶点。然而,随着传统AR靶向药物治疗时间的延长,PCa患者会出现治疗效果降低的现象[5]。目前,研发针对AR的新型药物已成为PCa治疗领域的研究热点。为此,本文将对新型AR靶向药物—阿帕他胺治疗PCa的研究进展进行详细阐述。
1 AR通路在PCa治疗中的机制及重要性
AR是一种配体依赖型的反式转录调节蛋白,与雄激素结合后,二聚体化,形成磷酸化活性结构,转位进入核内;AR介导的雄激素信号传导通路在调控前列腺上皮细胞增殖及凋亡的平衡、细胞的生长及分泌作用、维持男性生殖系统的功能方面起重要作用[6-7]。目前,随着对PCa发生发展分子机制的深入研究发现,其发展进程大致包含以下4个阶段:①雄激素依赖-AR依赖阶段。PCa细胞的生长依赖于机体内分泌循环中的高水平睾酮(testosterone,T)。②内源性雄激素依赖-AR依赖阶段。循环中的T被抑制后,PCa细胞生长可依赖于其自分泌或转化雄激素前体物质(如DHEA)获得具有活性的雄激素。③雄激素非依赖-AR依赖阶段。在没有雄激素环境中,通过其他信号通路(如HER2/Neu、IL-6、Scr激酶或经配体非依赖性雄激素受体剪接变体表达的其他物质)持续活化AR信号。④雄激素非依赖-AR非依赖阶段。AR信号被完全抑制,其他未知致癌模式驱动肿瘤进展[8]。从PCa进展各阶段可看出,其发生的早期主要依赖于雄激素的存在,而在发展过程中与AR介导的信号活化密切相关,但这种活化与外源性雄激素和受体结合无关,而是与PCa细胞内源性雄激素合成、AR基因扩增或突变、剪切变异体形成以及共刺激因子活化等相关[9-10]。总之,AR依赖信号活化在PCa进展中发挥关键作用,靶向AR药物的研发将有助于控制PCa的进展。
根据化学结构的不同,AR拮抗剂可分为甾体类与非甾体类两种;两者的化学结构、药理作用及不良事件均有所差异。甾体类AR拮抗剂的代表药物为醋酸环丙孕酮,与雄激素结构相似,可降低睾酮水平,亦可结合于其他激素受体,存在肝脏毒性及心血管副作用;相对而言,非甾体类AR拮抗剂抗雄激素的活性较好,不存在甾体类药物的激素样副作用,所以在临床上更为常用[8,11]。第二代AR靶向拮抗剂——比卡鲁胺是前期应用最为广泛的PCa治疗药物,可与去势治疗联合使用,共同阻断雄激素信号;但对于晚期PCa患者,疗效欠佳。此外,恩扎卢胺作为第三代非甾体AR拮抗剂,虽然被批准用于晚期去势抵抗性前列腺癌的治疗,但长期使用后的中枢神经系统安全性及耐药问题不容被忽视,尤其是对于中枢神经系统的副反应。随着对AR结构及其生物学功能的进一步了解,新一代强效AR拮抗剂-阿帕他胺(Apalutamide)被成功合成,并且已在临床上表现出良好疗效及安全性。2018年2月14日,美国FDA批准阿帕他胺用于治疗非转移性去势抵抗性PCa患者[12]。
2 阿帕他胺的结构优势及早期研发历程
阿帕他胺是一种合成的联芳基硫代乙内酰脲化合物,相对于比卡鲁胺与恩扎卢胺,阿帕他胺的结构表现出一定AR信号拮抗优势。阿帕他胺与AR的亲和力是比卡鲁胺的7~10倍,其体外抗AR活性IC50值为16 nmol/L;而恩扎卢胺与AR的亲和力是比卡鲁胺的5~8倍,其相应IC50为36 nmol/L。这提示阿帕他胺在较低浓度下就可表现出良好的AR拮抗作用;同时,即使在高浓度下,阿帕他胺也并未出现对AR的激动活性,这就避免了非甾体类AR拮抗剂恩扎卢胺长期治疗后拮抗剂转变为激动剂的缺点[13]。此外,有研究显示,在AR过表达及携带比卡鲁胺耐药突变的细胞中,阿帕他胺亦能发挥充分的拮抗作用;阿帕他胺对配体结合结构域F877L突变型AR的亲和力是野生型AR的30~48倍[14]。这进一步证实,阿帕他胺可有效抑制功能获得性突变AR的活性。此外,动物实验表明,与比卡鲁胺相比,阿帕他胺可有效缩小前列腺癌肿瘤体积,抑制肿瘤生长、促进肿瘤细胞凋亡;而且阿帕他胺可比恩扎卢胺更有效地抑制PCa生长[15]。这些研究均表明,相对于比卡鲁胺与恩扎卢胺,阿帕他胺治疗PCa更加有效。同时由于阿帕他胺的中枢神经系统浓度较恩扎卢胺低,提示癫痫发作等中枢神经系统毒性事件的风险降低[13],相关安全性更好。此外,Ⅰ/Ⅱ期临床试验均表明,阿帕他胺治疗PCa患者安全有效且耐受性良好(表1[16-20]);阿帕他胺还可与PCa相关信号通路如PI3K靶向抑制剂依维莫司联用治疗PCa,表现出良好的疗效;联合使用阿帕他胺的患者前列腺特异性抗原(prostate-specific antigen,PSA)降低>50%超过51周[21-22]。
表1 已完成的阿帕他胺Ⅰ/Ⅱ/Ⅲ期临床试验

研究临床试验分期患者例数患者群治疗方案第12周PSA下降值中位TTPPRATHKOPF[16]Ⅰ30mCRPC阿帕他胺-43.20%NAKOLINSKY[17]Ⅰb57mCRPC阿帕他胺/AAP;ENZ未治或经治患者PSA下降≥50%比例:67%(未治患者),15%(经治患者)NANASMITH[18]Ⅱ51NM-CRPC阿帕他胺-85%24个月RATHKOPF[19]Ⅱ46mCRPC阿帕他胺;AAP未治或经治患者-88%(未治患者)-22%(经治患者)18.2个月3.7个月SMITH[20]Ⅲ1 207NM-CRPC(M0 CRPC)阿帕他胺安慰剂-90%+40%未达到TTPP3.7个月
TTPP(time to PSA progression):至PSA进展时间;mCRPC:转移性去势抵抗性前列腺癌;NM-CRPC:非转移性去势抵抗性前列腺癌;AAP:醋酸阿比特龙泼尼松;ENZ:恩扎卢胺;NA:不适用。
3 阿帕他胺Ⅲ期临床试验——(SPARTAN研究)
一项纳入了1 207例非转移性去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)患者的多中心、双盲、安慰剂对照Ⅲ期临床试验(SPARTAN研究)结果显示,阿帕他胺治疗后,患者的估计中位无转移生存期(metastases-free survival,MFS)由16.2个月显著延长到40.5个月;而且至转移时间和无进展生存期(progression-free survival,PFS)显著延长。尽管阿帕他胺治疗时间长于安慰剂,但两者严重不良反应发生率相近[23]。SPARTAN研究的进一步随访将有助于明确患者接受阿帕他胺治疗后的总体生存获益情况。
4 目前进行中/即将开展的Ⅲ期临床研究
表2总结了目前进行中或即将开展的Ⅲ期临床研究,下文对主要的Ⅲ期临床研究进行阐述。
4.1 TITAN研究一项随机、双盲、安慰剂对照Ⅲ期临床试验纳入了1 052例转移的去势敏感性前列腺癌(metastatic castration-sensitive prostate cancer,mCSPC)(无论肿瘤负荷及危险因素,同时包括既往使用过多西他赛化疗)的患者,分别接受阿帕他胺联用雄激素剥夺疗法(androgen deprivation therapy,ADT)或ADT单独治疗。主要研究终点为放射学无进展生存期(radiological progression-free survival,rPFS)或总生存期(overall survival,OS)。该研究分为4个阶段:招募阶段(随机化前最多28 d)、治疗阶段(28 d治疗周期直至疾病进展或发生不可接受的治疗相关毒性反应)、治疗结束阶段(直至最后一剂研究药物使用后30 d)以及生存随访阶段。如果在中期分析或最终分析中获得阳性研究结果,治疗阶段的患者可以选择参加开放标签延伸阶段,这将允许患者接受阿帕他胺治疗约3年[24]。近期在2019-ASCO大会公布的首次中期结果[25]显示,中位随访22.7个月时,阿帕他胺治疗组(n=525)相比于安慰剂对照组(n=527)的2年rPFS率(68.2%vs. 47.5%;P<0.001)和OS率(82.4%vs.73.5%;P=0.005)都有显著获益,研究表明阿帕他胺使所有mCSPC患者的影像学进展和死亡风险降低了52%和33%;此外,其在次要终点方面也有一定优势,这些结果提示新型内分泌治疗在mCSPC的患者中早期使用获益更多。
4.2 ACIS研究关于mCRPC患者的另一项研究是在未接受过化疗的前列腺癌患者中进行阿帕他胺联用阿比特龙或阿比特龙单药的Ⅲ期随机双盲安慰剂对照研究,入组患者为983例。本研究的目的是评价阿帕他胺联用阿比特龙对mCRPC患者rPFS及OS的获益[26]。
4.3 ATLAS研究ATLAS研究的目的是在接受初次放疗的高风险、局部或局部晚期PCa患者中,比较阿帕他胺加促性腺激素释放激素(gonadotropin releasing hormone,GnRH)激动剂与比卡鲁胺加GnRH激动剂的随机、双盲、安慰剂对照的多中心临床试验;计划入组1 496例患者。主要研究终点为MFS;随访为期84个月。该研究分为招募阶段、治疗阶段、治疗后阶段及长期随访阶段[27]。
4.4 阿帕他胺治疗生化复发性前列腺癌的研究一项旨在明确阿帕他胺治疗生化复发的PCa的随机开放标签的Ⅲ期临床研究,计划纳入504例PSA倍增时间≤9个月的生化复发PCa患者;基于PSA倍增时间(<3个月vs.3~9个月)对患者进行分层,然后按照1∶1∶1比例随机入组:地加瑞克(Degarelix) 单药对照组、阿帕他胺+Degarelix治疗组、阿帕他胺+阿比特龙/泼尼松+Degarelix联合治疗组。该研究的治疗期将长达52周[28]。
4.5 阿帕他胺联合放疗及ADT治疗前列腺癌的研究一项旨在比较阿帕他胺联合或不联合促黄体激素释放激素类似物激动剂(luteinizing hormone releasing hormone analogue agonist,LHRHa)治疗局部PCa疗效的随机、开放标签、双臂、Ⅲ期临床试验,计划纳入990例既往接受放疗的PCa患者;按照1∶1比例患者随机入组:ADT+放疗组与阿帕他胺+ADT+放疗组。主要研究终点为无瘤生存期(disease-free survival,DFS);次要研究终点为PFS、OS及无远处转移生存期(distant-metastasis free survival,DMFS)等。预设完成时间为2026年6月[29]。
4.6 阿帕他胺联合ADT术前新辅助治疗的研究一项旨在比较阿帕他胺联合ADT术前新辅助治疗局部进展PCa疗效的随机、双盲、安慰剂对照、Ⅲ期临床试验计划纳入1 500例准备接受根治性切除PCa患者;患者随机入组:阿帕他胺联合ADT(AAP)组与ADT联合安慰剂治疗组。主要研究终点为病理学上完全反应(pathologically complete response,pCR)与MFS;次要研究终点为无生化复发生存期及PFS等。预设完成时间为2027年12月[30]。
4.7 阿帕他胺治疗非转移性CRPC的研究为了明确阿帕他胺在上市前的用药安全事件,一项开放标签临床研究计划500例非转移性CRPC患者。所有患者既往均未接受手术治疗。主要研究终点为患者自述治疗相关不良事件及严重不良事件。不过,该临床试验的招募患者仅限于南美国家,与SPARTAN研究结果可能存在一定的地域差异。预设完成时间为2021年7月[31]。
4.8 阿帕他胺联合传统疗法治疗复发PCa的研究一项旨在比较阿帕他胺联合AAP及LHRH激动剂与LHRH激动剂或拮抗剂治疗既往放疗后复发PCa疗效的Ⅲ期临床试验,计划纳入400例PCa患者。主要研究终点为MFS;次要研究终点为无生化复发生存期及PSA谷值等。预设完成时间为2034年12月[32]。
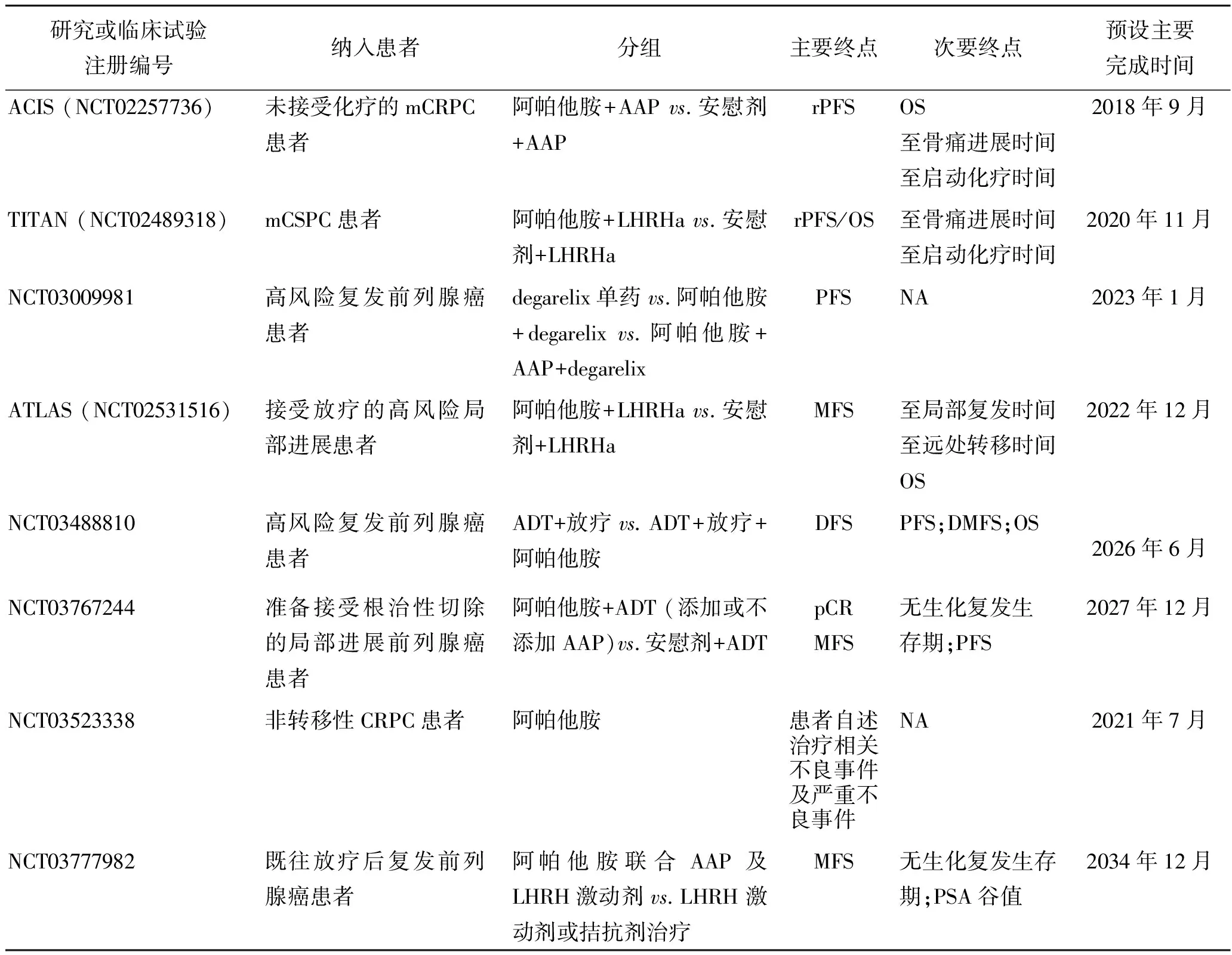
表2 正在进行的阿帕他胺Ⅲ期临床试验
注:CRPC:去势抵抗性前列腺癌;LHRHa:促黄体激素释放激素激动剂;mCRPC:转移性去势抵抗性前列腺癌;MRD:微小残留癌;MFS:无转移生存期;DFS:无病生存期;DMFS:无远处转移生存期;TTF:至治疗失败时间;mCSPC,转移的激素敏感性前列腺癌;OS:总生存期;rPFS:影像学无进展生存期;AAP:醋酸阿比特龙联合泼尼松;NA:不适用。
5 未来注册情况/展望发展方向
目前批准用于PCa(尤其是mCRPC)治疗的AR拮抗剂的长期生存改善尚不满意;因此,仍然需要开发新型药物。阿帕他胺作为一种新型AR拮抗剂,最近被美国FDA批准用于非转移性CRPC患者的治疗[33];2019年1月和2019年9月也分别获得欧洲药物管理局(European Medicines Agency,EMA)和中国国家药品监督管理局((National Medical Products Administration of China,NMPA)的批准。SPARTAN Ⅲ期研究的结果也证实了阿帕他胺可显著改善患者MFS及症状进展时间[16];目前正在进行的更多Ⅱ期或Ⅲ期临床研究将有助于我们对阿帕他胺在不同阶段PCa治疗中的潜在效能有进一步的深入了解。
