基于荧光素酶双报告基因系统体外验证长爪沙鼠Cip4基因受RXR及T4调控
2019-12-04王志远刘月环
王志远,刘月环
(浙江省医学科学院,杭州 310013)
CIP4(CDC42-interacting protein-4)为甲状腺素受体作用因子10(thyroid hormone receptors interactor 10,TRIP10)基因表达的蛋白,是一种细胞骨架调节蛋白,由545氨基酸残基组成,广泛存在于脑、气管、肝、肾、结肠、心、肺、前列腺等人体多种器官中,其表达受全反式维甲酸调节,作为活化的CDC42的下游,Cip4在调节肌动蛋白细胞骨架的形成和重排,调节细胞间的粘附,内吞等过程中起着重要的作用,目前的研究进展包括:(1)是EGFR的上游[1];(2)高糖下Cip4能诱导腹膜上皮细胞向间质细胞的转分化(epithelial to mesenchymal transition,EMT)[2];(3)间充质干细胞出现多种分化倾向并能引发肿瘤的转移[3];(4)丢失Cip4蛋白会造成血小板硬膜化[4];(5)Cip4基因敲除小鼠表现出餐后低血糖,胰岛素抵抗,葡萄糖,转铁蛋白吸收下降[5];(6)胰岛素抵抗(insulin resistance,IR)的大鼠磷酸酶高表达抑制了内脏脂肪组织中Cip4的表达[6]。现已知甲状腺素受体(Thyroxine receptor,TR,特定组织核受体之一,是一类配体激活型转录因子)与配体甲状腺素(三碘甲状腺原氨酸T3或四碘甲状腺原氨酸T4)结合后TR构象改变,通过与RXR(retinoic acid receptor X,维甲酸X受体)结合成二聚体来调控基因的表达,TR能够与特定的基因DNA序列(比如甲状腺素应答元件)结合而发挥生理作用。RXR是核受体蛋白家族(此外还包括TR及过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)等数十种)的核心成员,在细胞发育和代谢调节上处于核心地位。维甲酸信号转导系统中每两个核受体形成一个同源二聚体(RXR/RXR)或异源二聚体(RXR/RAR或PPAR/RXR或TR/RXR,加上各自的配体称为同源或异源四聚体),作为转录因子与靶基因DNA或是其上游的应答元件结合,从而调控基因的转录和表达,发挥一系列生物学效应[7]。
长爪沙鼠在高脂饲料(与高脂诱导大小鼠模型不同的是不需要加入抑制甲状腺的药物)喂养1周后即可形成单纯性脂肪肝,2周形成脂肪性肝炎(nonalcoholic steatohepatitis, NASH),4~12周即可形成不同程度的肝纤维化,12~16周出现肝硬化,具有成模速度快、死亡率低(成活率高于90%)、适于连续观察非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的病理进展的优点[8],在长达十多年研究中,笔者课题组用高通量测序法检测了高脂饲料诱导4周(NAFLD早期纤维化)及8月龄以上高龄(中老年)自发NAFLD(高脂血症)长爪沙鼠转录组,获得了352个差异基因和32个通路,总结出NAFLD长爪沙鼠模型的10大特点[9]。对测序数据的生信分析表明,与Cip4基因相关的通路(ko04910,胰岛素信号通路)显著上调,高脂诱发NAFLD上调大于3倍,这个结果显示出Cip4基因有可能受甲状腺素及甲状腺素受体变化而发生转录活性变化。另外,我们也发现Cip4基因显著上调与RXR低表达现象,但二者究竟有没有互作关系,目前没有明确的报道。关于Cip4基因研究较多的是其与CDC42的关系,即CDC42是Cip4上游,与细胞分裂周期密切相关[10]。Cip4作为一种受全反式维甲酸调节的甲状腺素受体作用因子,其转录激活是否可直接基于上述二聚体的结合,是否需要甲状腺素T4作为配体呢?Cip4的表达是否受配体激活型核转录因子及激动剂T4的调控,且是否与RXR信号通路相关?
报告基因检测是研究结构基因旁侧区域潜在的顺式元件(如启动子、增强子和沉默子等)和反式作用因子相互作用关系的一种重要工具[11]。通常是用萤火虫荧光素酶定量基因表达时,采用第二个报告基因来减少实验误差。目前不少公司可以提供萤火虫荧光素酶检测(一般是pGL3质粒作为载体)和海肾荧光素酶检测(一般是pRL-TK质粒作为内参)组合的双报告系统。在使用荧光素酶报告基因检测系统结合pRL载体系统,即表达第二个报告基因海肾荧光素酶的载体系统,就可以在单管中进行双荧光素酶报告基因的检测,较为灵敏快捷。本研究就是采用荧光素酶双报告基因系统对Cip4的表达是否受RXR,TRB(甲状腺素受体TR的B亚型)调控进行实验。
1 材料和方法
1.1 细胞系
肾细胞系HEK293(ATCC,自行培养传代)。
1.2 主要试剂与仪器
TRB激动剂(TRB的配体)T4(左旋甲状腺素钠五水合物)(Damas-beta,货号P1081372),DMEM(Hyclone,货号SH30243.01B),FBS(Gibco,货号26400-044),双荧光素酶检测试剂盒(Dual Luciferase Reporter Gene Assay Kit,Promega,货号E1910),转染试剂Lipofectamine2000(Thermofisher,货号11668030)。移液器(Gilson);离心机(Ependorf,型号5424R);恒温振荡器(上海知楚,型号ZQWY-200);细胞培养箱(Thermo,型号Forma 3111);超速离心机(Beckman,型号Avanti J-30I);化学发光分析仪(中生北控,型号BK-L96C)。
1.3 实验方法
1.3.1 质粒构建
通过化学合成方法将转录因子CDS序列克隆并构建到pcDNA3.1表达载体上;将长爪沙鼠Cip4启动子序列克隆并构建到pGL3 basic的载体上(下文质粒中标绿的那部分)。所涉及的转录因子是TRB和RXR,启动子序列是长爪沙鼠Cip4基因启动子区,基因克隆、合成及载体构建均由南京一道基因公司完成,碱基序列、长度及GeneBank号如下。
(1)转录因子TRB CDS区:长爪沙鼠thyroid hormone receptor beta (TRB), transcript variant X1, mRNA(1428 bp),NCBI参考序列为XM_021654936.1,TRB通过两侧(5’BamHI-3’EcoRI)添加酶切位点引入pcDNA3.1(+),碱基序列共1464 bp,质粒图谱如图1所示。
(2)转录因子RXR CDS区:长爪沙鼠全部信息链接见https://www.ncbi.nlm.nih.gov/gene/?term=RXR%20Gerbillinae,共有三个亚型,选取肝表达高的RXR[12],即长爪沙鼠retinoid X receptor alpha (RXRa),transcript variant X1,mRNA,NCBI参考序列为XM_021638115.1,1404 bp,RXR-XM_021638115.1通过5’HindIII-3’XhoI克隆到pcDNA3.1(+)载体,碱基序列共1440 bp,质粒图谱如图2所示。
(3)长爪沙鼠Cip4启动子:即长爪沙鼠thyroid hormone receptor interactor 10 (Trip10),Gene ID为110545609,1426 bp,Cip4启动子通过在两侧引入5’NheI-3’XhoI酶切位于点,克隆到pGL3 basic载体,碱基序列共1438 bp,质粒图谱如图3所示。
图1 转录因子TRB的质粒示意图
图2 转录因子RXR的质粒示意图
图3 启动子Cip4的质粒示意图
1.3.2 TRB的配体——激动剂甲状腺素T4的浓度梯度实验
以RXR及TRB的表达量为标记,T4设置梯度浓度为 0.1 μmol/L, 0.01 μmol/L, 0.001 μmol/L,设置24 h与48 h两个时间点,用荧光定量PCR法进行检测,RXR 上游引物:5’-TGCTCATCGCCT CCTTCTCC-3’,下游引物5’-GCTCCGTCTTGT CCATCTGC-3’,片段长度为177 bp;TRB上游引物:5’-GAACAGTCGTCGCCACATCTC-3’,下游引物:5’-CCTTTACATTTCTTCTCCTCCGTTTG-3’,片段长度为131 bp。PCR程序为95℃ 1 min,95℃ 15 s,60℃退火30 s,72℃延伸10 min,40个循环,99℃度保温。取两个基因与未加T4的空白组相比有差异的浓度为T4的工作浓度。
1.3.3 质粒转染与荧光素酶活性检测
利用Lipo2000转染试剂盒,将转录因子和重组的质粒利用脂质体转染的方法转染到HEK293T细胞中,用荧光素酶双报告基因法检测Cip4与RXR/TRB转录因子二聚体结合情况。
(1)质粒转染:①转染前一天24孔培养板中接种细胞,使转染时细胞密度在70%~80%,培养基为含1.3.2筛选出的工作浓度(0.01 μmol/L)T4药物的DMEM + 10% FBS(每个分组均包括含甲状腺素T4与不含甲状腺素T4,下同);②2 μL Lipo2000转染试剂稀释到50 μL无血清DMEM培养基中,质粒稀释到50 μL无血清DMEM培养基中(启动子+转录因子:TK=20∶1 总质粒量2 μg),混合室温孵育20 min,补无血清DMEM培养液100 μL;③吸除皿中培养基,加入上一步制备的转染复合物200 μL,37℃培养5 h;④吸除培养基,换0.5 mL含有1.3.2筛选出的工作浓度(0.01 μmol/L)T4药物的完全培养基,37℃培养48 h;⑤转染做5次重复;⑥质粒转染组合:第一次转染分组如表1所示,其中pcDNA3.1、pGL3 basic为空载质粒,pRL-TK为提供海肾荧光素酶检测的内对照质粒,pGL3 basic-Cip4、pcDNA3.1-TRB 分别是报告载体与TRB表达质粒,检测TRB对Cip4转录活性的影响。以上分组均包括含甲状腺素T4和不含T4两种处理,以检测T4的激动效果;第二次转染分组如表2所示,增加了pcDNA3.1-RXR表达质粒,第五组为检测RXR、TRB同时存在对Cip4转录活性的影响,其余同上(亦包括含甲状腺素T4和不含T4两种处理,以检测T4的激动效果)。

表1 TRB增强Cip4启动转录作用的质粒分组
表2RXR、TRB对Cip4启动作用的质粒分组
Table2Plasmid grouping of RXR and TRB on the initiation ofCip4

序号No.转染质粒组合Plasmid groups1pcDNA3.1 + pGL3 basic + pRL-TK2pcDNA3.1 + pGL3 basic-Cip4 + pRL-TK3pcDNA3.1-RXR + pGL3 basic + pRL-TK4pcDNA3.1-RXR + pGL3 basic-Cip4 + pRL-TK5pcDNA3.1-RXR + pcDNA3.1-TRB + pGL3 basic-Cip4+ pRL-TK
(2)双荧光素酶检测:①裂解细胞:每孔中加入细胞裂解液200 μL,室温孵育10 min,充分裂解细胞;②收裂解液10 000 r/min离心5 min,取上清作为待测液;③溶解萤火虫萤光素酶检测试剂和海肾萤光素酶检测缓冲液,并达到室温。海肾萤光素酶检测底物(100×)置于冰浴或冰盒上备用;④按仪器操作说明书开启化学发光仪,取100 μL裂解液上清加入96孔发光板中,加入100 μL萤火虫荧光素酶检测工作液,吹吸混匀;⑤上机测发光值,激发时间5 s;⑥加入海肾荧光素酶检测工作液100 μL,吹吸混匀,上机测发光值,激发时间5 s;⑦在以海肾萤光素酶为内参的情况下,用萤火虫萤光素酶测定得到的RLU值除以海肾萤光素酶测定得到的RLU值。根据得到的比值来比较不同样品间报告基因的活化程度。
1.4 统计学方法
2 结果
2.1 T4浓度影响RXR、TRB的表达量
T4刺激后RXR、TRB两个基因表达的qPCR结果分析绘制图4~6,从图上可以看出,0.1 μmol/L,1 μmol/L的T4刺激HEK293T在24 hr及48 hr后,两个基因表达均无差异,而用 0.01 μmol/L的T4刺激HEK293T后,TRB、RXR在两个时间点均表现出一定的差异,RXR表达量趋于增加,而TRB表达量趋于下降,鉴于RXR与TRB的表达量的差异,从实验的目的出发,选取0.01 μmol/L的T4作为下一步实验的工作浓度。
2.2 TRB的启动作用检测
根据计算测定的活性值进行绘图,如图7所示,进行统计学分析结果显示,从实验组及对照组的荧光素酶相对活性显示,TRB的共转没有提高Cip4启动子序列的转录活性(P>0.05)。
2.3 RXR与TRB对Cip4的启动作用
根据计算测定的活性值进行绘图,如图8所示,进行统计学分析结果显示,从实验组及对照组的荧光素酶相对活性显示,RXR的共转提高Cip4启动子序列的转录活性(P<0.001),但RXR、TRB两个转录因子共转,在甲状腺素T4激动的情况下Cip4活性较RXR单独存在的情况下显著下降(P<0.01)。
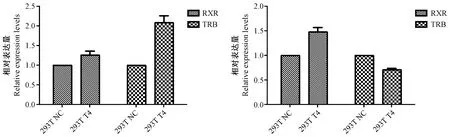
图4 0.01 μmol/L T4刺激24 h(左)或48 h(右)的HEK293T中RXR与TRB的基因表达量
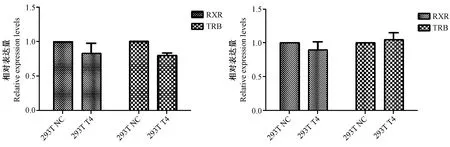
图5 0.1 μmol/L T4刺激24 h(左)或48 h(右)的HEK293T中RXR与TRB的基因表达量
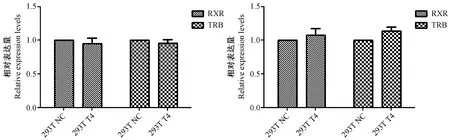
图6 1 μmol/L T4刺激24 h(左)或48 h(右)的HEK293T中RXR与TRB的基因表达量
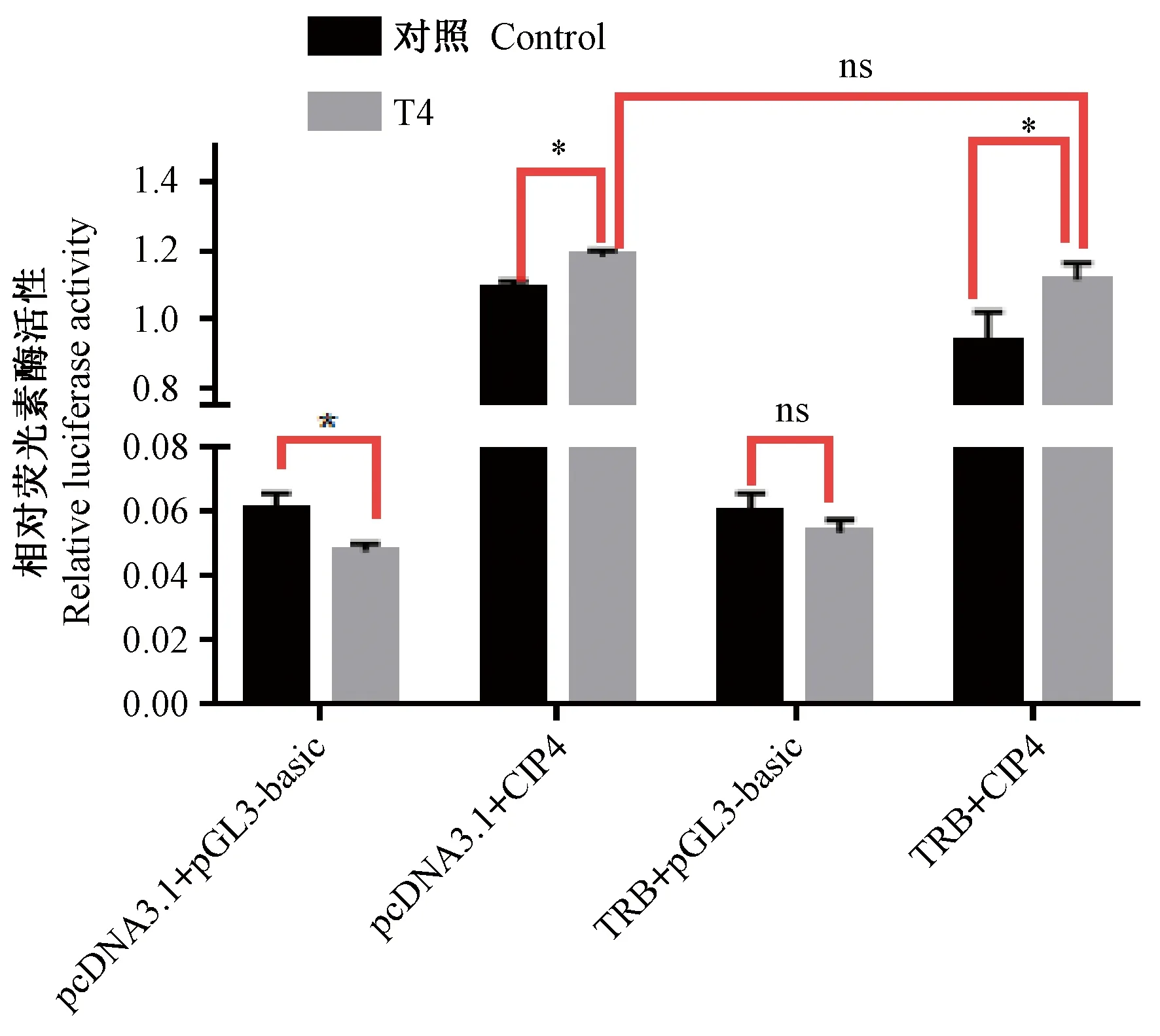
注:各组质粒组合均含pRL-TK。*P < 0.05;“ns”表示差异无显著性。
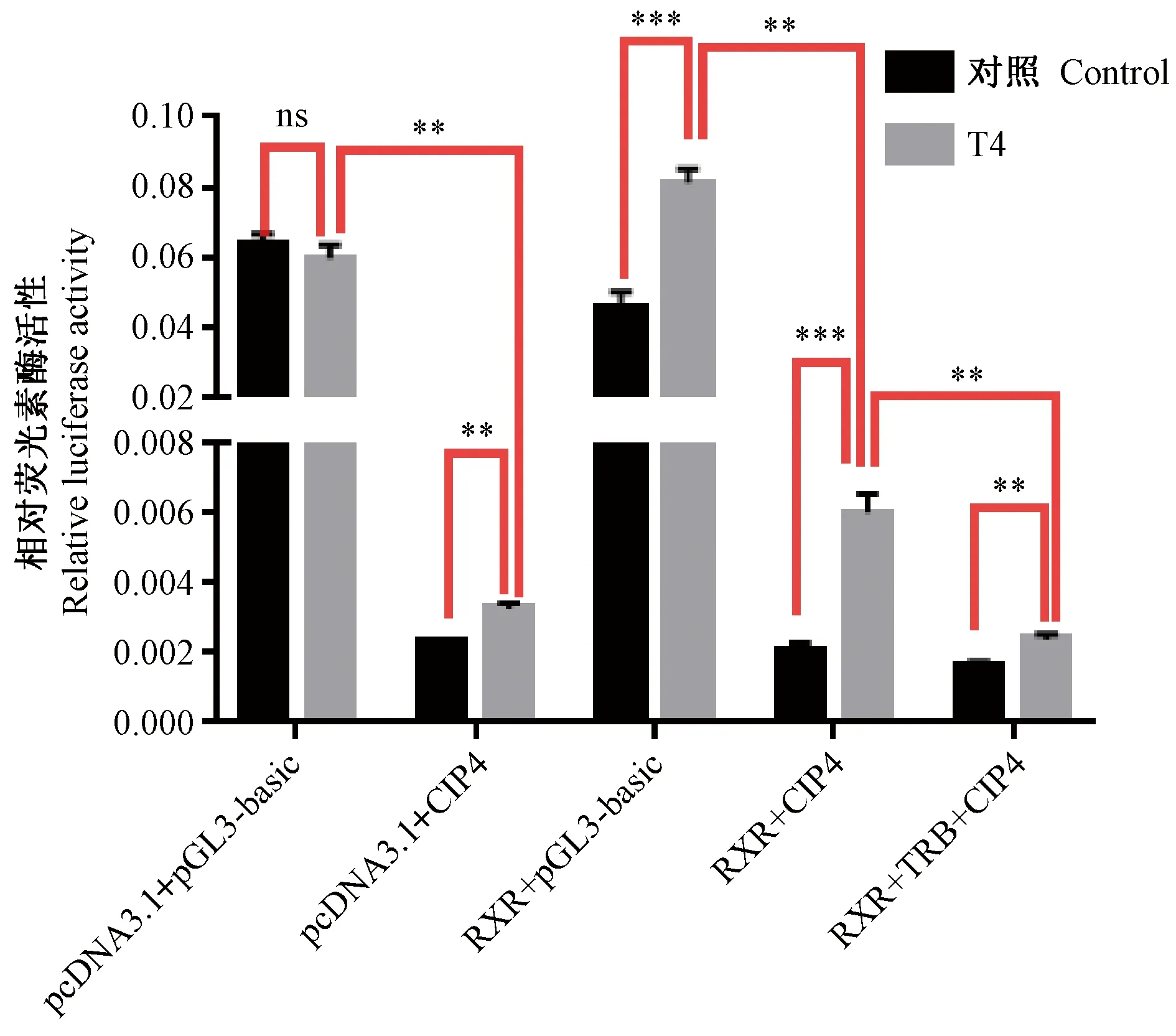
注:各组质粒组合均含pRL-TK。*P< 0.05,**P < 0.01,***P < 0.001;“ns”表示差异无显著性。
3 讨论
报告基因系统是把编码序列和基因表达调节序列相融合形成嵌合基因,通过检测其表达产物(精确定量荧光信号)来标定目的基因表达的调控情况[13]。该技术具有实时定量性、操作简单、灵敏度高、特异性强等等优点,因此在启动子活性分析、基因转移及表达分析、信号转导通路研究、大分子互作等生物医学领域都有广泛的应用[14]。
本研究是在获得长爪沙鼠Cip4基因启动子序列的基础上,将Cip4基因启动子序列以化学合成的方式插入到荧光素酶报告基因载体pGL3-basic中,然后和以相同方式构建在pCDNA3.1上的长爪沙鼠两个转录因子TRB、RXR、TK的质粒共转染HEK293细胞检测其荧光素酶活性,并将这个组成型Cip4基因启动序列全长荧光素酶报告质粒与T4共孵育,确定了T4、TRB与RXR对Cip4基因的启动及调控作用。研究结果表明:单纯加入TRB(T4受体)并不能改变Cip4的转录水平(P>0.05),但单纯加入RXR,可以明显改变Cip4的转录水平(P<0.05),在T4 的作用下是可以明显上调Cip4的转录水平(P<0.001),这证实了RXR可以优先与Cip4结合[15-16],同时表明T4对Cip4有本底调控作用或存在其他不依赖TRB(或称为非经典)的调控途径。TRB是在启动子区与Cip4-RXR复合物结合的另一个转录因子,TRB受T4的激动后,Cip4活性变化明显(P<0.05),这符合配体激活型转录因子的特征[15]。如果有RXR,TRB共同存在的情况下,Cip4的转录水平是受到更严格的下调(共调节)(P<0.01)[17-18]。现已知代谢性疾病中,核转录因子中RXR、PPAR、TRB等转录因子在靶基因转录激活中所起的作用是不相同的,一般情况下RXR和PPAR是占主要地位(核心地位)的核转录因子,其数量在正常与应激情况下都占多数[19-20]。本研究中T4浓度选择亦是考虑二种转录因子对T4的激动出现表达量差异时(即对二种受体转录因子效应不同,类似于依赖或不依赖型途径)的最佳浓度为首选[21],T4主要是TRB的激动剂,因此选择了0.1 μmol/L。
荧光素酶报告系统实验是检测转录因子与共价靶启动子中的特异性序列结合的重要手段,也是目前配体激活型转录因子(如miRNA,激动剂,抑制剂及其他环境影响要素等)的作用研究中常用的方法[22-23]。本研究提供了T4、TRB及RXR调控长爪沙鼠Cip4基因转录表达的证据,间接模拟了配体激活型转录因子RXR-TRB异源二聚体在配体T4存在对Cip4的转录活化现象[24],也证实了Cip4的转录活化与RXR信号通路密切相关。对单一靶基因的转录调控方式,所建立双荧光素酶报告基因系统也适用于其他受核转录因子调控的基因。另外本研究中用甲状腺素作为激动剂(配体)的实验为揭示长爪沙鼠NAFLD模型的特色及甲状腺素在人类NAFLD发病机制的研究奠定基础。
