Uox基因敲除自发高尿酸血症对小鼠体重、血压及血液生理生化的影响
2019-12-04潘明子贺玉伟李海龙李长贵
潘明子,贺玉伟,,李海龙,梁 楠,李长贵,*
(1.青岛大学附属医院,山东 青岛 266021;2.青岛大学代谢病研究院,山东 青岛 266021)
高尿酸血症(hyperuricemia,HUA)是由尿酸合成增加和(或)排泄减少引起的代谢性疾病,其定义为在正常嘌呤饮食状态下,非同日两次空腹血尿酸水平男性高于420 μmol/L,女性高于360 μmol/L[1]。近年来,随着生活水平的提高和高嘌呤食物摄入的增加,HUA的患病率逐年上升,并呈现年轻化趋势[2]。大量研究证实,HUA与肥胖、高血压、慢性肾脏病、2型糖尿病、痛风等疾病的发生发展密切相关,严重危害人类健康[3-7]。随着对HUA研究的深入,构建合适的高尿酸血症动物模型成为揭示其发病机制与研发治疗药物亟需解决的问题。课题组前期使用类转录激活因子效应物核酸酶敲除目的小鼠的尿酸氧化酶(urate oxidase,Uox)基因,基于C57BL/6 J遗传背景成功构建了Uox敲除(Uox-/-)小鼠模型。该模型血尿酸水平长期>420 μmol/L,自发高尿酸血症,在62周内存活率约为 40%,同时伴随肾功能损害、脂质代谢障碍、胰岛素分泌受损等代谢紊乱的特征[8],类似于人类高尿酸血症患者,为HUA发病机制研究及新药研发提供了较为理想的动物模型。
为明确Uox-/-自发高尿酸血症对C57BL/6 J小鼠体重、血压及血液生理生化指标的影响,本研究对三种不同尿酸酶基因的小鼠上述指标进行检测和分析,为利用该小鼠进行生命科学研究和生物医药研发提供参考依据。
1 材料和方法
1.1 实验动物
取同窝出生的6、12周龄C57BL/6 J尿酸氧化酶基因敲除(Uox-/-)、尿酸氧化酶基因杂合缺失(Uox+/-)及野生型(Uox+/+)对照小鼠,每组12只,雌雄各半。野生型C57BL/6J小鼠购自上海南方模式生物科技股份有限公司[SCXK(沪)2014-0002]。Uox-/-小鼠由作者所在实验室构建[8],具体方法如下:选择Uox两端DNA序列,体外转录,得到两段mRNA序列,分别标记为TALEN-L1 mRNA和TALEN-R1 mRNA。该序列可将尿酸氧化酶基因原序列中的T替换为U,产生终止密码子,使尿酸氧化酶基因变为哑基因不表达。将这两个序列注射到C57BL/6 J小鼠的受精卵胞质中,得到F0代嵌合体小鼠;F0代小鼠与野生型小鼠进行杂交,获得F1代杂合体小鼠;杂合体小鼠自交后获得尿酸氧化酶基因敲除的纯合体小鼠,即为自发高尿酸血症小鼠模型。所有小鼠均按照SPF级标准饲养于青岛大学附属医院实验动物中心[SYXK (鲁)2015-0003]IVC无菌通风笼中,自由饮水、摄食,12 h昼夜循环,室温(22±2)℃,湿度(75±5)%。实验过程中,在不影响实验要求和实验结果的基础上,严格按实验动物使用的3R原则关注实验动物福利。
1.2 主要试剂与仪器
美国肯特CODA Monitor多动物多通道尾袖套法无创血压系统,罗氏Roche cobas 6000 c501全自动生化分析仪和配套试剂,迈瑞BC-5300全自动血细胞分析仪和配套试剂,凯丰KFS1000电子秤,Thermo Heraeus Fresco 17微量冷冻离心机,离心管,EDTA.K2抗凝管。
1.3 实验方法
小鼠生长至6周龄和12周龄,检测小鼠体重、血压及血液生理生化指标。
1.3.1 体重的测量
禁食12 h,用电子秤分别称取小鼠体重。
1.3.2 血压的测量
使用美国肯特CODA Monitor多动物多通道尾袖套法无创血压系统对小鼠血压进行监测,每只小鼠测量三次以上,取平均值作为最终血压。
1.3.3 血液生理指标的检测
从小鼠眼眶后静脉丛采集0.1 mL小鼠静脉血至EDTA.K2抗凝管内,快速弹匀,进行血生理指标测定。12项血生理指标分别为:红细胞压积(HCT)、血红蛋白(HGB)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、平均红细胞体积(MCV)、平均血小板体积(MPV)、血小板压积(PCT)、血小板体积分布宽度(PDW)、血小板(PLT)、红细胞计数(RBC)、红细胞体积分布宽度(RDW-C)、红细胞体积分布宽度(RDW-S)和白细胞计数(WBC)。
1.3.4 血液生化指标的检测
从小鼠眼眶后静脉丛采集0.3 mL小鼠静脉血至离心管内,4℃静置20 min,3000 r/min离心10 min,取上层血清进行血生化指标测定。15项血生化指标分别为:白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷草转氨酶/谷丙转氨酶(AST/ALT)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IDBIL)、血糖(GLU)、甘油三酯(TG)、总胆固醇(CHOL)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、尿素氮(BUN)、肌酐(CREA)和尿酸(UA)。
1.4 统计学方法

2 结果
2.1 Uox-/-自发高尿酸血症对小鼠体重的影响
结果显示,6周龄雌性Uox-/-小鼠和12周龄Uox-/-小鼠体重均显著低于Uox+/+对照小鼠(P<0.05)。相较于雄性Uox+/+和Uox+/-小鼠体重显著高于同周龄雌性小鼠(P<0.05),雄性和雌性Uox-/-小鼠之间体重无统计学差异。三种基因背景12周龄小鼠体重均明显高于6周龄小鼠体重(P<0.01)。见表1、图1。
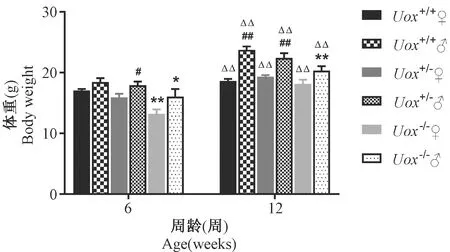
2.2 Uox-/-自发高尿酸血症对小鼠血压的影响
结果显示,6周龄雌性Uox-/-小鼠和12周龄雄性Uox-/-小鼠血压显著高于Uox+/+对照小鼠(P<0.05)。Uox-/-小鼠不同性别及不同周龄间血压比较没有差异。见表2、图2。
2.3 Uox-/-自发高尿酸血症对小鼠血液生理指标的影响
结果如表3所示,Uox-/-小鼠HCT、HGB、MCH、MCV、RBC和RDW-S均显著低于Uox+/+对照小鼠(P<0.05),而MCHC和PCT高于Uox+/+对照小鼠(P<0.05)。6周龄Uox+/-小鼠HCT、HGB和RBC也明显低于Uox+/+对照小鼠,PCT高于Uox+/+对照小鼠(P<0.05)。与6周龄Uox-/-小鼠相比,12周龄Uox-/-小鼠MPV和PDW明显升高(P<0.05),WBC显著降低(P<0.01)。
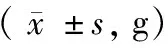
表1 三种小鼠体重测量结果
注:与同周龄同基因型雌性小鼠相比,aP<0.05,AP<0.01;与同性别同基因型6周龄小鼠相比,bP<0.05,BP<0.01;与同周龄同性别Uox+/+小鼠相比,cP<0.05,CP<0.01。下表同。
Note.Compared with the female mice of the same age and the same genotype,aP<0.05,AP<0.01.Compared with the 6-week-old mice of the same sex and the same genotype,bP<0.05,BP<0.01.Compared with theUox+/+mice of the same age and the same sex,cP<0.05,CP<0.01.The same in the following tables.
注:与同周龄同基因型雌性小鼠相比,#P<0.05,##P<0.01;与同性别同基因型6周龄小鼠相比,△P<0.05,△△P<0.01;与同周龄同性别Uox+/+小鼠相比,*P<0.05,**P<0.01。下图同。
2.4 Uox-/-自发高尿酸血症对小鼠血液生化指标的影响
结果显示,Uox-/-小鼠ALB、TBIL和DBIL低于Uox+/+对照小鼠(P<0.05),UA、CREA、BUN、CHOL和LDL显著高于Uox+/+对照小鼠(P<0.05,P<0.01)。见表4、图3。
3 讨论
动物模型是开展疾病发病机制研究与创新药物研发的基石。目前高尿酸血症动物模型主要为禽类和啮齿类,造模方法有促进尿酸生成法、抑制尿酸代谢法及这两种方法的联合应用[9]。然而,这些方法存在需要对小鼠长期使用药物处理,血尿酸水平波动较大,有的药物甚至本身就具有肾毒副作用等缺点[10]。为此,课题组构建了Uox-/-自发高尿酸血症小鼠模型,该小鼠具有稳定的高血尿酸水平,且能够很好地模拟HUA患者的发病状态,在医学生物学研究中的应用价值备受关注,曾被应用于动脉粥样硬化[11]、帕金森病[12]、肾损伤[13]、癫痫[14]等人类疾病机制研究及药物评价中。本实验通过检测幼龄和成年不同Uox基因型C57BL/6 J雌性和雄性小鼠的体重、血压以及血生理生化指标等基础生物学数据,发现Uox-/-自发高尿酸血症能够对小鼠体重、血压、肾功能、脂类代谢以及血生理指标产生影响,为该模型小鼠的使用提供参考。
表2 三种小鼠血压测量结果
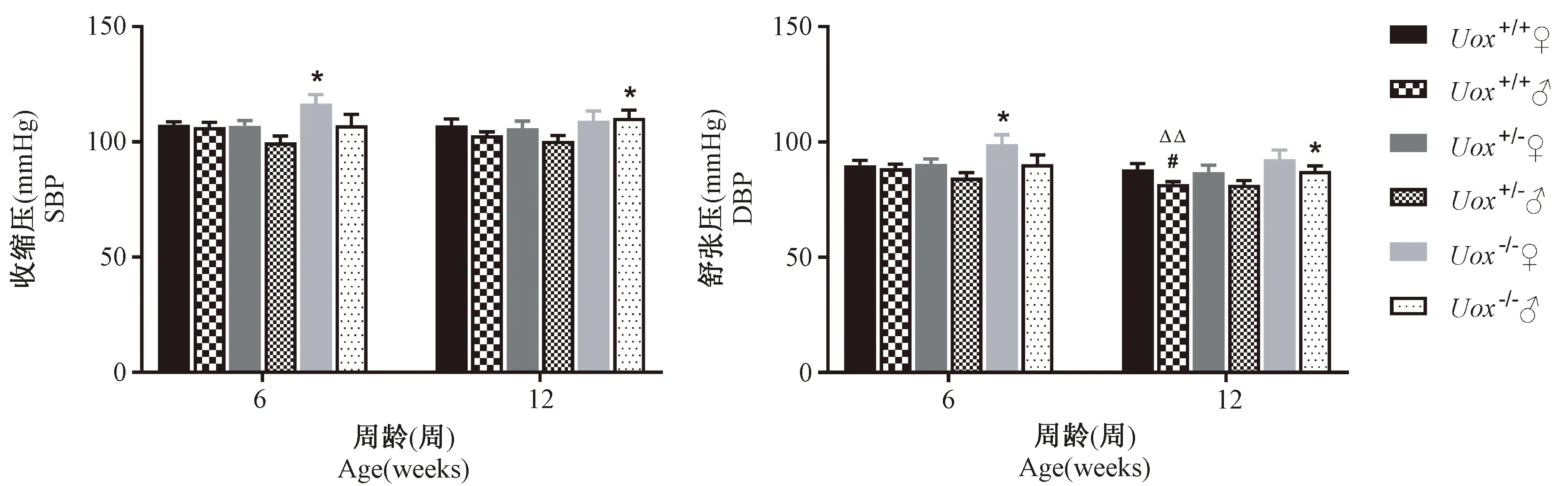
图2 三种小鼠收缩压和舒张压比较结果
6周龄雌性Uox-/-小鼠和12周龄Uox-/-小鼠体重均显著低于Uox+/+对照小鼠,这与临床观察到HUA伴随肥胖的现象相反[3]。与本研究结果一致,牛效清等[15]发现通过药物诱导的HUA模型小鼠体重也明显低于对照小鼠,可能由于HUA影响妊娠、出生体重及生长发育所导致[16-17]。
12周龄雄性Uox-/-小鼠和6周龄雌性Uox-/-小鼠血压明显高于Uox+/+对照小鼠,与Lu Jie等研究的结果一致[8]。大量临床报道及流行病学研究结果发现,HUA是高血压发病的独立危险因素,二者可能存在因果关系[18]。HUA可通过降低一氧化氮合成和激活肾素-血管紧张素系统等机制导致人体血压水平升高[19]。有动物实验证明给予降尿酸药物使血尿酸水平达到正常后血压不再升高[20],因此Uox-/-小鼠可为进一步研究两者关系提供动物模型。
表3 三种小鼠血液生理指标检测结果
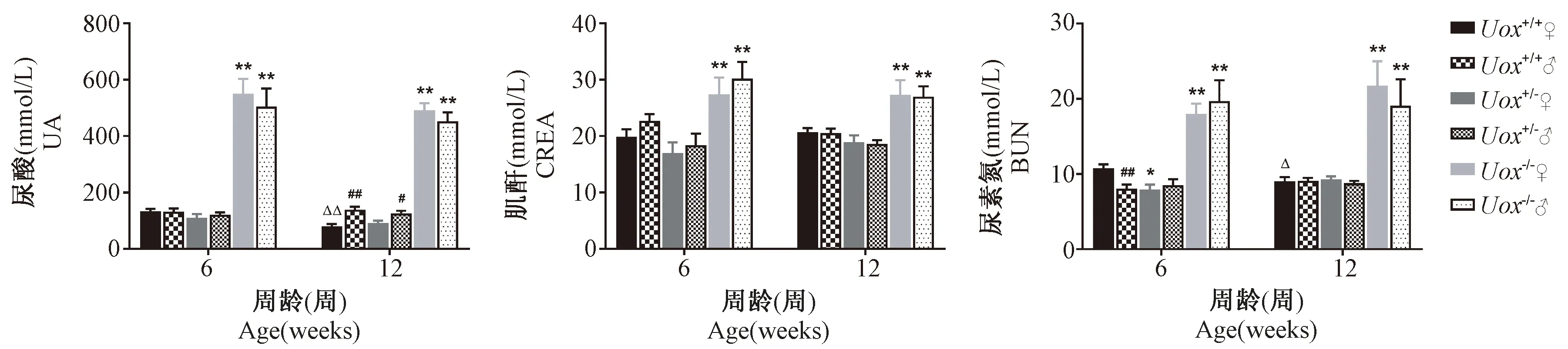
图3 三种小鼠UA、CREA、BUN比较结果
Table4Blood biochemical parameters of the threeUoxgenotypes of mice

周龄Weeks old指标IndicesUox+/+Uox+/-Uox-/-雌Female(n=12)雄Male(n=12)雌Female(n=12)雄Male(n=12)雌Female(n=6)雄Male(n=9)6周龄6 weeksALB(g/L)42.04±3.4637.88±4.52a41.86±1.7337.49±3.47A39.40±3.4437.83±2.15ALT(U/L)28.40±4.4036.00±8.66a36.29±7.97c34.88±11.4238.60±6.66C29.88±5.84aAST(U/L)56.56±9.0452.91±8.7755.38±7.6548.00±6.1361.80±2.0561.14±7.03cAST/ALT2.12±0.421.52±0.33A1.70±0.32c1.69±0.461.64±0.30c2.19±0.32ACTBIL(μmol/L)1.23±0.471.28±0.561.30±0.371.13±0.521.74±0.531.2±0.68DBIL(μmol/L)0.90±0.240.96±0.320.93±0.270.90±0.330.72±0.130.76±0.13IDBIL(μmol/L)0.33±0.310.33±0.290.38±0.210.23±0.311.02±0.47C0.44±0.61GLU(mmol/L)7.24±1.389.46±0.94A8.18±1.488.52±1.757.27±1.228.50±1.84TG(mmol/L)1.23±0.151.47±0.30a0.96±0.04c1.28±0.29a1.00±0.31c1.31±0.47CHOL(mmol/L)2.34±0.332.68±0.18A2.26±0.202.51±0.19a2.41±0.422.68±0.30HDL(mmol/L)1.79±0.352.10±0.17a1.78±0.221.96±0.221.88±0.482.08±0.28LDL(mmol/L)0.38±0.070.37±0.080.40±0.080.39±0.110.48±0.150.51±0.16cBUN(mmol/L)10.77±1.508.06±1.78A7.93±1.89c8.54±2.2017.96±3.08C19.68±8.37CCREA(μmol/L)19.89±4.0423.36±4.1817.00±4.9718.38±5.8527.40±6.66C30.22±8.80CUA(μmol/L)133.10±26.88131.91±35.91110.29±35.62121.13±22.47551.00±116.27C505.13±179.16C12周龄12 weeksALB(g/L)42.69±2.3338.87±2.20A39.69±3.19c38.04±3.33 39.48±3.44c38.56±2.74ALT(U/L)22.42±3.06B34.50±5.44A30.20±5.57C26.92±4.14C21.67±1.63B27.43±4.50aCAST(U/L)48.75±6.73b58.00±6.95A58.00±7.04C48.15±7.88AC49.00±2.76B47.33±3.08BCAST/ALT2.05±0.441.79±0.442.07±0.551.70±0.412.27±0.20B1.85±0.24AbTBIL(μmol/L)1.91±0.63b1.70±0.421.47±0.521.57±0.671.83±0.460.94±0.36ACDBIL(μmol/L)1.25±0.20B1.23±0.330.97±0.22C1.15±0.300.87±0.08bC0.83±0.18CIDBIL(μmol/L)0.66±0.610.47±0.250.50±0.400.42±0.430.97±0.460.11±0.21AcGLU(mmol/L)9.17±1.78b9.75±1.158.26±1.779.37±2.118.48±1.059.39±2.43TG(mmol/L)1.17±0.561.40±0.371.35±0.36B1.31±0.411.28±0.361.16±0.24CHOL(mmol/L)1.96±0.23B2.25±0.18AB1.97±0.542.43±0.21a2.46±0.42c2.79±0.35CHDL(mmol/L)1.74±0.342.11±0.24A1.75±0.482.10±0.26a2.13±0.242.47±0.26abCLDL(mmol/L)0.34±0.110.35±0.060.48±0.11C0.38±0.07a0.40±0.060.37±0.09BUN(mmol/L)9.00±2.00b9.09±1.399.30±1.338.79±1.0621.77±7.82C19.07±9.32CCREA(μmol/L)20.73±2.3320.50±2.8118.91±4.0118.62±2.4327.33±6.31C27.00±4.83CUA(μmol/L)79.64±28.96B138.75±35.69A91.50±26.85126.23±32.65a491.83±62.11C452.86±80.83C
Uox-/-自发高尿酸血症能够影响小鼠贫血相关血生理指标。与Uox+/+对照小鼠相比,Uox-/-小鼠RBC、HCT、MCV、RDW-S、HGB和MCH显著降低,Uox+/-小鼠RBC、HCT和HGB也明显降低,这与临床观察到HUA伴随血RBC、HCT、HGB和RDW指标升高的现象相反[21],但也有临床文献报道由于肾素基因突变导致出现高尿酸血症、贫血和慢性肾脏病的表现[22-23]。提示该类指标的变化可能与尿酸氧化酶基因敲除遗传背景相关,Uox-/-小鼠模型是否可用于血液学相关疾病研究尚待进一步明确。
Uox-/-自发高尿酸血症小鼠UA、CREA和BUN等生化指标显著高于Uox+/+对照小鼠。大量临床研究发现,血尿酸水平升高导致尿酸性肾病、肾结石和肾功能衰竭的患病率显著增加[24]。HUA可通过结晶阻塞肾小管引发炎症反应及诱导细胞凋亡等机制造成肾结构及功能异常[25],且病理结果证实有明显尿酸盐晶体沉积于Uox-/-小鼠肾组织[8]。Uox-/-小鼠6周龄就已出现明显肾功能受损,提示该小鼠是研究尿酸性肾病相关的理想模型。
Uox-/-小鼠是本实验室构建的国内首个基因敲除自发高尿酸血症小鼠模型,其生物学特性尚缺乏系统研究。通过对三种不同Uox基因的C57BL/6 J小鼠体重、血压及血液生理生化指标进行检测,明确了Uox-/-自发高尿酸血症对小鼠上述指标的影响,为今后生物医学领域利用该动物模型从事疾病尤其是尿酸性肾病发病机制研究及新型药物开发奠定了基础。
