毛蕊异黄酮减轻缺氧缺糖/复氧复糖PC12细胞损伤
2019-12-04张彐宁靳晓飞唐敬龙赵艳萌周晓红高维娟
张彐宁,靳晓飞,唐敬龙,赵艳萌,周晓红,高维娟
(河北中医学院,河北省心脑血管病中医药防治研究重点实验室,石家庄 050091)
脑卒中(stroke)发病率逐年攀升,发病人群已经出现年轻化趋势,严重影响着居民身体健康和生活质量,给患者家庭和社会造成了沉重的经济负担。脑卒中可分缺血性脑卒中和出血性脑卒中两大类,其中缺血性脑卒中更为多见。溶栓治疗是缺血性脑卒中的首选治疗方法,由于溶栓后缺血血管的再灌注,会给患者带来再次损伤,故疗效不佳。因此,寻求特效药物已成为防治缺血性脑卒中的研究重点。目前,临床上应用中药黄芪治疗缺血性脑卒中已取得良好效果,但其具体药效成分尚未完全证实,亟待探究。毛蕊异黄酮(calycosin)是黄芪黄酮类的有效单体成分,研究发现毛蕊异黄酮具有抗氧化、抗炎、抗病毒、保肝、延缓衰老等生物作用[1],但其在缺血性脑卒中方面尚缺乏研究。本实验采用缺氧缺糖/复氧复糖PC12细胞模型,模拟神经元体外缺血再灌注的环境,在细胞水平,探讨毛蕊异黄酮对缺氧缺糖/复氧复糖PC12细胞损伤的影响,为筛选黄芪治疗缺血性脑卒中的药效成分提供新的实验依据。
1 材料和方法
1.1 实验材料
PC12细胞(大鼠肾上腺嗜铬细胞瘤细胞系,经过神经生长因子NGF处理后具有神经元的相关特性)购自Boster公司。
1.2 主要试剂与仪器
毛蕊异黄酮购自上海士峰生物制品有限公司,20 mg/瓶,纯度≥ 98%;CCK-8试剂盒购自北京庄盟国际生物基因科技有限公司;Bcl-2抗体、Bax抗体、DAPI染色剂、Cy3和Alexa Fluor488荧光二抗均购自武汉赛维尔生物科技有限公司;PI染色剂购自美国Sigma公司;caspase-3抗体购自Gene Tex公司;LDH试剂盒购自南京建成生物工程研究所;青链霉素混合液购自北京索莱宝科技有限公司;DMEM高糖培养液、胰蛋白酶购自赛默飞世尔(苏州)仪器有限公司;Earle’s平衡盐溶液购自安徽雷根生物技术有限公司;胎牛血清购自浙江天杭生物科技股份有限公司。
SW-CJ-ID型超净工作台购自苏州净化公司;Axio Observer 7型倒置荧光显微镜购自德国Carl Zeiss公司;DPX-9052B-1型电热恒温培养箱购自上海福玛实验设备有限公司;3111型二氧化碳(CO2)培养箱、Multiskan FC型酶标仪、3131型三气培养箱均购自美国Thermo公司。
1.3 实验方法
1.3.1 实验分组及PC12细胞模型的建立
将PC12细胞随机分为5 组:正常对照组(control组)、缺氧缺糖/复氧复糖(oxygen and glucose deprivation/reoxygenation,OGD/R)组(model组)、毛蕊异黄酮高剂量(0.140 μmol/L)组、毛蕊异黄酮中剂量(0.070 μmol/L)组、毛蕊异黄酮低剂量(0.035 μmol/L)组。正常对照组采用DMEM培养液(10%胎牛血清)于CO2培养箱内正常培养,其余各组细胞均建立缺氧缺糖/复氧复糖细胞模型:用无糖Earle’s平衡盐溶液替代DMEM培养液,置于三气培养箱(94% N2、5% CO2、1% O2)内培养2 h,即氧、糖剥夺2 h,之后模型组更换为DMEM培养液,给药组则更换为含有不同浓度毛蕊异黄酮(0.140 μmol/L、0.070 μmol/L、0.035 μmol/L)的培养液,放入CO2培养箱内继续培养24 h,即复氧复糖24 h。
1.3.2 CCK-8法检测各组细胞活性
各组细胞以1×106/L的密度接种于96孔板,OGD/R造模和给药处理后,每孔加入10 μL CCK-8溶液,于CO2培养箱中孵育50 min,酶标仪检测各孔450 nm波长下的吸光(OD)值。OD值越大,细胞活性越强。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.3.3 LDH法检测各组细胞乳酸脱氢酶漏出率
造模和给药处理后,取出各组细胞,按照LDH试剂盒操作步骤,在96孔板中分别加入各组细胞上清液和LDH试剂,充分混匀,室温静置5 min,酶标仪检测各孔450 nm波长下的吸光(OD)值,此为细胞上清液中的LDH含量。之后向原含有细胞的培养板内加入1% Tritonx-100,室温破膜20 min后,取细胞培养液和LDH试剂混匀,室温静置5 min,酶标仪检测各孔450 nm波长下的吸光(OD)值,此为细胞破膜液 LDH释放量。LDH漏出率(%)=上清LDH/(上清LDH+细胞破膜液LDH)×100%。
1.3.4 PI荧光染色观察各组细胞膜完整性
配制PI工作液20 μg/mL于PBS中,避光配置,现配现用,取出各组细胞爬片,PBS清洗1 min×3次,加入PI工作液,37℃电热恒温培养箱中避光孵育30 min,PBS清洗5 min×3次,待细胞爬片稍干后,封片,红染的细胞为阳性细胞,荧光显微镜下随机选取6个视野,观察各组细胞的荧光表达。PI阳性细胞发生率=阳性细胞数/细胞总数×100%。
1.3.5 免疫组化法检测各组细胞caspase-3表达
细胞传代时,进行细胞爬片预培养,之后给予造模给药处理,取出各组细胞爬片,用含4%多聚甲醛的磷酸盐缓冲液固定25 min,室温干燥5 min,PBS清洗2 min×3次,待爬片甩干后,每个爬片滴加50~100 μL 0.2% Triton X-100细胞破膜液,室温破膜20 min,5%山羊血清封闭20 min,甩掉封闭液后,滴加caspase-3单克隆抗体(1∶600),4℃过夜,洗去一抗,滴加山羊抗兔IgG(1∶200)二抗,37℃孵育60 min,洗去二抗,DAB显色15 min,苏木素复染10 min,脱水,透明,封片。显微镜下随机选取6个视野,采用Image J软件分析caspase-3平均光密度值,用积分光密度IOD/Area表示。
低噪声放大器选用飞利浦的BGA2001,它是一款可应用于低电压情况的单片微波集成放大器,最大电源电压为4.5 V;在1~1.6 GHz频段内,即包含卫星导航信号的工作频段内,增益高达20 dB,噪声系数低至1.3 dB。图2是设计的低噪放电路。
1.3.6 免疫荧光法检测各组细胞Bax、Bcl-2表达
各组细胞爬片、固定、破膜同上述免疫组化步骤,各组细胞破膜后,加4% BSA室温封闭30 min,甩掉封闭液后,滴加Bax抗体(1∶100)和Bcl-2抗体(1∶100)50~100 μL于爬片上,4℃过夜,洗去一抗,滴加山羊抗小鼠IgG(1∶300)和驴抗兔IgG(1∶200)二抗,室温避光孵育60 min,洗去二抗,滴加DAPI染液室温避光10 min,封片,荧光显微镜下随机选取6个视野,观察各组细胞的荧光表达。Bax为红色荧光,Bcl-2为绿色荧光,采用Image-Pro Plus 6.0软件分析Bax与Bcl-2的荧光强度值,并计算Bax/Bcl-2比值。
1.4 统计学方法

2 结果
2.1 倒置显微镜观察各组细胞形态
Control组细胞形态饱满,折光性较好;与control组相比,OGD/R处理后,PC12细胞的折光性降低,突触减少,细胞干瘪,细胞数量减少;与model组相比,calycosin中剂量组和calycosin低剂量组显著改善OGD/R诱导的细胞损伤,PC12细胞突触增多,胞体变圆,且与calycosin低剂量组相比,calycosin中剂量组细胞恢复较好;calycosin高剂量组与model组相比无明显差异。见图1。

注:A:正常对照组;B:模型组;C:毛蕊异黄酮高剂量组;D:毛蕊异黄酮中剂量组;E:毛蕊异黄酮低剂量组。
2.2 CCK-8法检测各组细胞活性
与control组相比,OGD/R处理后PC12细胞的活性明显降低(P<0.05);与model组对比,calycosin中剂量组和calycosin低剂量组可显著提高OGD/R诱导的PC12细胞活性(P<0.05),且与calycosin低剂量组相比,calycosin中剂量组细胞活性较高(P<0.05);calycosin高剂量组与model组对比无显著性差异(P>0.05)。见图2。

注:与对照组相比,*P<0.05;与模型组相比,#P<0.05;与毛蕊异黄酮低剂量组相比,ΔP<0.05。
2.3 LDH法检测各组细胞乳酸脱氢酶漏出率
与control组相比,OGD/R处理后PC12细胞的乳酸脱氢酶漏出率明显提高(P<0.05);与model组对比,calycosin中剂量组和calycosin低剂量组可显著降低OGD/R诱导的PC12细胞乳酸脱氢酶漏出率(P<0.05),且与calycosin低剂量组相比,calycosin中剂量组乳酸脱氢酶漏出率较低(P<0.05);calycosin高剂量组与model组对比无显著性差异(P>0.05)。见图3。
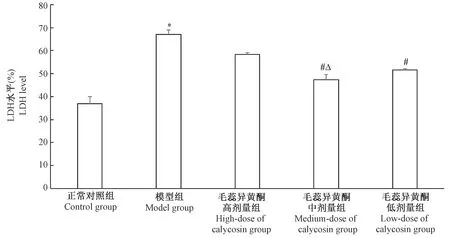
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05;与毛蕊异黄酮低剂量组相比,ΔP<0.05。
2.4 PI荧光染色观察各组细胞胞膜完整性
PI是一种不透膜的红色荧光染料,不能通过活细胞膜,但却能穿过破损的细胞膜而对核染色。与control组相比,OGD/R处理后,PC12细胞红染数明显增多(P<0.05);与model组相比,calycosin中剂量组和calycosin低剂量组红染细胞数减少(P<0.05),且与calycosin低剂量组相比,calycosin中剂量组细胞红染数较少(P<0.05);calycosin高剂量组与model组相比无明显差异(P>0.05)。见图4。
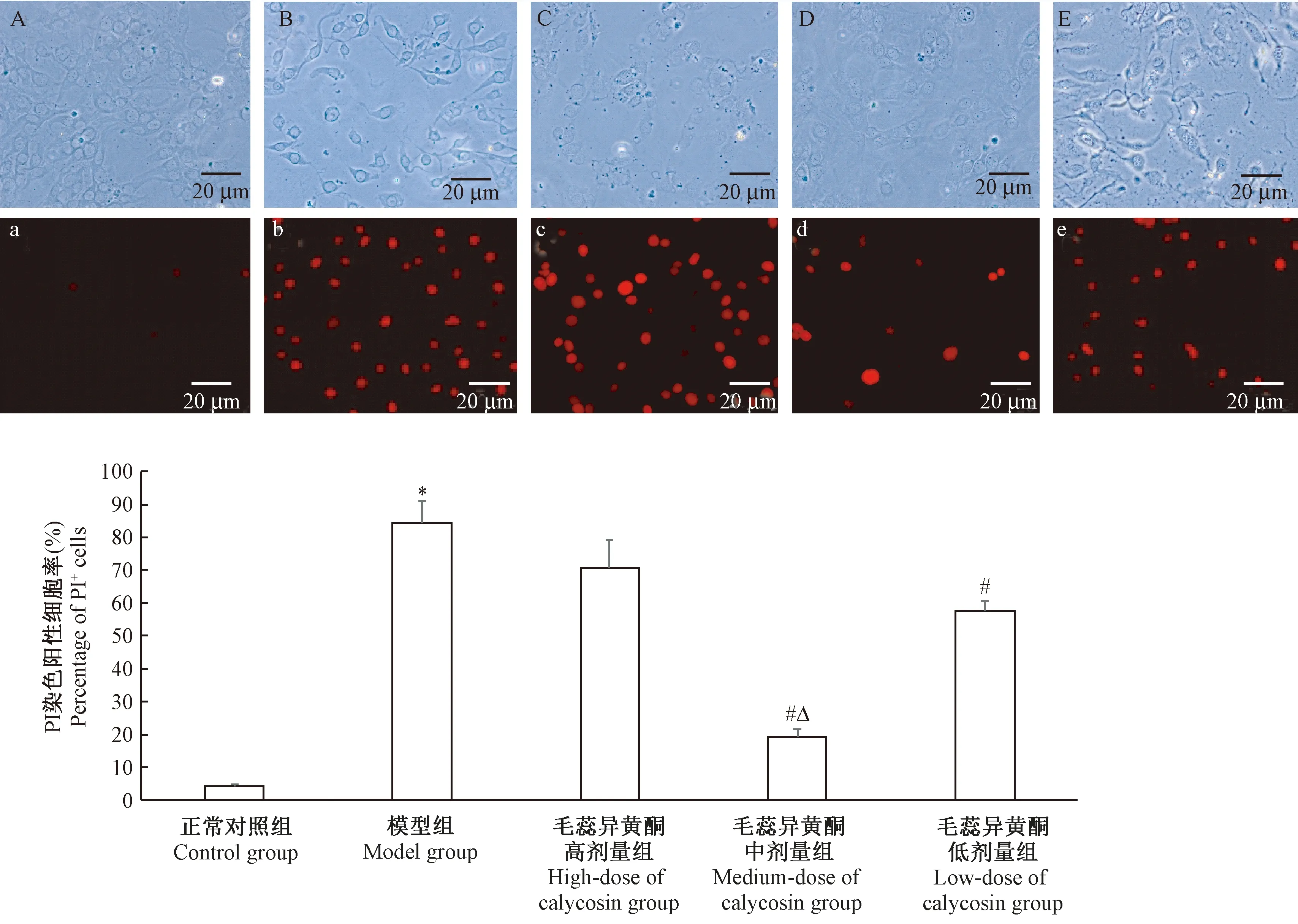
注:A、a:正常对照组;B、b:模型组;C、c:毛蕊异黄酮高剂量组;D、d:毛蕊异黄酮中剂量组;E、e:毛蕊异黄酮低剂量组。A~E:倒置荧光显微镜相差下拍摄图片(× 400);a~e:倒置荧光显微镜下拍摄的荧光图片(× 400)。与对照组相比,*P<0.05;与模型组相比,#P<0.05;与毛蕊异黄酮低剂量组相比,ΔP<0.05。
2.5 免疫组化法检测各组细胞caspase-3表达
与control组相比,OGD/R处理后PC12细胞caspase-3表达显著升高(P<0.05);与model组相比,calycosin中剂量组和calycosin低剂量组可明显减少caspase-3表达(P<0.05),且与calycosin低剂量组相比,calycosin中剂量组caspase-3表达较低(P<0.05);calycosin高剂量组与model组对比差异不明显(P>0.05)。见图5。
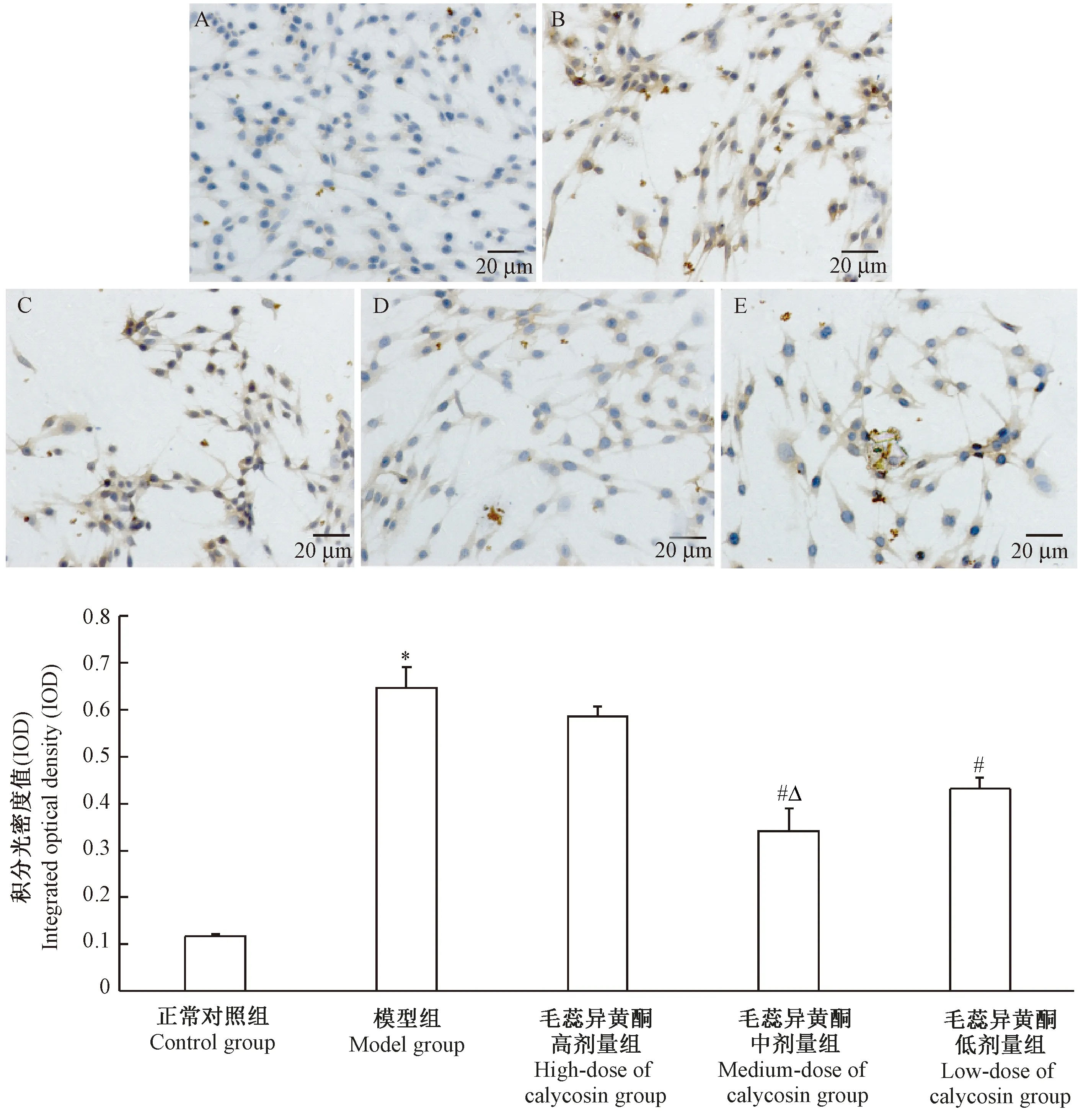
注:A:正常对照组;B:模型组;C:毛蕊异黄酮高剂量组;D:毛蕊异黄酮中剂量组;E:毛蕊异黄酮低剂量组。与对照组相比,*P<0.05;与模型组相比,#P<0.05;与毛蕊异黄酮低剂量组相比,ΔP<0.05。
2.6 免疫荧光法检测各组细胞Bax、Bcl-2表达
与control组相比,OGD/R处理后,细胞出现凋亡,Bax/Bcl-2比值明显升高(P<0.05);与model组相比,calycosin中剂量组和calycosin低剂量组Bax/Bcl-2比值明显降低(P<0.05),细胞凋亡程度减轻,且与calycosin低剂量组相比,calycosin中剂量组降低更明显(P<0.05);calycosin高剂量组与model组对比无显著差异(P>0.05)。见图6。
3 讨论
目前,早期恢复血流是治疗缺血性脑卒中的最好方法,但恢复血液供应也可能加剧缺血组织损伤,产生较为严重的病理反应——脑缺血再灌注损伤,其发生机制主要涉及细胞凋亡、钙超载、氧化应激、炎性反应等因素[2],各因素之间相互作用,致使脑组织产生不可逆性损伤。脑缺血后再灌注引起的迟发型神经细胞死亡多以细胞凋亡为主,在线粒体调控的细胞凋亡途径中,Bcl-2蛋白家族发挥着关键作用,caspase-3在启动线粒体途径细胞凋亡过程中扮演着重要角色。Bcl-2家族蛋白可以与孔蛋白相互作用,使位于线粒体内、外膜的通透转换孔PTP开放,大量的有机溶质进入细胞内,导致线粒体内膜膨胀破裂,CytC、AIF等释放入胞质,激活caspase级联反应,最终导致细胞凋亡[3]。Bax、Bcl-2是Bcl-2蛋白家族的重要成员,当细胞受到缺血等刺激时,位于胞质中的Bax向线粒体膜聚集,促使线粒体膜通透性改变,进而释放CytC,诱导caspase-3活化,引起细胞凋亡;而Bcl-2作为一种与线粒体相关的膜稳定蛋白,能够维持和保护膜的稳定性,与Bax形成异源二聚体,抑制caspase-3活化,阻止细胞凋亡的发生[4,5]。
中药黄芪是临床常用补气要药,始载于《神农本草经》,具有保元补虚、益卫固表、利尿消肿的功效。大量医籍记载和实验发现,黄芪不仅具有补气保元的作用,还具有良好的活血化瘀之功。古代医家根据中医“气为血之帅”、“血为气之母”、“气能生血”、“气行则血行”等理论,常以黄芪配伍成方,治疗中风之半身不遂后遗症。补阳还五汤即为治疗中风的代表方剂,重用君药黄芪,意在气旺则血行,瘀去则络脉通畅,在临床上应用至今,尤其在治疗缺血性中风方面疗效显著[6-10]。现代药理学研究发现,黄芪的主要活性成分包括黄酮、皂苷、多糖三大类成分[11]。研究者通过大量离体或在体实验,对黄芪主要活性成分进行了深入研究,发现黄芪三大主要成分在抗炎、抗氧化、调控自噬、调节血压、促进干细胞增值、改善认知功能障碍等方面均发挥着重要作用,其中黄芪黄酮类成分更是受到越来越多的关注[12-15]。
黄芪黄酮类化合物主要包括异黄酮、黄酮、异黄烷和紫檀烷四大类,毛蕊异黄酮(calycosin)是异黄酮类代表性有效单体成分,是检测黄芪质量的重要参考指标,具有抗氧化、促进细胞增殖、延缓衰老、抗炎、抗心肌肥厚等生物作用。LIU等[16]采用B3LYP方法对黄芪中毛蕊异黄酮、毛蕊异黄酮苷、芒柄花素、芒柄花苷4种成分进行了研究,发现毛蕊异黄酮的抗氧化活性最为显著,其抗氧化性明显高于其它3种成分。朱嘉欢等[17,18]研究表明毛蕊异黄酮与阿魏酸、黄芪甲苷、芒柄花素联合应用时,可以明显降低衰老造血干细胞(hematopoietic stem cells,HSCs)衰老时细胞周期蛋白Cyclin D1和CDK4 蛋白表达水平,能够抑制HSCs衰老和促进其增殖。赵海鹏等[19]研究发现,毛蕊异黄酮可通过激活AMPK通路,抑制炎症因子IL-6和IL-8活性和NF-κB的过度激活,从而减轻PM2.5诱导的小鼠肺泡上皮细胞系 MLE12细胞损伤和炎症反应。
毛蕊异黄酮作为黄芪黄酮类的重要有效单体成分,在抗氧化、抗炎、促进细胞增殖、延缓衰老等方面均有应用,但是目前尚缺乏毛蕊异黄酮防治缺血性脑卒中方面的研究,亟需探索。本研究通过体外实验,建立PC12细胞的缺氧缺糖/复氧复糖(OGD/R)模型模拟神经细胞缺血再灌注环境,在细胞水平,探讨了不同剂量(高剂量0.140 μmol/L、中剂量0.070 μmol/L、低剂量0.035 μmol/L)毛蕊异黄酮对OGD/R诱导的PC12细胞损伤的影响。实验结果显示,毛蕊异黄酮中、低剂量组可明显提高OGD/R诱导的PC12细胞活力,降低乳酸脱氢酶漏出率,有效改善OGD/R引起的PC12细胞皱缩、膜破坏等现象,降低促凋亡相关蛋白caspase-3、Bax表达,提高抗凋亡蛋白Bcl-2表达,从而显著减轻OGD/R诱导的PC12细胞损伤,其中毛蕊异黄酮中剂量组效果更为显著,而高剂量组与模型组比较无明显差异。表明毛蕊异黄酮可优化缺氧缺糖/复氧复糖PC12细胞生长状态,提高细胞存活率,抑制细胞凋亡,发挥保护作用,且其药物作用无剂量依赖性。目前,毛蕊异黄酮减轻OGD/R诱导的PC12细胞损伤是本课题组针对毛蕊异黄酮在防治缺血性脑卒中方面的一个初步探讨,其具体作用机制尚不明朗,本课题组将继续深入探讨毛蕊异黄酮拮抗脑缺血再灌注损伤、发挥神经保护作用的分子机制,为黄芪治疗缺血性脑卒中药效成分的筛选提供更有力的实验依据。
