长链非编码RNA LINC00152对人脑胶质瘤裸鼠移植瘤生长的影响及机制探讨
2019-12-04赵立智
金 亮,金 爱,赵立智
(1.沧州市人民医院神经外科,河北 沧州 061000;2.沧州市人民医院输血科,河北 沧州 061000)
脑胶质瘤(brain glioma)是常见的颅内原发性恶性肿瘤,当前其主要治疗手段为手术切除联合化学治疗和放射治疗[1]。脑胶质瘤恶性程度较高,且常规化疗药物难以通过血脑屏障,临床治疗效果往往不佳[2]。因此,如何有效治疗脑胶质瘤是临床面临的严重挑战。LINC00152属于长链非编码RNA(long noncoding RNA,LncRNA),并异常表达于肝癌、胃癌及结肠癌等恶性肿瘤细胞中[3-5]。文献报道,LINC00152参与恶性肿瘤细胞的增殖、迁移及转移等生物学行为[3-5]。最新研究显示,LINC00152与脑胶质瘤临床不良预后相关,下调LINC00152基因表达可抑制脑胶质瘤细胞的体内生长[6]。还有研究显示,上调LINC00152可促进胶质瘤细胞侵袭[7]。这些提示,LINC00152与胶质瘤细胞的恶性生物学行为相关,能促进脑胶质瘤的体内生长。Yes相关蛋白(Yes-associated protein,YAP)为一种转录共激活因子,主要在Hippo通路下游发挥细胞增殖和凋亡调控作用[8]。但YAP是否参与LINC0015对脑胶质瘤生长的调节还未有研究报道。本研究以慢病毒转染法上调脑胶质瘤U251细胞LINC00152表达水平并建立荷瘤鼠模型,观察LINC00152对脑胶质瘤生长的影响及YAP在其中的作用。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
雄性BALB/c nu/nu裸鼠60只,SPF级,5~6周龄,体重13~15 g,购自北京维通利华实验动物技术有限公司[SCXK (京)2016-0006],质量合格证号:No.11400700329359。动物饲养于沧州医学高等专科学校实验动物中心SPF级动物房[SYXK (冀)2019-006]IVC笼中,每笼6只,自由饮水、摄食,12 h光照/12 h黑暗,温度20℃~25℃,相对湿度40%~70%。体内实验通过了沧州医学高等专科学校实验动物中心动物管理和伦理委员会审批,审批号:CPH1702。按实验动物使用的3R原则给予人道的关怀。
1.1.2 细胞株
人脑胶质瘤U251细胞(目录号:TCHu 58)购自中国科学院上海细胞库。
1.2 主要试剂与仪器
XMU-MP-1(货号HY-100526)购自美国MCE公司;胎牛血清(fetal bovine serum,FBS)、MEM培养基和磷酸盐缓冲液(phosphate buffer solution,PBS)购自美国Gibco公司;Ki67抗体(货号sc-23900)购自美国Santa Cruz公司;YAP抗体(货号4912)、Phospho-YAP(Ser127)(货号D9W2I)抗体(货号13008)、Phospho-LATS1(Ser909)抗体(货号9157)购自美国CST公司;LATS1抗体购自美国Abcam公司(货号ab70561);GAPDH抗体(货号AP0063)、抗兔IgG-HRP二抗(货号BS13278)、抗鼠IgG-HRP二抗(货号BS12478)购自南京巴傲得公司;HS 15(货号42966)购自美国Sigma-Aldrich公司;TRIzol和RIPA细胞裂解液购自上海碧云天公司;SYBR Premix Ex TaqTMⅡ购自大连宝生物公司;ECL化学发光液购自美国Millipore公司;EnVision法免疫组织化学试剂盒购自丹麦Dako公司。全波段多功能酶标仪,美国BioTek公司;AI600凝胶成像仪,美国GE公司;FACSCalibur流式细胞仪,美国BD公司;7300型实时荧光定量PCR,美国ABI公司产品;Allegra 64R Centrifuge台式高速冷冻离心机,美国Beckman Coulter公司产品。
1.3 实验方法
1.3.1 慢病毒转染法构建LINC00152稳定表达细胞株
慢病毒转染法构建LINC00152过表达组(LV-LINC00152组)和空载对照组(LV组)细胞,同时以正常U251作为空白对照组(control组)。将U251细胞以每孔3×106个接种于六孔板中,当细胞汇合度达50%时进行转染。LV-LINC00152组和LV组细胞更换为含10 μg/mL Polybrene的MEM全培养基,加入以培养基稀释好的空载和LINC00152包装的病毒液,空白组细胞加入等量培养基,37℃、5% CO2过夜培养,12 h时更换为MEM全培养基,继续培养至对数期传代,嘌呤霉素筛选稳定表达的细胞株。
1.3.2 实时荧光定量PCR检测LINC00152表达水平
收集LV-LINC00152组、LV组和对照组细胞,TRIzol法提取细胞总RNA,用酶标仪对各组细胞总RNA浓度进行定量,各取1 μg进行反转录,稀释反转录好的cDNA至500 μL,充分混匀备用。各引物按正向引物与反向引物1∶1稀释,利用SYBR Premix Ex TaqTMⅡ在ABI 7300型实时荧光定量PCR系统中进行扩增,反应条件:95℃,10 s;95℃,10 s,60℃,60 s,40个循环,每组设置6个重复孔。2-△△Ct法计算LINC00152的相对表达水平。
1.3.3 蛋白印迹检测蛋白表达
将各组动物肿瘤组织剖下,切割0.5 g肿瘤组织并加入500 μL RIPA细胞裂解液(含蛋白酶抑制剂)研磨裂解10 min,12 000 r/min离心20 min,吸取上清液至预冷的EP管中,采用BCA蛋白定量试剂盒定量,制备蛋白样品。以SDS-PAGE电泳分离蛋白样品中的蛋白质(上样量为30 μg);将分离的蛋白湿法转印至PVDF膜上;转膜完成后以5%脱脂牛奶封闭PVDF膜2 h;然后按要求加入YAP(1∶2000)、p-YAP(1∶1000)、LATS1(1∶1000)、p-LATS1(1∶1000)或GAPDH抗体(1∶5000)4℃孵育过夜。次日,TBST洗膜3次,再加入相应的二抗(1∶5000),室温孵育1 h,以ECL化学发光液进行显色,凝胶成像仪进行成像,对蛋白印迹条带进行处理和分析,实验重复3次。
1.3.4 免疫组化及结果判断
所有组织标本按EnVision法进行免疫组织化学实验,参考说明书进行固定、脱水、石蜡包埋、脱蜡、切片、抗原修复、阻断内源性过氧化酶、封闭剂孵育一抗(1∶1000)、孵育EnVisionTM、孵育色源底物溶液和显色拍照。一抗为小鼠单克隆Ki-67抗体,需4℃过夜,阴性对照以PBS代替一抗。
Ki67蛋白定位于细胞核,出现棕黄色颗粒显色为阳性。随机选取6个高倍视野,采用免疫组织化学评分方法半定量分析,分别计算各视野中阳性细胞数平均百分比和染色强度。计数阳性细胞百分比,阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。评价阳性染色强度,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。最终评分为两项评分相乘:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.3.5 肿瘤模型的建立及分组给药
于每只裸鼠右腋下接种U251细胞2×106个,总体积0.1 mL(含0.05 mL Matrigel胶)。接种后观察肿瘤生长情况,最终以瘤体积100 mm3左右为标准进行筛选,剔除瘤体积过大或过小的动物,选取合格动物纳入实验。
实验一分组:分别以转染空载体的LV组细胞和过表达LINC00152的LV-LINC00152组细胞荷瘤,筛选合格的实验动物,前者设为LV组,后者设为LV-LINC00152组;
实验二分组:以LV-LINC00152组细胞荷瘤并筛选合格的实验动物分为生理盐水组(normal saline组)、XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组。
将XMU-MP-1溶解于HS 15中,并以生理盐水稀释XMU-MP-1溶液,同时配制含等量HS 15溶剂的生理盐水作为对照。XMU-MP-1给药剂量为1 mg/kg和3 mg/kg,每周给药3次,共给药3周,采用游标卡尺测量并记录肿瘤长径、短径,按照以下公式计算肿瘤体积:肿瘤体积=1/2 ×长径×短径2,瘤径测量时间分别为:分组前测量瘤径1次,首次给药后每周3次,安乐死前1次。动物安乐死后剖下肿瘤组织并称重,取适当肿瘤组织用于实验,其余进行固定保存。
1.4 统计学方法

2 结果
2.1 慢病毒转染法外源性上调模型细胞LINC00152表达水平
实时荧光定量PCR结果显示,对照组、LV组和LV-LINC00152组细胞中LINC00152 mRNA相对表达水平分别为(0.33±0.02)、(0.32±0.03)和(1.58±0.13),对照组和LV组无显著性差异(P>0.05);与LV组相比,LV-LINC00152组LINC00152 mRNA相对表达水平明显上调(P<0.01)。见图1。
2.2 LINC00152促进模型细胞移植瘤生长
实验期间,各组动物生长状态良好,体重随时间逐渐增加,组间无明显差异(P>0.05)。如图2A所示,分组给药后,随时间的增加,各组荷瘤鼠肿瘤体积逐渐增大。实验终点时,与LV组相比,LV-LINC00152组肿瘤体积显著增大(P<0.01)。实验终点时,LV组和LV-LINC00152组瘤重分别为(0.86±0.29)g和(1.21±0.40)g,与LV组相比,LV-LINC00152组瘤重增加明显(P<0.01),见图2B。
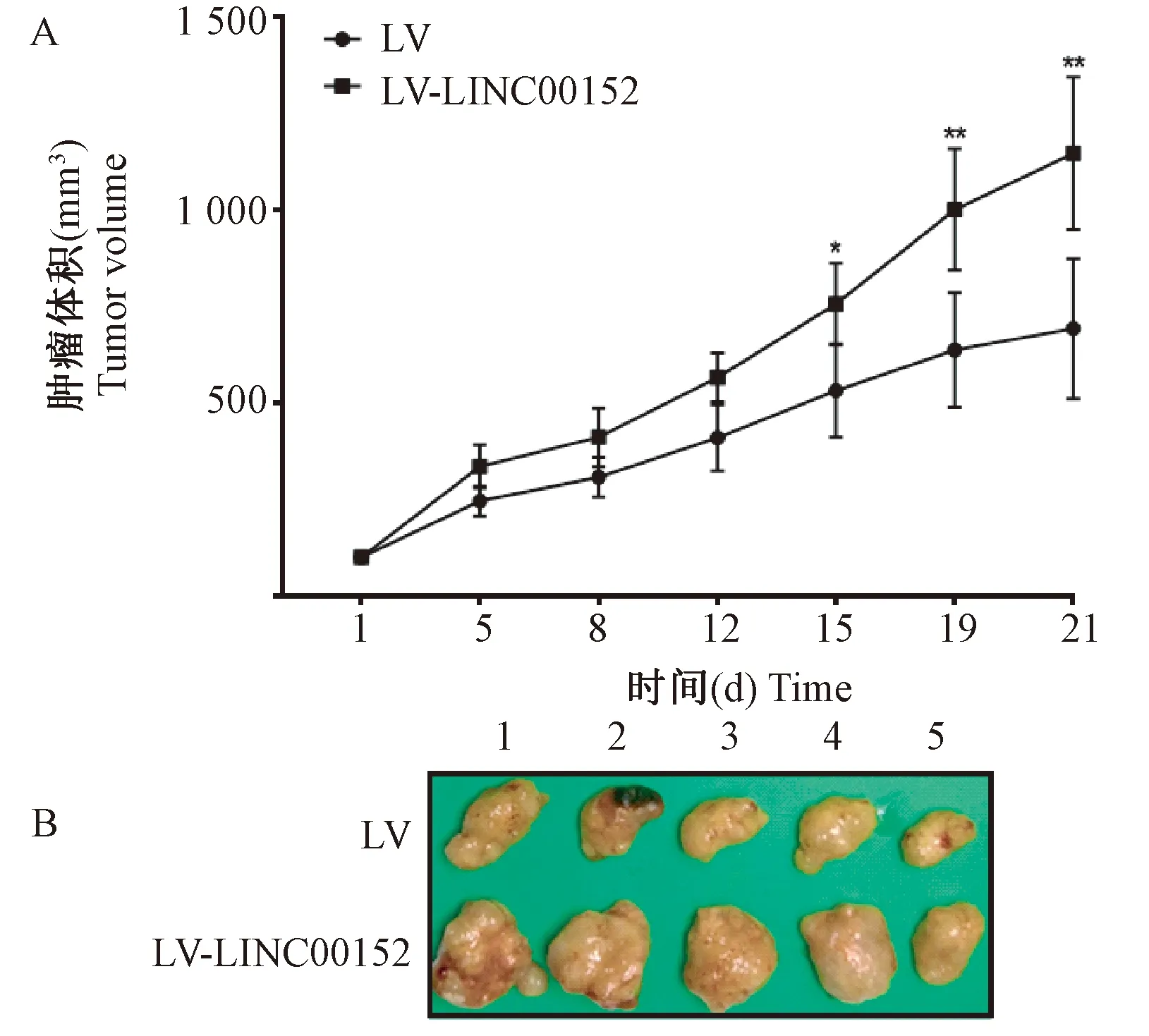
注:A:LV组和LV-LINC00152组肿瘤体积,与LV组相比,*P<0.05,**P<0.01;B:LV组和LV-LINC00152组肿瘤图片,1~5为各动物组内编号。
2.3 XMU-MP-1处理抑制LINC00152诱导的模型细胞移植瘤生长
如图3A所示,分组给药后,随时间的增加,各组荷瘤鼠肿瘤体积逐渐增大。实验终点时,与生理盐水组相比,XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组肿瘤体积显著减小(P<0.01),并呈剂量依赖性。实验终点时,生理盐水组、XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组瘤重分别为(1.08±0.41)g、(0.35±0.19)g和(0.68±0.28)g,与生理盐水组相比,XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组瘤重显著减小(P<0.01),并呈剂量依赖性,见图3B。
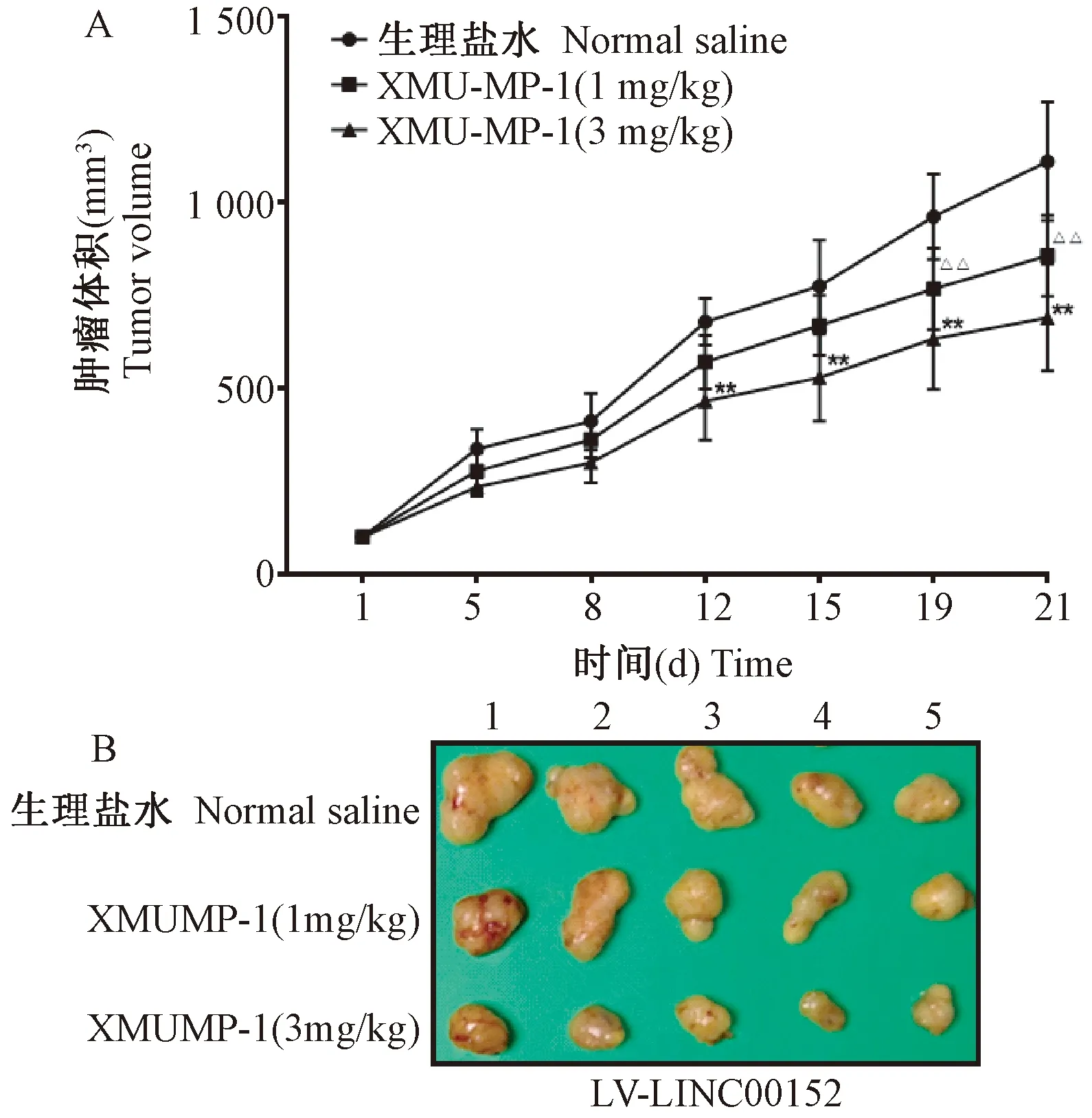
注:A:生理盐水组、XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组肿瘤体积,与生理盐水组相比,*P<0.05,**P<0.01;B:生理盐水组、XMU-MP-1(3 mg/kg)组和XMU-MP-1(1 mg/kg)组肿瘤图片,1~5为各动物组内编号。
2.4 各组肿瘤组织Ki67蛋白表达变化
免疫组织化学染色结果显示,LV组肿瘤组织Ki67呈弱阳性表达,而LV-LINC00152组肿瘤组织Ki67呈强阳性表达。以生理盐水组作为对照,XMU-MP-1处理LV-LINC00152细胞荷瘤鼠后发现,生理盐水组肿瘤组织Ki67呈强阳性,XMU-MP-1(1 mg/kg)组呈阳性,而XMU-MP-1(3 mg/kg)组呈弱阳性。见图4。
2.5 各组肿瘤组织p-YAP和p-LATS1蛋白表达变化
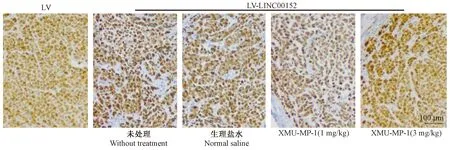
图4 各组肿瘤组织Ki67蛋白表达变化(免疫组织化学染色,× 200)
蛋白印记实验分析各组肿瘤组织p-YAP和p-LATS1蛋白表达变化,与LV组相比,LV-LINC00152组肿瘤组织p-YAP和p-LATS1蛋白表达明显上调(P<0.01)。以不同浓度XMU-MP-1处理LV-LINC00152组裸鼠,结果发现与生理盐水组相比,XMU-MP-1(3 mg/kg)和XMU-MP-1(1 mg/kg)处理后p-YAP和p-LATS1蛋白表达均显著下调(P<0.01),并存在剂量依赖性。见图5。
3 讨论
长链非编码RNA(long noncoding RNA,LncRNA)是碱基组成从200 nt到100 000 nt的非编码RNA,在细胞周期调控、表观遗传调控、转录调控及转录后调控等生物学过程中发挥重要作用,并涉及神经系统、心血管系统及恶性肿瘤等多种疾病[9-10]。随着研究的深入,越来越多的LncRNA被发现与脑胶质瘤、白血病、乳腺癌、肝癌等恶性肿瘤的发生发展相关[11-12]。LINC00152是LncRNA大家族的一员,异常表达于肝癌、胃癌及结肠癌等恶性肿瘤[13-14]。最新研究显示,LINC00152与脑胶质瘤临床不良预后相关,而下调LINC00152基因表达可抑制脑胶质瘤细胞的体内生长[6]。提示,LINC00152胶质瘤中可能发挥促癌效应,能促进脑胶质瘤细胞的体内生长。
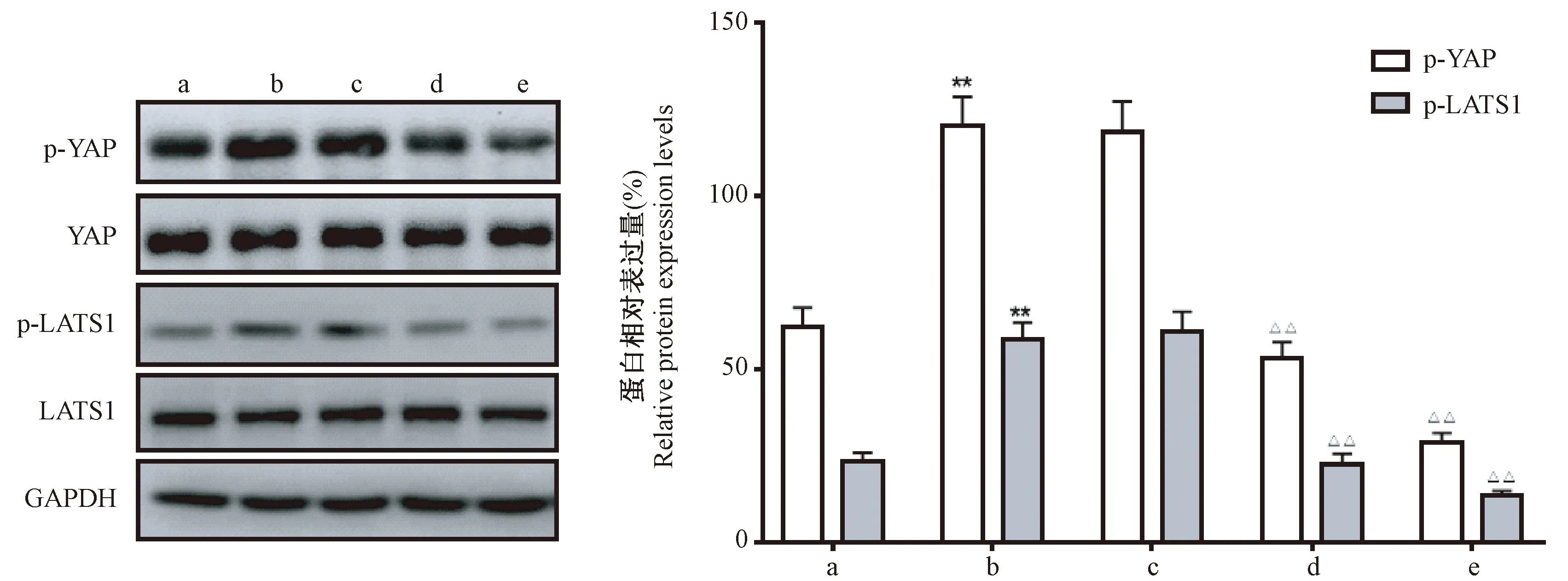
注:a:LV组;b:LV-LINC00152组;c:LV-LINC0015 +生理盐水组;d:LV-LINC0015 + 1 mg/kg XMU-MP-1组;e:LV-LINC0015 + 3 mg/kg XMU-MP-1组。与LV组相比,**P<0.01;与LV-LINC0015 +生理盐水组相比,△△P<0.01。
本研究通过慢病毒转染法外源性上调脑胶质瘤U251细胞中LINC00152表达水平,嘌呤霉素筛选稳定表达LINC00152的细胞株。以BALB/c裸鼠建立脑胶质瘤U251荷瘤鼠模型发现,实验终点LINC00152过表达U251荷瘤鼠肿瘤体积和瘤重明显增大。提示,LINC00152能促进U251荷瘤鼠肿瘤生长。这与文献报道相类似[6]。Ki67定位于细胞核,是目前临床常用的恶性肿瘤增殖活性衡量指标之一[15]。本研究观察了Ki67的表达变化,发现LINC00152过表达U251荷瘤鼠肿瘤组织中Ki67表达强于对照。表明LINC00152能增强U251荷瘤鼠肿瘤组织细胞的增殖活性。重要的是,本研究还发现U251荷瘤鼠肿瘤组织中p-YAP和p-LATS1蛋白表达显著上调。LATS1是YAP的上游信号靶点,当LATS1磷酸化后可引起下游效应物YAP磷酸化。文献报道,敲低脑胶质瘤LN229细胞中YAP的蛋白表达能显著抑制细胞增殖和Ki67蛋白表达[16]。提示,p-YAP参与U251荷瘤鼠肿瘤的增殖生长。XMU-MP-1是研究已证实的YAP抑制剂,能够抑制p-YAP的表达[17]。本研究进一步采用XMU-MP-1处理LINC00152过表达的U251荷瘤鼠。结果显示,XMU-MP-1能显著抑制p-YAP和p-LATS1表达,同时还可抑制TV和瘤重的增加以及Ki67蛋白表达。提示,抑制YAP磷酸化能遏制LINC00152介导的U251荷瘤鼠肿瘤生长。
综上所述,本研究发现,LINC00152能通过磷酸化YAP从而介导U251荷瘤鼠肿瘤生长。文献显示,在肝癌、肾癌中及膀胱癌等多种肿瘤细胞中,YAP磷酸化后从细胞核转位至细胞质中,从而失去其直接的转录活性[18-20]。提示本研究中YAP的生物学调节作用主要在细胞质中发挥。但其具体机制还有待于进一步研究。
