小鼠原发性肝癌模型的建立与优化
2019-12-04孙振宇武鸿彪徐胤淇陈雪健徐力善袁旦平
孙振宇,武鸿彪,刘 宁,徐胤淇,周 健,陈雪健,王 伟,徐力善,袁旦平*
(1.宁波市第一医院,浙江 宁波 315000;2.哈尔滨医科大学附属第四医院,哈尔滨 150001;3.军事科学院军事医学研究院生物工程研究所,北京 100850)
肝细胞癌(hepatocellular carcinoma,HCC)为肝的原发恶性肿瘤,每年全世界上有超过50多万人被诊断为HCC[1-2],HCC是由一系列相关病毒感染以及其他相关因素,诸如高度酒精、糖尿病及其并发症和黄曲霉毒素暴露等引起的慢性疾病进展而来[3-4]。HCC的发生与发展是一个多步骤多因素的过程,其中涉及到多种基因蛋白,这些基因蛋白包括p53和b-连环蛋白等等[5],它们与细胞的增殖、细胞周期的进程,以及细胞的凋亡与侵袭有着极其密切的相关性。受到生长因子调节的信号通路[6],细胞分化相关通路和血管生成诱导的信号通路也可以促进HCC的发生与发展。另外,相关基因的改变也可以导致HCC的发生。二乙基亚硝胺(diethylnitrosamine,DEN)是一种具备高度遗传毒性的致癌物质,研究人员通过比较基因组学分析之后得知DEN所诱导的肝癌模型中的基因表达与人类肝细胞癌的患者肝组织类似[7]。研究表明DEN在小鼠的体内最终可以转化成为烷基化代谢物,此代谢物可以导致DNA加合物的形成,随后转化成中间体,促使了甲基化,DEN的成瘤过程中最关键的是由于DNA中的O6与N-7甲基鸟嘌呤的形成,使得遗传信息的改变,形成启动致癌的细胞[8]。合理有效的建立原发性肝癌动物模型是研究肝细胞癌发生发展及致病机制的重中之重,目前常用的肝癌动物模型通常选用小鼠(BALB/c、C57BL/6、ICR),目前诱导小鼠肝癌常用化学诱导法,采用DEN溶液或DEN与CCl4联用对小鼠腹腔注射进行肝癌建模,此方法经济节约,操作简便,稳定性高,可以避免因小鼠个体差异带来的误差,较好的模拟了肝癌在人体中自然形成过程。而目前腹腔注射法存在诱癌时间较长的缺点。本文旨在较短的时间内,成功建立小鼠肝癌模型,在此基础上衡量各自的优缺点,克服难点,更精准更合理的进行小鼠肝癌造模,为研究肝癌的发生与发展奠定基础。
1 材料和方法
1.1 实验动物
SPF级C57BL/6雄性小鼠80只,14~16日龄,体重约为4 g,均购自北京维通利华实验动物技术有限公司[SCXK (京)2016-0011]。饲养于军事科学院军事医学研究院生物工程研究所实验动物中心[SYXK (军)2016-0010],恒温恒湿,湿度(60±5)%,温度24℃,光照遵循昼夜节律,每笼饲养5只C57BL/6小鼠。本实验通过哈尔滨医科大学实验动物中心和实验动物伦理委员会批准(110052018016),并且严格按照实验动物使用的3R原则给予人道主义的关怀照顾。
1.2 主要试剂与仪器
二乙基亚硝胺(DEN,Sigma公司);四氯化碳(CCl4,Sigma公司);甲胎蛋白(AFP)与高尔基体蛋白73(GP73)ELISA试剂盒(北京热景生物技术股份有限公司)。全自动生化分析仪(美国贝克曼库尔特公司);-80℃冰箱(海尔公司)。
1.3 实验方法
1.3.1 实验小鼠的分组及造模
将实验小鼠随机分为4组,每组20只,分别命名为低剂量DEN组、高剂量DEN组、DEN+CCl4组、对照组,随后分笼饲养。低剂量DEN组腹腔注射DEN(25 mg/kg)。高剂量DEN组腹腔注射DEN(40 mg/kg)。DEN+CCl4组腹腔注射DEN(2 mg/kg),两周后腹腔注射CCl4(5 mL/kg,20%),每周给药2次共16周。对照组不予染毒处理,饲养环境及饮食饮水与实验组保持一致。在造模的第24周集中麻醉断颈法处死各组小鼠,剖开腹腔,取得肝样本拍照,将部分肝组织冻存于-80°C冰箱中备用,比较各组间肝的外观,肿瘤的发生率,及肿瘤的大小与面积占比。
1.3.2 各组实验小鼠的存活状态及存活时间的观察
各组小鼠造模后观察小鼠的存活情况,如有小鼠死亡,则详细记录死亡时间,绘制存活曲线,比较各组差异。
1.3.3 小鼠血清ALT和AST的检测
在造模的第24周集中麻醉断颈法处死各组小鼠,收集血液标本并置于37°C温箱放置30 min。随后将收集的小鼠血液2000 r/min离心10 min以收集足量的血清,分别取100 μL小鼠血清存放入EP管中注明各组组别并送至北京武警总医院生化分析室,使用全自动生化分析仪检测。
1.3.4 小鼠血清GP73、AFP的检测
按照1.3.3方法取得足量小鼠血清,使用鼠源GP73、AFP的ELISA试剂盒,体外定量检测鼠血清中GP73、AFP的表达水平(酶联免疫吸附技术)。具体的操作方法严格遵循试剂盒说明书进行操作。
1.4 统计学方法

2 结果
2.1 各组小鼠的生存曲线统计与分析
生存曲线的统计时间为24周,从造模开始直至第24周造模结束。由图1可知低剂量DEN组与高剂量DEN组小鼠DEN染毒后造模开始的1周内死亡率较高,第2周直至第24周两组小鼠几乎无死亡,而DEN+CCl4组小鼠在造模初期无死亡,直至造模第4周后开始呈现出较高的死亡率(P<0.001)。
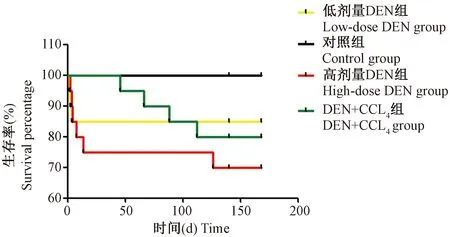
注:各组小鼠的存活曲线比较。
2.2 各组小鼠肝样本肉眼观察
在造模过程中,低剂量DEN组、高剂量DEN组、DEN+CCl4组小鼠均出现食欲不振、体重下降、精神萎靡、退毛等等非正常现象,而对照组的小鼠精神状态良好,毛发光亮,食欲佳。在造模的第24周集中麻醉断颈处死小鼠,取得肝样本并拍照,由图2所示,高浓度DEN组小鼠的肝整体可见大面积坏死,水肿,肉眼可见大量的癌结节。低浓度DEN组与DEN+CCl4组小鼠肝的表面较为光滑,癌结节的数量少于高剂量DEN组。
2.3 各组小鼠的肿瘤数目及肿瘤发生率的比较
取得各组小鼠肝样本后对肝的肿瘤数目及发生率进行分析,如图3所示,对照组小鼠肝无肿瘤生长,肝癌发生率为0%,低剂量DEN组小鼠肝肉眼可见9处肿瘤,肝癌发生率为35%,高剂量DEN组小鼠肝肉眼可见9处肿瘤,肝癌发生率为86%,DEN+CCl4组小鼠肝肉眼可见20处肿瘤,肝癌发生率为56%。
2.4 各组小鼠血清ALT、AST、AFP、GP73的表达水平
在造模的第24周处死各组小鼠取得血清标本后分别对小鼠血清ALT、AST、AFP、GP73的表达水平进行检测。如表1所示,低剂量DEN组、高剂量DEN组、DEN+CCl4组小鼠的血清ALT、AST、AFP、GP73表达水平显著高于对照组(P<0.001)。ALT与AST可以发映出肝的炎性损伤程度,AFP与GP73是肝癌的肿瘤标记物,其数值明显高于对照组均可反映出肝癌造模成功。值得注意的是GP73在高剂量DEN组小鼠的血清表达水平升高得更为明显。
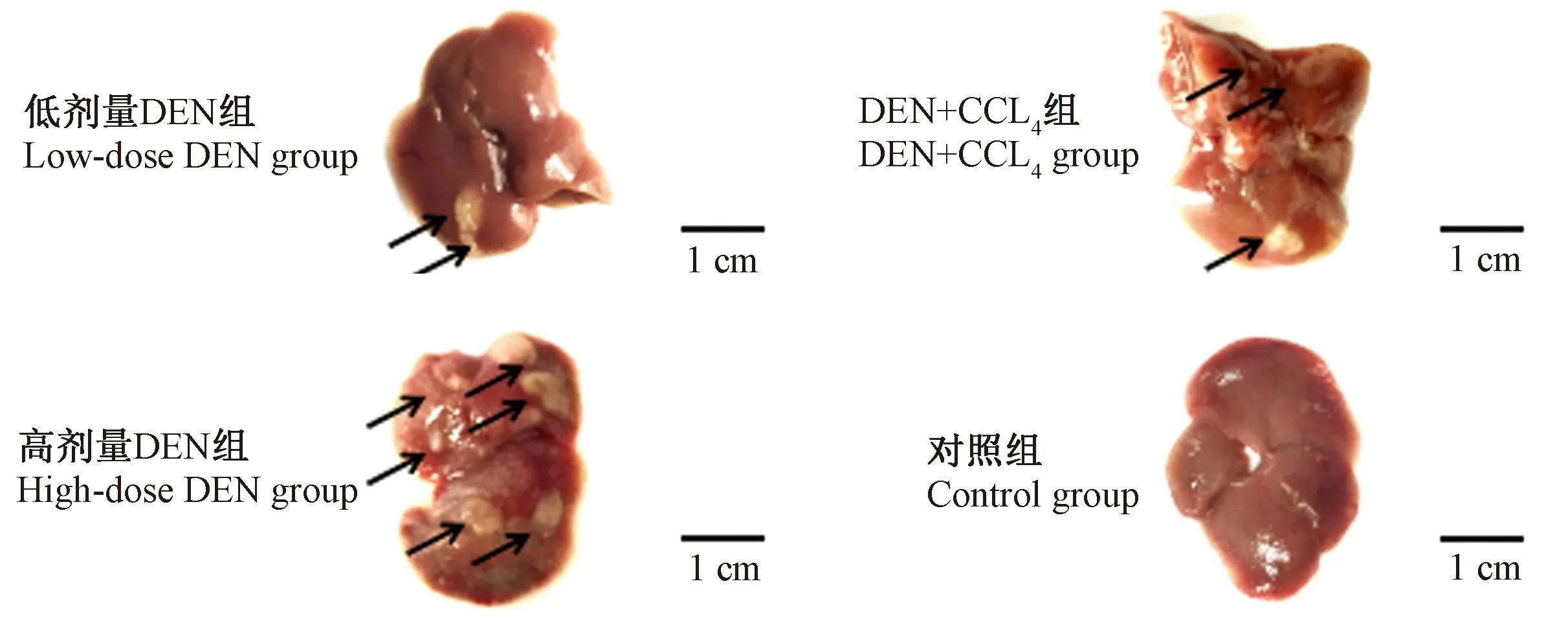
注:箭头表示肿瘤之所在。
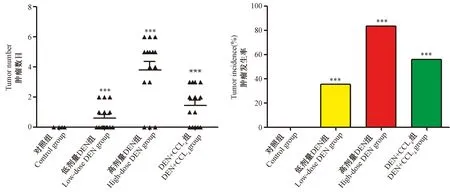
注:与对照组相比,***P<0.001。

Table1Serum expression levels of ALT, AST, AFP, and GP73 in each group of mice
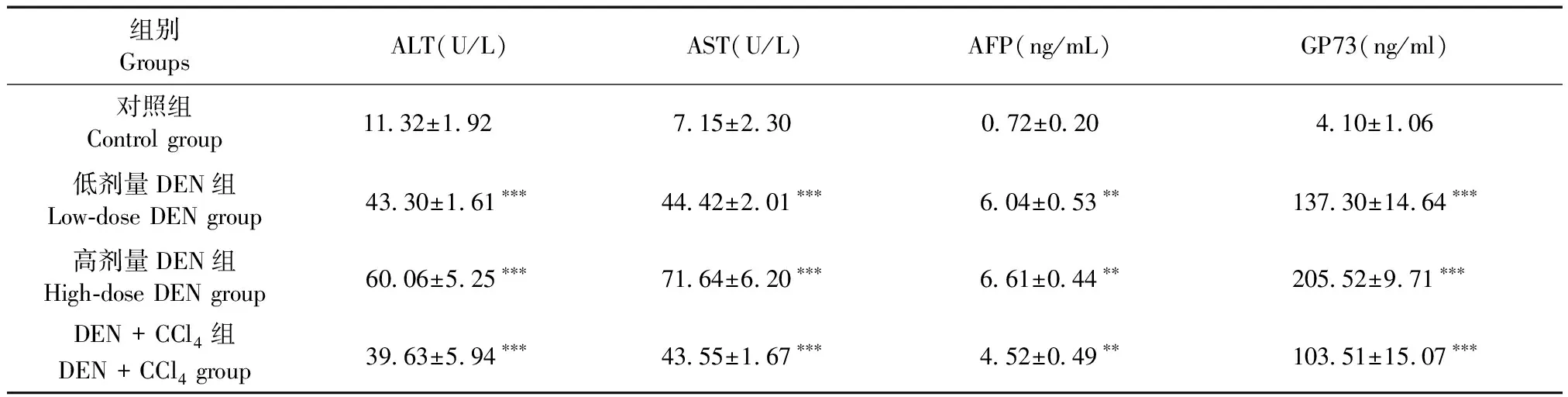
组别GroupsALT(U/L)AST(U/L)AFP(ng/mL)GP73(ng/ml)对照组Control group11.32±1.92 7.15±2.30 0.72±0.20 4.10±1.06 低剂量DEN组Low-dose DEN group43.30±1.61∗∗∗44.42±2.01∗∗∗6.04±0.53∗∗137.30±14.64∗∗∗高剂量DEN组High-dose DEN group60.06±5.25∗∗∗71.64±6.20∗∗∗6.61±0.44∗∗205.52±9.71∗∗∗DEN + CCl4组DEN + CCl4 group39.63±5.94∗∗∗43.55±1.67∗∗∗4.52±0.49∗∗103.51±15.07∗∗∗
注:与对照组相比,**P<0.01,***P<0.001。
Note.Compared with the control group,**P< 0.01,***P< 0.001.
3 讨论
肝细胞癌的发生与发展是一个多步骤、多因素的进程[9]。在肝细胞癌中,可以观察到急、慢性肝损伤,肝的炎性病变,肝细胞的变性、再生、坏死等等与小细胞形态学相关的肿瘤癌前病变[10]。肝细胞癌的发病率往往表现出与区域性和种族相关的差异[11]。一些DNA损伤性化学物质与细胞毒性物质被认为是肝细胞癌发生的根本原因,诸如二乙基亚硝胺(DEN),四氯化碳(CCl4),全氟化学品,全氟辛酸,苯并芘,丙烯酰胺,膳食污染物等等[12-14]。进行肝细胞癌的研究,建立稳定有效的动物模型是必不可少的,也是肝癌的发生发展研究的基本必要条件之一。
目前建立小鼠的肝癌模型以化学诱导法多见,其中又以二乙基亚硝胺(DEN)与四氯化碳(CCl4)为主要的诱癌剂。使用化学诱导法造模大多选择用两周龄小鼠[15-16],有研究指出,幼鼠的肝组织极易发生癌变,而且酶的活性会随着小鼠年龄增长,大概在1~2周时达峰值[17]。由于化学诱导法建立小鼠原发性肝癌模型的时间多为24~48周[18-19],故选用建模后第24周集中处死各组小鼠。本实验选用两种不同浓度的DEN(25 mg/kg,40 mg/kg)以及DEN与CCl4联合应用进行小鼠原发性肝癌造模。DEN与CCl4联合应用的方法需每间隔一段时间进行CCl4的注射,这使得造模过程过于繁琐,每一次对实验动物的注射无法保证绝对相同的剂量和与上次注射相近的实验环境。此法最终虽可成功建立小鼠原发性肝癌模型,但是肝细胞癌的形成是一个动态且持续的过程,不断的施加干扰措施会影响到小鼠肝细胞癌形成过程中的诸多指标,尤其对需要持续的进行称重、监测生存曲线、检测血清各项生化指标的动态变化实验尤为不利,加大了不稳定因素的干扰,往往使实验结果不够理想。
单独使用DEN建模可成功的建立肝癌模型,但是在剂量上始终没有明确的统一规定[20],通过本实验结果可知高剂量DEN组(40 mg/kg)于24周时成瘤率可达86%,而低剂量DEN组与DEN+CCl4组于24周的成瘤率分别为35%与56%,结果表明高剂量的DEN(40 mg/kg)可以更快速稳定的建立小鼠原发性肝癌的模型。前文数据可知本次实验高剂量DEN组小鼠死亡率达30%,由于DEN本身的急性肝毒性较大,对于幼鼠在造模的早期易使其夭折并可致更高的死亡率,故采取本法需要准备足量的小鼠进行造模,最大限度的减少由于造模初期存在的高死亡率所造成的实验误差。单独使用DEN并在25 mg/kg的基础上增加剂量到40 mg/kg 建立小鼠肝癌模型,此法虽有不足之处,但是其优势较低剂量DEN(25 mg/kg)与DEN+CCl4联合使用更加突出,主要在于更快速的建立小鼠原发性肝癌模型,大幅度的缩短了实验时间,一次注射之后避免了后续的再次注射染毒操作,使得实验难度降低的同时也使得模型建立的过程比较平稳,无过多的外界干扰因素,尤其是对于需要进行在造模过程中动态监测小鼠血清生化指标的实验极具优势,可以最大限度的避免实验误差,使得实验结果更为理想。有研究认为GP73是肝癌最有价值的标志之一,并通过多种途径参与肝癌的发展[21]。GP73也在胆囊癌,胰腺癌,肺癌,膀胱癌和其他癌症中高表达,GP73的高表达和预后不良与种种恶性生物学行为(如肿瘤大小、侵袭、迁移)密切相关[22-24]。由此可知GP73相对于AFP具有更高的敏感性,对于肝癌手术的预后的评估,GP73也表达出更精准的可靠性[25]。因此,本实验检测了小鼠血清GP73的表达水平,值得注意的是,高剂量(40 mg/kg)DEN组的小鼠血清GP73的升高水平尤为明显,这也间接的反映出了高剂量(40 mg/kg)DEN建立的小鼠原发性肝癌模型更具说服力。
综上,高剂量(40 mg/kg)DEN建立小鼠原发性肝癌模型简单易行,造模时间短,肿瘤发生率及肝癌的严重程度更高,这为进一步研究肝癌的发生与发展提供了更为合理有效的动物模型。
